稀土配合物的水热合成与结构表征
2015-02-21马丽斯唐小冬
马丽斯, 刘 静 , 唐小冬
(1.空军工程大学 理学院,陕西 西安 710051; 2.西安工程大学 环境与化学工程学院,陕西 西安 710048)
稀土配合物的水热合成与结构表征
马丽斯1, 刘 静1, 唐小冬2
(1.空军工程大学 理学院,陕西 西安 710051; 2.西安工程大学 环境与化学工程学院,陕西 西安 710048)
稀土离子与配体结合后,可以很大程度地修饰、增强稀土离子和配体原有的特性。针对酰腙配体及其稀土金属配合物的合成工艺还不够成熟这一问题,开展水热法合成稀土配合物及其相关性质的研究工作。介绍了通过水热合成法,设计合成对甲氧基苯基乙酮4-氯苯甲酰腙与五种稀土硝酸盐配合物。结果表明,经元素分析、紫外光谱、红外光谱、X射线粉末衍射的物化分析手段确定了稀土配合物的组成为[Re(C16H15N2O2Cl)2]·2H2O(Re=La、Ce、Sm、Nd、Eu),同时根据每种稀土离子都有相似的原子轨道和配位环境,结合以上的结构表征,推测出配合物可能的配位结构。
酰腙; 稀土配合物; 合成; 结构表征
0 引 言
酰腙类化合物作为一种特殊的希夫碱,以其强的配位能力、优良的生物药理活性和潜在的抗癌抗肿瘤活性[1-3],成为科学家们感兴趣的研究领域之一。稀土元素特殊的电子构型,使其在光、电、磁等方面具有独特的性质。稀土离子与配体结合之后,可以很大程度地修饰、增强稀土离子及配体原有的特性。近年来,国内外出现了对酰腙类稀土配合物晶体结构的描述[4]和生物活性的报道[5],Rao等[6]合成出带氨基的乙酸腙和异烟酰腙的稀土配合物,并对配合物的光谱性质进行了详细的分析对比。谭志诚等[7-8]对2-噻吩乙酸、稀土氨基酸配合物的低温热容及热化学性质进行了分析计算。陈凤英等[9]对2-羰基丙酸水杨酰腙稀土配合物的溶解焓进行了测定,并研究了稀土配合物溶解焓数据与稀土元素原子序数的关系。何水样等[10]合成的水杨醛水杨酰腙中C=N因发生π—π*跃迁,酰腙吸收峰出现在316 nm处,和稀土离子配位后,由于C=N的氮原子参与配位,该吸收峰红移至353 nm处。Sharmeli等[11]对稀土异烟酰腙配合物的热化学参数进行了测定和分析计算。本文设计采用已合成出的对甲氧基苯基乙酮苯甲酰腙配体[12],采用水热合成法与5种稀土硝酸盐配位,通过元素分析、红外、紫外、X射线粉末衍射的物化分析手段对酰腙及其稀土配合物的结构特点和配位性能进行研究,为酰腙类配体的合理设计提供思路,也为实际应用提供依据。
1 实验部分
1.1 主要试剂和仪器
实验中所用到的试剂均为分析纯。实验仪器:vario ELⅢ元素分析仪(德国元素分析系统公司);5700红外光谱分析仪(美国Thermo公司);UV-2450紫外可见分光光度计(日本岛津公司);D/max-3c X-射线衍射仪(日本Rigalcu公司)
1.2 对甲氧基苯基乙酮4-氯苯甲酰腙稀土配合物的合成
配合物的合成采用水热合成法。按照1∶2的物料比,分别称取一定量稀土硝酸盐和对甲氧基苯基乙酮4-氯苯甲酰腙[11]于反应釜中,加入15 mL溶剂,如甲醇、乙醇、丙酮,120 °C反应72 h,关闭电源,冷却至室温,过滤。滤液分两份,分别装在25 mL小烧杯中和20 mL试管中,保鲜膜封存,细针扎3或4个小孔,室温下缓慢挥发,得到土黄色固体粉末。
2 结果与讨论
2.1 元素分析
采用vario ELⅢ型元素分析仪对对甲氧基苯基乙酮4-氯苯甲酰腙和其稀土配合物进行C、H、N元素的分析。配合物中的稀土元素采用络合滴定法测定其含量。元素分析实际值如表1所示,括号内为理论计算值。由表可以看出,实际值与理论值很接近,说明推测的配合物组成与实际组成相符合。

表1 配体及稀土配合物的元素分析 %
2.2 红外光谱分析
以溴化钾作压片,在红外区400~4 000 cm-1范围内测定了对甲氧基苯基乙酮4-氯苯甲酰腙与对甲氧基苯基乙酮4-氯苯甲酰腙稀土配合物的红外光谱,主要吸收峰的数据列于表2,红外光谱图见图1。

表2 配体和配合物的红外数据 cm-1
从红外图谱可以看出,各配合物的红外图谱比较
相近,配合物的主要吸收峰数据也比较接近,说明配合物的组成较相似。比较配体的红外光谱的振动吸收峰的位置可以看出,配合物的振动吸收峰都有明显的红移现象,而且强度也有很大变化,峰面积也有所增大,表明配体与稀土盐发生了反应。
自由配体在1 251 cm-1处出现C—O单键的伸缩振动,而在配合物中C—O单键的伸缩振动红移到716~1 184 cm-1,伸缩振动强度也比配体弱一些,意味着配体甲氧基中的氧原子参与了五种金属的配位,配合物在约886 cm-1处出现ν(RE—O)峰,也证实了这一点。配体中另一个特征基团C=N吸收峰出现在1 511 cm-1附近,而配合物中该特征基团红移至1 367~1 495 cm-1,吸收强度减弱,我们认为酰腙基团中的亚氨基氮参与了配位。
自由配体N—H的伸缩振动吸收峰出现在3 208 cm-1,而配合物中N—H的伸缩振动吸收峰移至3 416 ~3 461 cm-1,表明配体不再以游离态存在[13],可能由于氮原子上的孤对电子与水分子形成氢键,才使吸收峰移动,与配体相比,其强度也明显减弱。自由配体中C=O在1 687 cm-1处出现伸缩振动,而配合物中的伸缩振动红移到1 607~1 637 cm-1,伸缩振动强度明显减弱,我们认为羰基中的氧原子参与了金属离子配位,配位时两分子的配体与一个金属离子配位,分子中的氮氧原子参与配位。

(a) 对甲氧基苯基乙酮4-氯苯甲酰腙

(b) La配合物

(c) Ce配合物

(d) Nd配合物

(e) Sm配合物

(f) Eu配合物
图1 试样的红外光谱图
2.3 紫外光谱分析
分别配制10-4mol/L对甲氧基苯基乙酮4-氯苯甲酰腙及其稀土配合物的富马酸二甲脂(DMF)溶液20 mL,采用UV-2450型紫外-可见分光光度计对对甲氧基苯基乙酮4-氯苯甲酰腙及其稀土配合物的紫外光谱进行测定。配体及配合物的紫外数据见表3,配体及配合物的紫外光谱图见图2。
从紫外数据和图谱可以看出,配体及配合物均有三处较强的吸收波长,配合物之间的吸收波长比较接近,配体和配合物的吸收波长相差较大,据此可推测配体已经配位。在配合物中,3个吸收峰分别红移到312~319、355~358和429~431 nm处,可认为是酰腙羰基参与配位后共轭体系增大的结果,分子内氢键的存在也会影响吸收峰位。表中第1列吸收波长属于R吸收带,R吸收带是由于配体和配合物中的C=O双键的n→π*电子跃迁而产生;第2列吸收波长属于K吸收带,由共轭结构中的π→π*电子跃迁而产生;第3列属于B吸收带,也叫苯环型谱带,是由苯环上π→π*电子跃迁与苯环振动能级跃迁重叠而产生[14]。
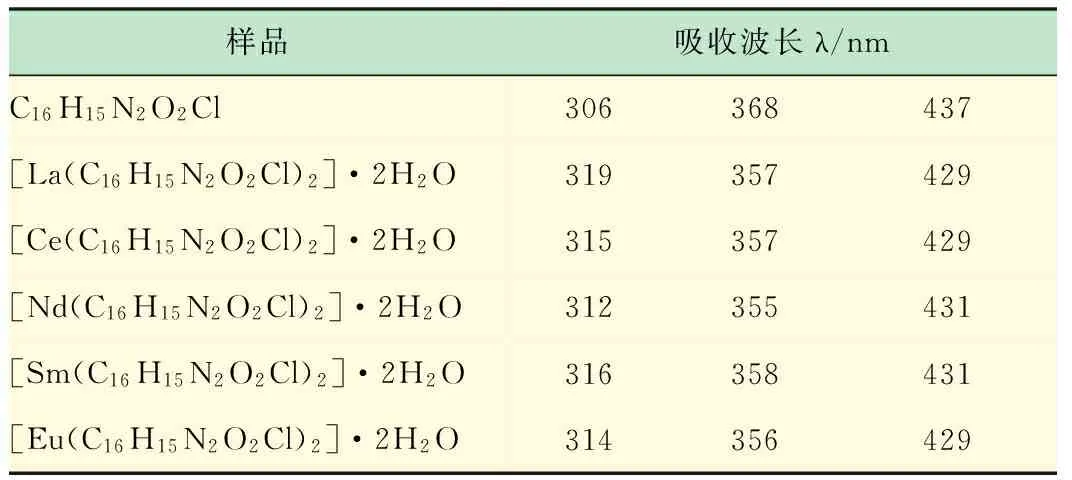
表3 配体及配合物的紫外数据
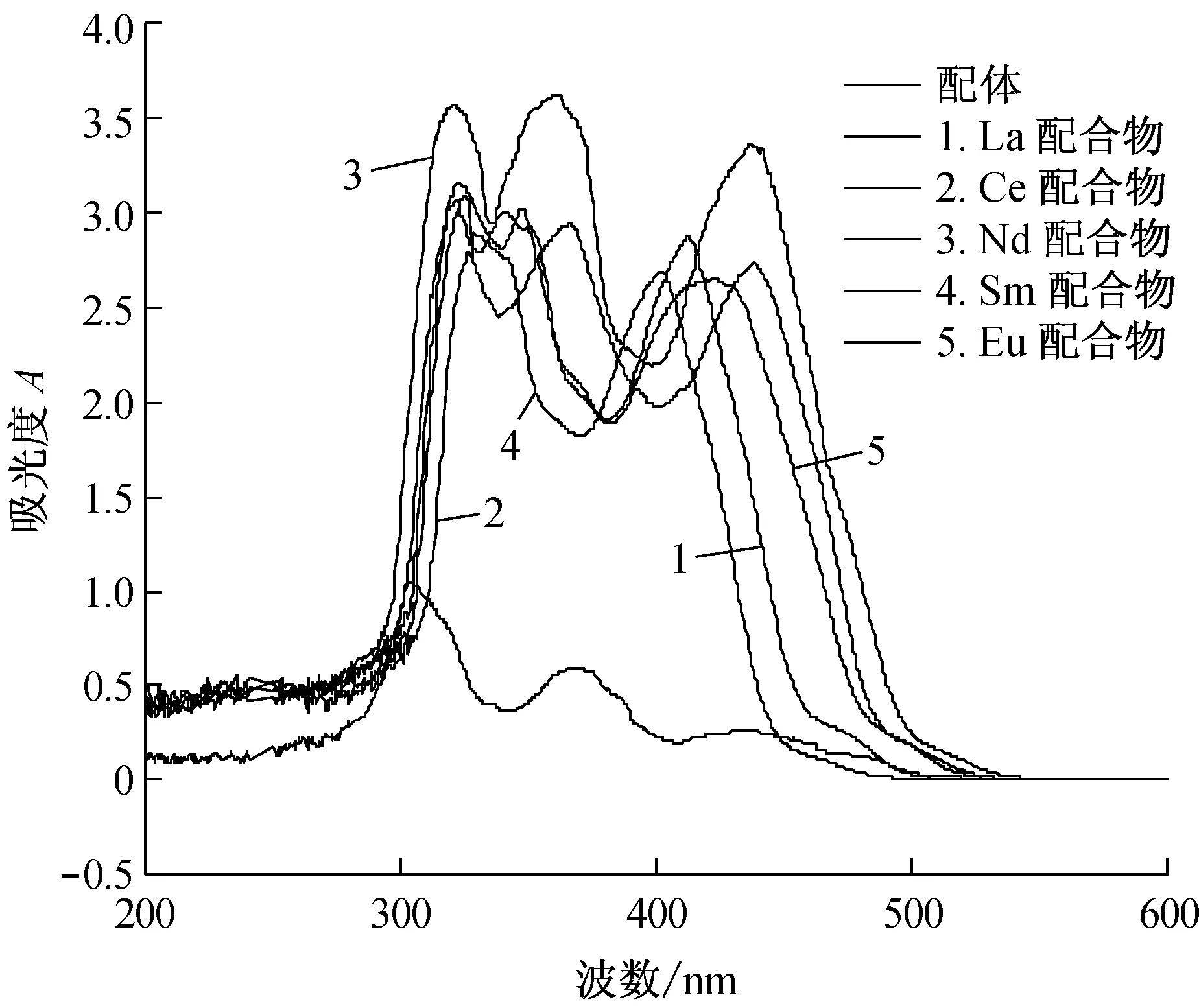
图2 对甲氧基苯基乙酮4-氯苯甲酰腙及其稀土配合物的紫外光谱图
整体来说,配合物的吸收峰强度都有很大幅度的变化,峰面积也有所增大。配合物吸收峰都发生了一定程度的红移,这可能是酰腙配体与稀土离子结合后使整个共轭体系增大的缘故。此外,Nd配合物的吸收峰值最大。
2.4 X-射线粉末衍射分析
以La配合物为代表,采用日本理学D/max-Ⅲ型X射线衍射仪进行X射线粉末衍射测定,测试起始角为5°,终止角为50°,步长为0.02°,扫描速率16 °/min,Cu靶(λ=0.154 178 nm),管电压为40 kV,管电流30 mA,狭缝DS1、RS.3、SS1,滤波片为石墨单色器。
对甲氧基苯基乙酮4-氯苯甲酰腙及其La配合物的X射线粉末衍射数据见表4,La(NO3)3·4H2O的X-射线粉末衍射数据来自MDI Jade5.0软件的粉末衍射数据集(PDF),稀土盐的卡片号为PDF#22-1176。从表4及衍射图谱3~5可以看出,La配合物的衍射强度和衍射峰的位置明显有别于酰腙配体和稀土盐,也不是酰腙配体和稀土盐的衍射数据的简单叠加,这表明有新的物相生成,即新的配合物(见图6)。

表4 X射线粉末衍射数据
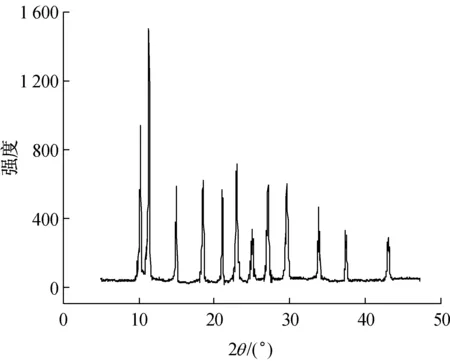
图3 对甲氧基苯基乙酮4-氯苯甲酰腙的X射线粉末衍射图谱
3 结 语
采用水热合成法,以丙酮、甲醇等为溶剂,用对甲氧基苯基乙酮4-苯甲酰腙与五种稀土硝酸盐反应,合成出5种二元稀土酰腙配合物,得出以下结论:

图4 La配合物的X射线粉末衍射图谱
(1) 采用元素分析、红外光谱、紫外光谱、X射线粉末衍射的物化分析手段确定出对甲氧基苯基乙酮4-苯甲酰腙配合物的组成为[RE(C16H15N2O2Cl)2]·2H2O(RE = La、Ce、Sm、Nd、Eu)。
(2) 2个对甲氧基苯基乙酮4-氯苯甲酰腙分子中的氮、氧配位原子,以亚氨基氮和烯醇氧负离子的形式与一个稀土阳离子结合,配体以三齿形式与稀土阳离子形成稳定的五元环和六元环结构。每种稀土离子都有相似的原子轨道和配位环境,结合以上的结构表征,推测配合物的结构见图6。

图5 C16H15N2O2Cl和La(NO3)3·4H2O的X射线粉末衍射叠加图谱
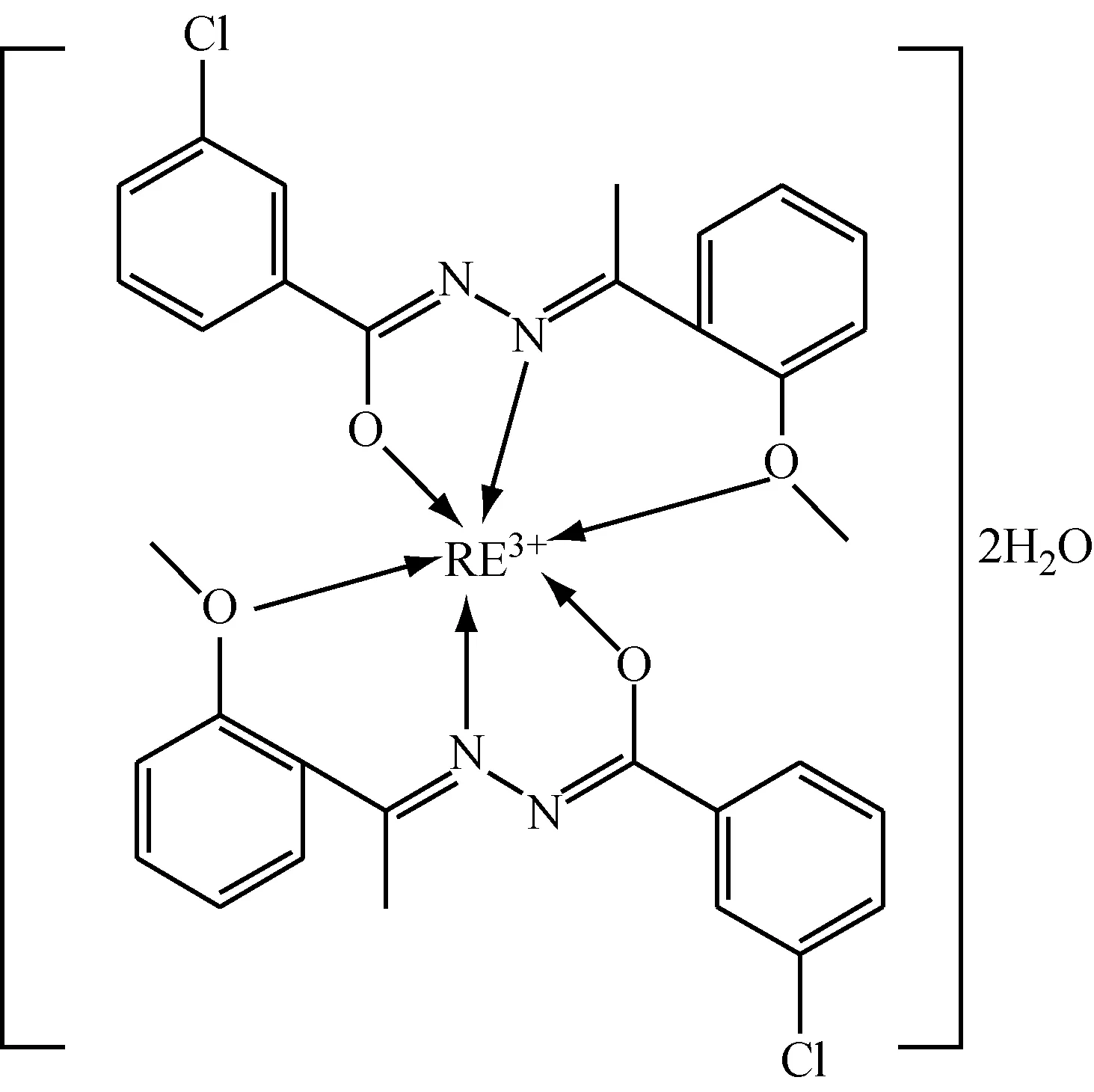
图6 对甲氧基苯基乙酮4-氯苯甲酰腙稀土配合物的结构示意图
[1] RAO S N, MUNSHIKN,RAO N N,etal. Synthesis, spectraland X-
ray structural characterization of[cis-Mo2(L)(solv)](L=salicylidene salicyloyl hydrazine) and its use ascatalytic oxidant[J]. Polyhedron, 1999, 18: 2 491-2 497.
[2] 韦捷敏,田 华,王麟生.抗癌金属配合物的研究新进展[J].化学世界, 2009, 11(4): 602-605.
[3] 张建民,李瑞芳,刘树祥.过渡金属配合物的稳定性及杀菌性[J].无机化学学报, 2000, 15(4): 493-496.
[4] Paschalidis D G, Tossidis I A, Gdaniec M. Synthesis, characterization and spectra of Lanthanide(III) hydrazone complexes The X-ray molecular structuREs of the erbium(III) complex and the ligand[J]. Polyhedron, 2010, 19, 2629-2637.
[5] Yang Z Y, Yang R D, Li F S. Crystal structuRE and antitumor activity of some raRE earth metal complexes with Schiff base[J]. Polyhedron, 2010, 19: 2599-2604.
[6] Rao T R, Srivastava M R, Synthesis and spectral studies of some lanthanide metal chelates of anunsymmetrical tridentate Schiff-base[J]. Synth REact Inorg Met-OrgChem, 1992, 22(10): 1551-1564.
[7] 高宗华, 史 全. 2-噻吩乙酸的低温热容和热力学性质[J]. 化学学报, 2010, 68(3): 227-232.
[8] 张景楠, 谭志诚. Sm(Val)Cl3·6H2O低温热容及热化学性质[J]. 物理化学学报, 2008, 24(8): 1378-1382.
[9] 陈凤英, 曹文凯. RE(III)与2-羰基丙酸水杨酰腙配合物的合成、表征及热化学[J]. 物理化学学报, 2008, 22(3): 280-285.
[10] 何水样, 陈军利,等. 水杨醛水杨酰腙及其稀土配合物的合成、波谱研究及生物活性[J]. 有机化学, 2003, 23(12): 1387-1392.
[11] Sharmeli Yumnam, Lonibala Rajkumari, Thermodynamics of the Complexation of N-(Pyridin-2-ylmethylene) Isonicotinohydrazide with Lighter Lanthanides[J]. J Chem Eng Data, 2009, 54: 28-34.
[12] 唐小冬, 郑长征, 田晓雪. 一种新型芳香酰腙的合成与结构表征[J]. 西安工程大学学报, 2011, 25(5): 684-688.
[13] 宋雅茹, 吴 红, 朱丽萍,等. 水杨醛类希夫碱在LB膜上的光谱性能研究[J]. 光谱学与光谱分析, 2009, 22(4): 645-647.
[14] 杨定国. 波谱分析基础及应用[M]. 北京:中国纺织出版社, 1993.
Hydrothermal Synthesis and Structure Characterization of Rare Earth Complexes
MALi-si1,LIUJing1,TANGXiao-dong2
(1. College of Science, Air Force Engineering University, Xi’an 710051, China;2. College of Environmental and Chemical Engineering, Xi’an Polytechnic University, Xi’an 710048, China)
The rare-earth ions and ligands can bind together, and once they are binded, the original features of rare-earth ions and ligands will be modified largely. In the view of the problem that domestic and aboard research situation of hydrazone and their rare earth complexes, this paper introduces the methods of hydrothermal synthesis. Five rare earth nitrates with the p-methoxy acetophenone 4-chloro benzoylhydrazone are designed and synthesized. The result shows by elemental analysis, UV, IR, X-ray power diffraction and other physico-chemical tools, the structure of the composition of the series of binary complexes are [Re(C16H15N2O2Cl)2]·2H2O(Re=La, Ce, Sm, Nd, Eu). Each rare earth ions has similar atomic orbitals and coordination environment. According to the above characterizations, we suggest the complex structures.
hydrazone; rare earth complexes; synthesis; structure characterization
2014-03-17
马丽斯(1984-),女,陕西西安人,硕士,助教,主要从事电化学分析研究。Tel.:13572516117; E-mail:malisi2008@163.com
O 626.4
A
1006-7167(2015)01-0056-04
