镁离子对大鼠血管平滑肌细胞钙化相关因子表达的影响
2015-02-21白亚玲徐金升靳晶晶张俊霞张胜雷崔立文张慧然
白亚玲,徐金升,靳晶晶,张俊霞,张胜雷,崔立文,张慧然
·论著·
镁离子对大鼠血管平滑肌细胞钙化相关因子表达的影响
白亚玲,徐金升,靳晶晶,张俊霞,张胜雷,崔立文,张慧然
目的 探讨镁离子对大鼠血管平滑肌细胞(VSMCs)钙化相关因子表达水平的影响。方法 选择5周龄健康雄性SD大鼠6只。以组织贴壁法进行原代VSMCs培养,至3~5代时用于细胞实验。将VSMCs采用随机数字表法分为正常对照组、高磷组(加入10 mmol/L β-甘油磷酸)、镁干预组〔加入10 mmol/L β-甘油磷酸+3 mmol/L硫酸镁(MgSO4)〕、2-氨基乙氧基二苯基硼酸(2-APB)干预组(10 mmol/L β-甘油磷酸+3 mmol/L MgSO4+10-4μmol/L 2-APB)。采用邻甲酚酞络合酮比色法检测细胞培养14 d后钙化情况,酶联免疫吸附法检测细胞培养14 d后碱性磷酸酶(ALP)活性,反转录聚合酶链反应(RT-PCR)检测0、3、6、10、14 d时细胞内基质G蛋白(MGP)mRNA和骨桥蛋白(OPN)mRNA的表达水平。结果 细胞培养14 d后,4组钙水平比较,差异有统计学意义(F=409.800,P<0.05);高磷组、2-APB干预组钙水平高于正常对照组和镁干预组 (P<0.05)。4组ALP活性比较,差异有统计学意义(F=490.901,P<0.05);高磷组、2-APB干预组ALP活性高于正常对照组和镁干预组 (P<0.05)。培养14 d后,4组MGP mRNA和OPN mRNA的表达水平比较,差异有统计学意义(F=1 279.905、1 157.247,P<0.05);镁干预组MGP mRNA和OPN mRNA的表达水平高于高磷组及2-APB干预组 (P<0.05)。动态观察MGP mRNA和OPN mRNA的表达变化,结果显示在培养第3天时,高磷组MGP mRNA和OPN mRNA表达水平均降低(P<0.05),并随着时间的延长呈下降趋势;镁干预组MGP mRNA和OPN mRNA表达水平均升高(P<0.05),并随着时间的延长呈上升趋势。结论 高浓度镁离子在抑制VSMCs钙化过程中可上调MGP及OPN的表达,并呈一定时间依赖性,为临床进一步研究提供了参考依据。
肌细胞,平滑肌;β-甘油磷酸盐;镁离子;血管钙化;基质G蛋白;骨桥蛋白质
白亚玲,徐金升,靳晶晶,等.镁离子对大鼠血管平滑肌细胞钙化相关因子表达的影响[J].中国全科医学,2015,18(6):665-668.[www.chinagp.net]
Bai YL,Xu JS,Jin JJ,et al.Effect of magnesium on factors related to calcification in rat vascular smooth muscle cells[J].Chinese General Practice,2015,18(6):665-668.
血管钙化是慢性肾衰竭患者体内常见的病理现象,已成为增加心血管疾病发病率及病死率的重要原因之一[1]。镁离子是体内重要的阳离子,对维持血管弹性有重要作用[2],笔者前期研究发现镁离子可在一定程度上抑制高磷诱导的血管平滑肌细胞(VSMCs)钙化和成骨样转分化,其可能是通过抑制VSMCs中骨源性相关因子的表达来实现[3]。而研究表明,血管钙化形成过程中除钙化相关促进因子(如骨源性相关因子)表达水平增加外,还伴有相关抑制因子表达水平降低[4]。因此,本研究以VSMCs钙化为模型,研究镁离子对VSMCs钙化相关的抑制因子—基质G蛋白(MGP)和骨桥蛋白(OPN)表达水平的影响。
1 材料与方法
1.1 材料来源 选择5周龄健康雄性SD大鼠6只,体质量80~100 g,购自河北医科大学实验动物中心。
1.2 主要试剂及仪器 胎牛血清(fetal bovine serum,FBS)购自美国Hyclone公司,DMEM培养基(dulbecco′s modified eagle′s medium)购自美国GIBCO公司,兔抗鼠平滑肌肌动蛋白单克隆抗体购自北京博奥森生物有限公司,免疫组化试剂盒购自上海博海生物有限公司,β-甘油磷酸及2-氨基乙氧基二苯基硼酸酯(2-APB)购自美国Sigma 公司,碱性磷酸酶(ALP)活性试剂盒购自南京建成生物工程研究所,反转录聚合酶链反应(RT-PCR)试剂盒购自美国Fermentas公司,PCR引物由上海捷瑞生物工程有限公司合成,钙测定试剂盒购自中生北控生物科技股份有限公司,二喹啉甲酸(bicinchoninicacid,BCA)蛋白定量试剂盒购自北京索莱宝科技有限公司;倒置相差显微镜购自日本Olympus公司,细胞培养箱购自美国Sheldon公司,RT-PCR仪购自美国Abi公司。
1.3 方法
1.3.1 原代VSMCs培养及鉴定 以组织贴壁法进行原代VSMCs培养。原代VSMCs形态学观察:应用倒置相差显微镜观察细胞大小、形态、生长特点及排列方式等。免疫组化法染色:6孔板内用消毒的盖玻片制作细胞爬片,待细胞贴壁生长至60%~70%时,弃去培养基,用免疫组化法鉴定VSMCs特异性抗体A-SMA actin,二氨基联苯胺(DAB)显色,苏木素轻度复染,经分化、脱水、透明、封片,在显微镜下观察,胞质内表达为强阳性,并可见棕黄色的免疫产物可判定为阳性结果,当细胞随传代而自行纯化时,细胞理化性质无明显改变。原代VSMCs传代培养至3~5代时用于细胞实验。
1.3.2 实验分组及造模 将VSMCs采用随机数字表法随机分为4组:(1)正常对照组:加入含10%胎牛血清的DMEM培养;(2)高磷组:在正常对照组培养基的基础上加入10 mmol/L β-甘油磷酸诱导钙化;(3)镁干预组:高磷组培养基的基础上加入3 mmol/L硫酸镁(MgSO4)溶液;(4)2-APB干预组:在镁干预组培养基的基础上加入10-4μmol/L 2-APB。
1.3.3 VSMCs钙化及ALP活性测定 采用邻甲酚酞络合酮比色法检测细胞钙化情况:细胞培养14 d后弃去上清液,加入0.6 mol/L盐酸溶液37 ℃脱钙过夜,取上清液测钙水平,再用0.1 mol/L氢氧化钠(NaOH)和0.1%十二烷基磺酸钠(SDS)溶液溶解细胞30 min,BCA法测定细胞蛋白水平,结果用细胞钙水平比蛋白水平表示(mg/g蛋白)。酶联免疫吸附法检测ALP活性:细胞培养14 d后弃去上清液,依据ALP活性试剂盒测定其活性,严格按照试剂盒说明书进行操作。上述实验均重复3次,结果为3次平均值。
1.3.4 RT-PCR法检测VSMCs MGP mRNA和OPN mRNA的表达 分别提取0、3、6、10、14 d时正常对照组、高磷组、镁干预组以及14 d时2-APB干预组细胞的总mRNA,测定MGP和OPN的表达。PCR引物由Primer 5.0软件设计,MGP上游引物为:5′-AAAGCCCAGGAAAGAGTCCG-3′,下游引物为:5′-TCTTATTTGGCTCCTCGGCG-3′;OPN上游引物为:5′-ATGCTATCGACAGTCAGGCG-3′,下游引物为:5′-GCTCAGGGCCCAAAACACTA-3′;甘油醛-3-磷酸脱氢酸(GAPDH)上游引物为:5′-CCCACTAAAGGGCATCCTGG-3′,下游引物为:5′-GGCCCCTCCTGTTGTTATGG-3′。PCR反应体系为20 μl。反应条件为:95 ℃预变性5 min;95 ℃变性30 s,MGP 55 ℃、OPN 56 ℃ 、GAPDH 57 ℃退火30 s,72 ℃ 延伸45 s(共35个循环);最后72 ℃延伸10 min。实验均重复3次,结果为3次平均值。

2 结果
2.1 大鼠VSMCs原代培养及鉴定 大鼠胸主动脉组织块贴壁3~4 d后可见细胞从组织块边缘爬出,细胞为长梭形,呈束状排列,6~7 d后融合成片,细胞呈星形或不规则形,以梭形为主,相互重叠生长。细胞质A-SMA actin表达强阳性,呈棕黄色(见图1)。

图1 大鼠VSMCs细胞质A-SMA actin表达情况(免疫组化染色法,×200)
Figure 1 The rat VSMCs cytoplasmic expression of A-SMA actin
2.2 4组钙水平及ALP活性比较 细胞培养14 d后,4组钙水平比较,差异有统计学意义(F=409.800,P<0.05);高磷组、2-APB干预组钙水平高于正常对照组和镁干预组,差异均有统计学意义(P<0.05)。4组ALP活性比较,差异有统计学意义(F=490.901,P<0.05);高磷组、2-APB干预组ALP活性高于正常对照组和镁干预组,差异均有统计学意义(P<0.05,见图2)。
2.3 4组MGP mRNA及OPN mRNA的表达水平比较 培养14 d后,4组MGP mRNA和OPN mRNA的表达水平比较,差异有统计学意义(F=1 279.905、1 157.247,P<0.05);镁干预组MGP mRNA和OPN mRNA的表达水平高于高磷组及2-APB干预组 (P<0.05,见图3)。动态观察MGP mRNA和OPN mRNA的表达变化,结果显示在培养第3天时,高磷组MGP mRNA和OPN mRNA表达水平均降低(P<0.05),并随着时间的延长呈下降趋势;镁干预组MGP mRNA和OPN mRNA表达水平均升高(P<0.05),并随着时间的延长呈上升趋势(见图4)。
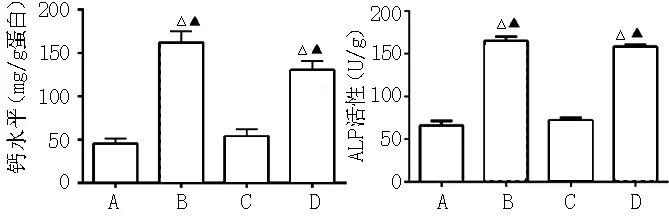
注:ALP=碱性磷酸酶;A为正常对照组,B为高磷组,C为镁干预组,D为2-APB干预组;与正常对照组比较,△P<0.05;与镁干预组比较,▲P<0.05
图2 培养14 d后4组细胞钙水平及ALP活性的比较
Figure 2 Comparison of the calcium levels and ALP activity in the four groups after incubation for 14 days
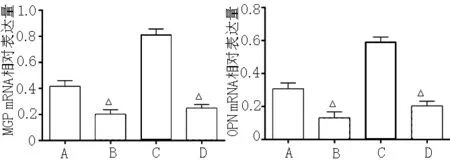
注:MGP=基质G蛋白,OPN=骨桥蛋白;A为正常对照组;B为高磷组;C为镁干预组;D为2-APB干预组;与镁干预组比较,△P<0.05
图3 培养14 d后4组MGP mRNA及OPN mRNA的表达水平比较
Figure 3 Comparison of the expression of MGP mRNA and OPN mRNA in the four groups after incubation for 14 days

注:与正常对照组比较,△P<0.05;与高磷组比较,○P<0.05
图4 不同时间段MGP mRNA和OPN mRNA的表达水平比较
Figure 4 Comparison of the expression of MGP mRNA and OPN mRNA in the four groups in different time
3 讨论
血管钙化在慢性肾脏病患者中普遍存在,研究表明与慢性肾脏病相关的钙化主要是血管中膜钙化[5],其主要表现为血管壁僵硬度增加,顺应性减低,从而引起心肌缺血、心力衰竭,是导致慢性肾脏病患者心血管高发病率和高病死率的重要原因之一。镁离子作为人体所必需的重要元素,具有重要的生理功能,如作为酶的辅助因子调节酶活性,同时还对血管壁内皮细胞、平滑肌细胞、巨噬细胞等多种细胞具有调节作用,因此镁离子与血管钙化的关系近年来受到人们的关注。Spiegel等[6]最近一项随访18个月的临床研究发现,碳酸镁可以阻止冠状动脉钙化的进展。笔者之前的基础研究亦发现镁离子对高磷诱导的血管钙化有一定抑制作用[3]。本研究进一步向镁干预组加入了镁离子通道抑制剂,阻止镁离子进入细胞,结果显示2-APB干预组钙水平高于镁干预组,提示其明显减弱了镁离子对高磷诱导VSMCs钙化的抑制作用,进一步证实镁离子对VSMCs钙化具有强效的拮抗作用。
然而,镁离子抑制血管钙化的具体机制目前尚不清楚。众所周知,血管钙化是类似于骨形成的高度可调控的细胞介导的主动过程[7]。研究表明,在血管钙化形成过程中除钙化相关促进因子(如骨源性相关因子)表达水平增加外,还伴有相关抑制因子表达水平的降低[4]。MGP广泛分布于软骨、心、血管及肺等组织中,是软骨内骨形成和血管内异位钙化的重要调节因子。研究发现,MGP基因敲除的小鼠模型出生后不久即出现严重血管钙化,2个月后因动脉钙化破裂而死亡[8]。MGP可与骨形态发生蛋白2结合,拮抗其促进动脉钙化的作用[9]。OPN是一种广泛表达于骨、软骨、肾脏等组织的分泌糖基化磷酸蛋白。现有报道表明,OPN具有很强的抑制血管钙化的作用,与仅缺乏MGP的小鼠相比,缺乏OPN及MGP两种基因的小鼠更早出现动脉钙化,并且动脉钙化率是前者的2倍[10]。本研究表明,VSMCs钙化伴随MGP mRNA及OPN mRNA的表达水平下降,提示内源性抗钙化能力减弱在血管钙化的发生中起重要作用。本研究还发现,给予镁离子干预后可明显上调MGP mRNA及OPN mRNA的表达水平,而给予镁通道抑制剂后这种效果即消失,提示镁离子可增强内源性抗钙化能力来抑制钙化;随后动态观察了镁离子上调MGP及OPN的特点,结果显示在培养第3天时,高磷组MGP mRNA和OPN mRNA表达水平均降低,并随着时间的延长呈下降趋势;镁干预组MGP mRNA和OPN mRNA表达水平均升高,并随着时间的延长呈上升趋势,提示镁离子增强内源性抗钙化系统的作用呈一定的时间依赖性。
总之,本研究进一步证实高浓度镁离子对血管钙化具有强效的抑制作用,而上调内源性钙化拮抗系统可能是其重要的作用机制之一。但本研究仅局限于体外细胞水平,而其在人体如何,尚有待进一步设计动物实验及临床试验观察镁离子对血管钙化相关钙化因子表达水平的影响。
[1]Raggi P,Bellasi A,Gamboa C,et al.All-cause mortality in hemodialysis patients with heart valve calcification[J].Clin J Am Soc Nephrol,2011,6(8):1990-1995.
[2]Geiger H,Wanner C.Magnesium in disease[J].Clin Kidney J,2012,5(Suppl 1):i25-38.
[3]Bai YL,Xu JS,Feng WX,et al.Effects of magnesium ions on the calcification of vascular smooth muscle cells[J].Tianjin Medical Journal,2014,56(5):443-446.(in Chinese) 白亚玲,徐金升,冯伟勋,等.镁离子对大鼠血管平滑肌细胞钙化的影响[J].天津医药,2014,56(5):443-446.
[4]Jono S,Shioi A.Vascular calcification in chronic kidney disease[J].J Bone Miner Metab,2006(24):176-181.
[5]Giachelli CM. The emerging role of phosphate in vascular calcification[J]. Kidney Int,2009,75(9):890-897.
[6]Spiegel DM,Farmer B.Long-term effects of magnesium carbonate on coronary artery calcification and bone mineral density in hemodialysis patients:a pilot study[J].Hemodial Int,2009,13(4):453-459.
[7]CannatA-Andia JB,Roman-Garcia P,Hruska K.The connections between vascular calcification and bone health[J].Nephrol Dial Transplant,2011,26(11):3429-3436.
[8]Luo G,Ducy P,McKee MD,et al.Spontaneous calcification of arteries and cartilage in mice lacking matrix GLA protein[J].Nature,1997,386(6620):78-81.
[9]Zebboudj AF,Imura M,Boström K.Matrix GLA protein,a regulatory protein for bone morphogenetic protein-2[J].J Biol Chem,2002,277(6):4388-4394.
[10]Cho HJ,Cho HJ,Kim HS.Osteopontin:a multifunctional protein at the crossroads of inflammation,atherosclerosis,and vascular calcification[J].Curr Atheroscler Rep,2009,11(3):206-213.
修回日期:2014-12-21)
(本文编辑:李婷婷)
Effect of Magnesium on Factors Related to Calcification in Rat Vascular Smooth Muscle Cells
BAIYa-ling,XUJin-sheng,JINJing-jing,etal.
DepartmentofNephrology,theFourthHospitalofHebeiMedicalUniversity,Shijiazhuang050011,China
Objective To investigate the effect of magnesium on the expression of factors related to calcification in rat vascular smooth muscle cells (VSMCs).Methods A total of 6 healthy SD rats aged 5 weeks were selected.VSMCs were primarily cultured in vitro using tissue block adhering wall method,and the third to fifth generation was used for cell experiment.The VSMCs were randomly divided into control group,high phosphorus group (10 mmol/L β-glycerophosphate),magnesium intervention group (10 mmol/L β-glycerophosphate and 3 mmol/L MgSO4),2-APB intervention group (10 mmol/L β-glycerophosphate,3 mmol/L MgSO4and 10-4μmol/L 2-APB).After culturing for 14 days,calcification was detected with OCPC method and the activity of alkaline phosphatase was detected with enzyme linked immunosorbent assay (ELISA) method.The expression of matrix gla protein (MGP) mRNA and osteopontin (OPN) mRNA on 0,3,6,10 and 14 days were detected by RT-PCR method.Results After culturing for 14 days,the four groups showed statistically significant differences in calcification level (F=409.800,P<0.05),with the high phosphorus group and 2-APB intervention group significantly higher than the control group and magnesium intervention group (P<0.05).The four groups showed statistically significant differences in ALP activity (F=490.901,P<0.05),with the high phosphorus group and 2-APB intervention group significantly higher than the control group and magnesium intervention group (P<0.05).The four groups showed statistically significant differences in the expression of MGP mRNA and OPN mRNA (F=1 279.905,1 157.247,P<0.05),with the magnesium intervention group significantly higher than the phosphorus group and 2-APB intervention group (P<0.05).Dynamic observation showed that the expression of MGP mRNA and OPN mRNA decreased after culturing for three days (P<0.05) and the decrease was in a time dependent manner.However,the expression of MGP mRNA and OPN mRNA in magnesium intervention group increased (P<0.05) in a time dependent manner.Conclusion Magnesium may up-regulate the expression of MGP and OPN in a time dependent manner in inhibiting the calcification of VSMCs,providing a reference for further clinical study.
Myocytes,smooth muscle;β-glycerophosphate;Magnesium;Vascular calcification;Matrix gla protein;Osteopontin
项目:河北省自然科学基金资助项目(H2012206157)
050011 河北省石家庄市,河北医科大学第四医院肾内科
徐金升,050011 河北省石家庄市,河北医科大学第四医院肾内科;E-mail:xjs5766@126.com
R 692.5
A
10.3969/j.issn.1007-9572.2015.06.013
2014-09-21;
