天然牛磺酸对肝硬化大鼠肝脏超微结构及脂质过氧化的影响
2015-02-21彭佩纯
文 彬,陈 然,彭佩纯,邓 鑫
·论著·
天然牛磺酸对肝硬化大鼠肝脏超微结构及脂质过氧化的影响
文 彬,陈 然,彭佩纯,邓 鑫
目的 探讨天然牛磺酸对肝硬化大鼠肝脏超微结构及脂质过氧化的影响。方法 将80只SD大鼠按照随机数字表法分为正常对照组(A组)15只和造模组60只。采用复合因素法制备肝硬化大鼠模型,造模成功后,造模组大鼠重新采用随机数字表法分为模型组(B组,20只)、合成牛磺酸治疗组(C组,20只)及天然牛磺酸治疗组(D组,20只)。硫代巴比妥酸(TBA)比色法测定肝线粒体、微粒体丙二醛(MDA)的含量,邻苯三酚自氧化法测定肝线粒体、微粒体超氧化物歧化酶(SOD)活性,苏木素-伊红染色法(HE)观察肝脏病理学改变,透视电镜下观察肝脏超微结构。结果 与A组比较,B组大鼠MDA含量增加,SOD活性下降(P<0.01),肝组织病理学及超微结构损害严重;与B组比较,C、D组大鼠MDA含量降低,SOD活性升高(P<0.01),肝脏线粒体、内质网等超微结构明显改善。与C组比较,D组大鼠MDA含量降低、SOD活性升高(P<0.01)。结论 天然牛磺酸可以增强机体抗氧化损伤能力,对肝脏线粒体、内质网等细胞器具有保护作用。
牛磺酸;肝硬化;丙二醛;超氧化物歧化酶
文彬,陈然,彭佩纯,等.天然牛磺酸对肝硬化大鼠肝脏超微结构及脂质过氧化的影响[J].中国全科医学,2015,18(6):661-664.[www.chinagp.net]
Wen B,Chen R,Peng PC,et al.Effect of natural taurine on liver ultrastructure and lipid peroxidation in rats with cirrhosis[J].Chinese General Practice,2015,18(6):661-664.
肝硬化涉及肝细胞损伤、增殖、凋亡等复杂过程,脂质过氧化、细胞外基质的过度沉积是导致肝纤维化的重要病理学基础[1-2]。肝硬化迄今尚缺乏有效的治疗方法,天然牛磺酸是从中药乌蛤肉中提取,在防治肝硬化门静脉高压的动物实验中已取得了初步肯定,而且前期实验研究发现,600 mg·kg-1·d-1天然牛磺酸对抗大鼠肝纤维化效果明显优于其他剂量[3-4]。为进一步探索该药的作用机制,本实验从大鼠肝脏脂质过氧化及电镜下肝脏超微结构等方面探讨天然牛磺酸对肝硬化大鼠的保护作用及影响环节。
1 材料与方法
1.1 动物 健康清洁SD大鼠,SPF级,雄性,周龄6~7周,体质量(0.18±0.02) kg,由广西医科大学动物实验中心提供,动物合格证:scxk桂2009-0002。
1.2 主要药物 天然牛磺酸从乌蛤肉中提取,采用热水提取法,红外光谱仪鉴定产品质量;合成牛磺酸T0625(美国sigma公司提供)。
1.3 主要试剂及设备 四氯化碳(CCl4)、分析纯购自天津富宇精细化工有限公司;食用酒购自北京方庄酒厂;西班牙贝蒂斯橄榄油购自青岛金欧利营销有限公司;丙二醛(MDA)、超氧化物歧化酶(SOD)试剂盒购自南京建成生物工程研究所;H-7650型透射电子显微镜购自日本日立公司。
1.4 方法及观察指标
1.4.1 模型制备 大鼠在适应性饲养1周后,按随机数字表法分为正常对照组(A组,15只)和造模组(60只),采用复合因素法造模[5],造模组大鼠首次按0.005 ml/g腹部皮下注射混合液(贝蒂斯橄榄油60%+CCl440%),后每隔3 d按0.003 ml/g皮下注射,2次/周,15%乙醇为唯一饮料,同时辅以20%猪油、0.5%胆固醇、79.5%玉米面混合饲料,共计12周;A组则以普通饲料和纯净水喂养。实验12周后经病理学检查确认造模成功。
1.4.2 分组及用药 造模组大鼠采用随机数字表法分为3组,即模型组(B组,20只)、合成牛磺酸治疗组(C组,20只)及天然牛磺酸治疗组(D组,20只)。C组合成牛磺酸600 mg·kg-1·d-1灌胃,D组天然牛磺酸600 mg·kg-1·d-1灌胃,均为1次/d,连续60 d,B组及A组大鼠给予相同剂量0.9%氯化钠溶液灌胃。
1.4.3 标本采集及指标测定 实验结束后3%戊巴比妥钠按0.003 ml/g 腹腔注射,剖腹,取相同部位新鲜肝脏组织,硫代巴比妥酸(TBA)比色法测定MDA的含量,邻苯三酚自氧化法测定SOD活性。另一部分肝脏组织以10%甲醛溶液固定,常规脱水,石蜡包埋,切片,行苏木素-伊红染色法(HE)染色,光镜下观察。取小块新鲜肝组织大小1 mm×1 mm×1 mm投入4 ℃预冷的4%戊二醛,固定24 h,再经1%四氧化锇固定2 h,常规乙醇和丙酮脱水,加丙酮-Epon812环氧树脂包埋,修块及切片,铀-铅染色,透视电镜下观察。

2 结果
2.1 大鼠肝脏组织HE染色病理学比较 HE染色下A组大鼠肝脏组织的结构完整,肝小叶结构清晰,肝细胞排列规则成索状,围绕中央静脉呈放射状排列。B组大鼠肝脏组织的实质被破坏,肝小叶正常结构紊乱,门脉区纤维组织大量增生,并呈条索状向肝小叶内延伸形成假小叶。C组大鼠肝脏组织的炎性细胞浸润与坏死明显减轻,肝脏组织纤维间隔不完全,胶原纤维沉积明显改善。D组大鼠肝脏组织的肝小叶结构基本正常,未见明显炎性细胞浸润及纤维间隔(见图1)。
2.2 大鼠肝脏线粒体、微粒体MDA、SOD变化 与A组比较,B组大鼠肝脏线粒体、微粒体MAD含量升高,SOD活性降低,差异有统计学意义(P<0.01);与B组比较,C、D两组大鼠肝脏线粒体、微粒体MDA含量均下降,SOD活性均升高,差异有统计学意义(P<0.01);与C组比较,D组肝脏线粒体、微粒体MDA含量降低、SOD活性增加,差异有统计学意义(P<0.01,见表1)。
2.3 大鼠肝脏超微结构比较 A组大鼠肝细胞核规则,核内异染色质少,线粒体发达,多为圆形或肾形,嵴稀疏短小,内质网呈层状紧密排列,肝细胞与Disse间隙内未见胶原纤维(见图2A)。B组肝细胞核萎缩,细胞器明显减少,粗面内质网层状排列不明显,呈囊状扩张肿胀、甚至空泡化;线粒体形状不规则、嵴欠清晰,部分线粒体肿胀破裂或溶解成灶性空泡,Disse间隙可见较多胶原纤维及成纤维细胞增生沉积(见图2B1、2B2)。C组大鼠肝细胞无明显肿胀,线粒体明显增生,内质网稍扩张,Disse间隙可见少量胶原纤维束沉积,增生不明显(见图2C)。D组大鼠肝细胞形态正常,细胞器明显增多,线粒体基本正常,嵴清晰可见,内质网排列紧密,Disse间隙见极小量胶原纤维束沉积(见图2D)。
3 讨论
复合因素法构建大鼠肝硬化模型是一种经典的造模方法,简便、周期短、模型稳定性及成功率高,在前期肝纤维化研究中已采用该法多次成功建立肝硬化大鼠模型[3-4]。研究表明,CCl4可引起体内过氧化产物(如MDA)增多,SOD减少,氧化和抗氧化的动态平衡遭破坏,引发脂质过氧化,加速肝纤维化进程[5-7]。因此,一定程度上减少脂质过氧化,激发抗氧化酶活性成为治疗肝纤维化的一个重要举措。
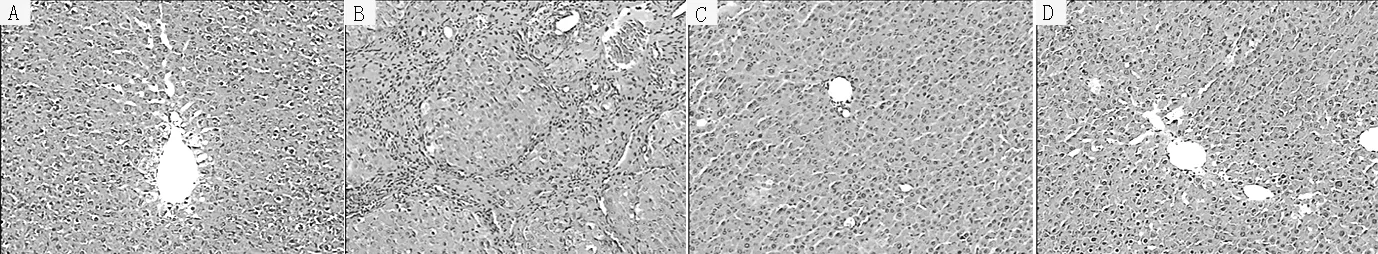
注:A、B、C、D分别为A组、B组、C组、D组
图1 大鼠肝脏组织病理学检查(HE染色,×100)
Figure 1 Pathology of the rat liver tissue

注:A、B、C、D分别为A组、B组、C组、D组
图2 大鼠肝脏超微结构(铀-铅染色,×20 000)
注:与A组比较,*P<0.01;与B组比较,△P<0.01;与C组比较,▲P<0.01;MDA=丙二醛,SOD=超氧化物歧化酶
牛磺酸是人体重要的营养物质,具有清除氧自由基及抗脂质过氧化等生物学作用[8-9]。目前国内外市场以化学合成的牛磺酸为主,但研究发现较大剂量(1.0 g·kg-1·d-1)使用合成牛磺酸,对实验大鼠产生明显的不良反应,在某些发达国家,合成牛磺酸已被禁用于婴幼儿食品的添加。中药乌蛤中天然牛磺酸含量高,现代药理学研究显示:天然牛磺酸具有解毒护肝、抗氧化损伤、抗肿瘤及增强机体免疫功能等活性,且无相关不良反应[10-11]。本实验结果表明,合成牛磺酸和天然牛磺酸均可降低MDA含量,增加SOD活性,具有一定抗脂质过氧化作用,但天然牛磺酸治疗效果更佳。
线粒体有“动力工厂”的美誉,对调控能量代谢、细胞凋亡起着重要的作用。肝硬化时线粒体、微粒体氧化和抗氧化系统的平衡被打破,生命活动所需的ATP会受到严重抑制。本实验进一步从超微结构层次探讨肝脏病理学结构变化,结果显示,B组大鼠肝细胞线粒体肿胀、溶解甚至灶性空泡化,而经天然牛磺酸治疗后,线粒体的形态结构得到明显改善,从超微结构等方面进一步论证天然牛磺酸具有抗脂质过氧化作用,减轻线粒体的氧化损伤,恢复肝线粒体能量代谢功能。内质网在肝细胞中高度发达,有研究证实内质网的功能紊乱和脂质代谢有着直接联系,共同协调体内氧化和抗氧化系统[12]。而滑面内质网含有混合功能氧化酶系(如CYP-450),可以与一氧化碳(CO)结合,通过羟基化作用而使一些低分子物质(如代谢产物、毒物等)等有害物质失活、溶解,达到解毒和生物转化作用。本研究结果提示天然牛磺酸能够改善损伤的肝脏超微结构,从而影响毒物在肝内的代谢转化,通过减轻肝脏毒性而达到抗纤维化目的。
本研究结果表明,天然牛磺酸可以减少过氧化物MDA含量,增强SOD活性,对肝细胞线粒体、内质网等超微结构具有保护作用,其抵抗肝硬化的作用机制可能与抗氧化损伤、稳定线粒体膜功能及电子信号传递链畅通等有关。
[1]杨凤蕊,娄建石,方步武.蒿鳖养阴软坚方抗CCl4复合因素所致大鼠肝纤维化的作用[J].中草药,2011,42(3):530-534.
[2]Ginès P,Cárdenas A,Arroyo V,et al.Management of cirrhosis and ascites[J].N Engl J Med,2004,350(16):1646-1654.
[3]Deng X,Liang J,Li YZ,et al.Protective effect of natural taurine on mitochondria of hepatic fibrosis in rats[J].Journal of Xi′an Jiaotong University(Medical Sciences),2007,28(6):649-650.(in Chinese) 邓鑫,梁健,李益忠,等.天然牛磺酸对肝纤维化大鼠肝线粒体的保护作用[J].西安交通大学学报:医学版,2007,28(6):649-650.
[4]邓鑫,梁健,黄彬,等.天然牛磺酸对肝纤维化大鼠TGF-β1/Smad信号通路的影响[J].大连医科大学学报,2007,29(3):336-339.
[5]梁扩寰,李绍白.门静脉高压症[M].北京:人民军医出版社,1999:414-416.
[6]Cederbaum AL,Lu Y,Wu D.Role of oxidative stress in alcohol-induced liver injury[J].Arch Toxicol,2009,83(6):519-548.
[7]Lu SY,Qi P,Liang YE,et al.Protective effect of Ilicifoliosids alkaloid A and its derivatives on hepatic fibrosis induced by carbon tetrachloride in rats[J].Lishizhen Medicine and Materia Medica Research,2013,24(2):310-311.(in Chinese) 卢顺玉,祁平,梁颖娥,等.老鼠簕生物碱A及其衍生物对四氯化碳致大鼠肝纤维化的保护作用[J].时珍国医国药,2013,24(2):310-311.
[8]Schuller-Levis G,Gordon RE,Wang C,et al.Protection of bleomycin-induced fibrosis and in flammation by taurine[J].Int Immunopharmacol,2009,9(7/8):971-977.
[9]Lakshmi Devi S,Anuradha CV.Mitochondrial damage,cytotoxicity and apoptosis in iron-potentiated alcoholic liver fibrosis:amelioration by taurine[J].Amino Acids,2010,38(3):869-879.
[10]Li CZ,Pan ZF,Chen YH,et al.Research progress in active substance of oyster softbody[J].Science and Technology of Food Industry,2012,33(8):412-415.(in Chinese) 李超柱,潘珍凤,陈艳辉,等.牡蛎软体活性物质的研究进展[J].食品工艺科技,2012,33(8):412-415.
[11]张鹏,徐家敏,于广利.牛磺酸的生物活性及应用研究进展[J].青岛海洋大学学报,1995(S1):133-137.
[12]Rutkowski DT,Wu J,Back SH,et al.UPR pathways combine to prevent hepatic steatosis caused by ER stress-mediated suppression of transcriptional master regulators[J].Dev Cell,2008,15(6):829-840.
(本文编辑:高晓欢)
Effect of Natural Taurine on Liver Ultrastructure and Lipid Peroxidation in Rats with Cirrhosis
WENBin,CHENRan,PENGPei-chun,etal.
GuangxiUniversityofTraditionalChineseMedicine,Nanning530001,China
Objective To explore the effect of natural taurine on liver ultrastructure and lipid peroxidation in rats with cirrhosis.Methods 80 SD rats were randomly divided into 2 groups by random number table method:normal control group (group A,15 cases) and model group (60 cases).The rat model with cirrhosis was prepared by composite factor method,as soon as the model was prepared successfully,the rats in model group were divided into model group (group B,20 cases),synthetic taurine group (group C,20 cases) and natural taurine group (group D,20 cases) by random number table.The content of methane dicarboxylic aldehyde (MDA) in liver mitochondria and microsome were measured by thiobarbituric acid (TBA) colorimetric assay,the activity of superoxide dismutase (SOD) in liver mitochondria and microsome were measured by pyrogallol autoxidation,the pathological changes in the liver were observed after HE staining,ultrastructure changes of rat liver tissue were observed under electron microscope.Results MDA content in rats in group B was significantly higher than that in rats in group A (P<0.01),the activity of SOD in rats in group B was significantly lower than that in rats in group A,the damage of liver tissue and ultrastructure was serious.MDA content in rats in group C and group D was significantly lower than that in rats in group B,the activity of SOD in rats in group C and group D was significantly higher than that in rats in group B(P<0.01),the ultrastructure of liver mitochondria and endoplasmic reticulum significantly improved.The activity of MDA content in rats in group D was significantly lower than that in rats in group C,SOD in rats in group D was significantly higher than that in rats in group C(P<0.01).Conclusion The natural taurine can enhance the body′s antioxidant capacity to resist oxidative damage,and can protect organelles such as liver mitochondria and endoplasmic reticulum.
Taurine;Liver cirrhosis;Malondialdehyde;Superoxide dismutase
国家自然科学基金资助项目(81160433);广西科技厅重点课题(2011GXNSFD018035);广西卫生厅重点课题(重20122031);中南大学博士后科学基金(2013M531816)
530001广西南宁市,广西中医药大学(文彬,陈然,彭佩纯);广西中医药大学附属瑞康医院消化内科(邓鑫)
邓鑫,530000广西南宁市,广西中医药大学附属瑞康医院消化内科;E-mail:wenbin357@yeah.net
R 575.2
A
10.3969/j.issn.1007-9572.2015.06.012
2014-03-05;
2014-07-07)
