2008—2013年江苏省甲型肝炎疫苗疑似预防接种异常反应监测分析
2015-02-21张晋琳马福宝
高 君,张晋琳,马福宝
·数据研究分享·
2008—2013年江苏省甲型肝炎疫苗疑似预防接种异常反应监测分析
高 君,张晋琳,马福宝
目的 分析江苏省接种甲型肝炎疫苗(HepA)发生疑似预防接种异常反应(AEFI)的流行病学特征,评价HepA预防接种的安全性。方法 通过AEFI信息管理系统和江苏省免疫规划信息系统,收集江苏省2008—2013年HepA AEFI报告数据和HepA接种数据,对相关指标进行描述性分析。结果 江苏省2008—2013年共报告HepA AEFI 2 585例,其中冻干甲型肝炎减毒活疫苗(HepA-L)1 068例,平均报告发生率310.0/100万剂;甲型肝炎灭活疫苗(HepA-I)1 517例,平均报告发生率358.8/100万剂。HepA-L AEFI一般反应发生率为267.0/100万剂(920例),异常反应发生率为39.5/100万剂(136例);HepA-I AEFI一般反应发生率为334.2/100万剂(1 413例),异常反应发生率为24.1/100万剂(102例)。年龄分布上,HepA-L AEFI以1岁组为主,占83.1%;HepA-I AEFI以1岁组和2~3岁组为主,分别占57.7%和38.7%。HepA-L和HepA-I AEFI男女性别比均为1.4∶1。HepA-L和HepA-I AEFI每个季节均有报告,春、夏季所占比例略高,分别为59.6%和61.6%。在不良反应的临床损害分布上一般反应的主要症状为发热、红肿、硬结,异常反应主要症状为过敏性皮疹。不良反应集中在接种后≤1 d发生。结论 HepA-L和HepA-I均具有较好的预防接种安全性,不良反应以发热、红肿、硬结和过敏性皮疹为主,发生时间主要集中在接种后≤1 d。临床需关注HepA接种后急性过敏反应的发生信号。
甲型肝炎疫苗;大规模疫苗接种 ;疑似预防接种异常反应
甲型肝炎(甲肝)是由甲肝病毒(HAV)引起的一种以肝脏损害为主的急性传染病。江苏省曾是甲肝的高发流行区,随着甲型肝炎疫苗(HepA)的使用以及环境卫生的改善,甲肝发病率显著降低[1]。HepA接种是预防和控制甲肝最有效的方法[2]。江苏省自2008年开始将HepA纳入到扩大的国家免疫规划,适龄儿童可免费接种。2008—2011年免疫规划以冻干甲型肝炎减毒活疫苗(HepA-L)接种为主,2012—2013年免疫规划全部采用甲型肝炎灭活疫苗(HepA-I)。这两种疫苗的安全性在既往临床试验研究中多次被报道[3-6],但纳入国家免疫规划进行大规模儿童接种后,相关报道尚不多见。现对江苏省2008—2013年HepA疑似预防接种异常反应(AEFI)的监测数据进行分析,评估其预防接种安全性。
1 资料与方法
1.1 资料来源 AEFI个案数据来源于AEFI信息管理系统,HepA接种数据来源于江苏省免疫规划信息系统。统计截至2014-06-30江苏省报告的2008—2013年所有HepA AEFI个案数据。
1.2 AEFI报告方式 根据江苏省《预防接种副反应监测试点工作指南》和《全国疑似预防接种异常反应监测方案》要求报告的范围开展AEFI监测和报告。由医疗机构、接种单位等责任报告单位发现AEFI后,及时向县(市、区)疾病预防控制中心报告,县(市、区)疾病预防控制中心将AEFI报告卡和个案调查数据通过AEFI信息管理系统报告。
1.3 AEFI报告内容及分类 AEFI是指在预防接种后发生的怀疑与预防接种有关的反应或事件。按发生原因分为不良反应(包括一般反应和异常反应)、疫苗质量事故、接种事故、偶合症、心因性反应5种类型。严重异常反应按照《全国疑似预防接种异常反应监测方案》进行统计。
1.4 统计学方法 将AEFI信息管理系统中的AEFI个案数据导出为Excel文件后进行整理,采用SPSS 18.0软件对数据进行描述性分析。
2 结果
2.1 AEFI报告情况 2008—2013年,全省共报告HepA AEFI 2 585例,其中HepA-L AEFI 1 068例,报告发生率为(136.2~542.1)/100万剂,平均报告发生率为310.0/100万剂;HepA-I AEFI 1 517例,报告发生率为(102.1~475.9)/100万剂,平均报告发生率为358.8/100万剂。
HepA-L AEFI以一般反应为主(920例,占86.1%,平均报告发生率为267.0/100万剂),其次是异常反应(136例,占12.7%,平均报告发生率为39.5/100万剂),再次是偶合症(8例,占0.8%,平均报告发生率为2.3/100万剂)和心因性反应(4例,占0.4%,平均报告发生率为1.2/100万剂),无疫苗质量事故和接种事故发生。HepA-I AEFI以一般反应为主(1 413例,占93.2%,平均报告发生率为334.2/100万剂),其次是异常反应(102例,占6.7%,平均报告发生率为24.1/100万剂),再次是偶合症(2例,0.1%,平均报告发生率为0.5/100万剂),无心因性反应、疫苗质量事故和接种事故发生(见表1)。
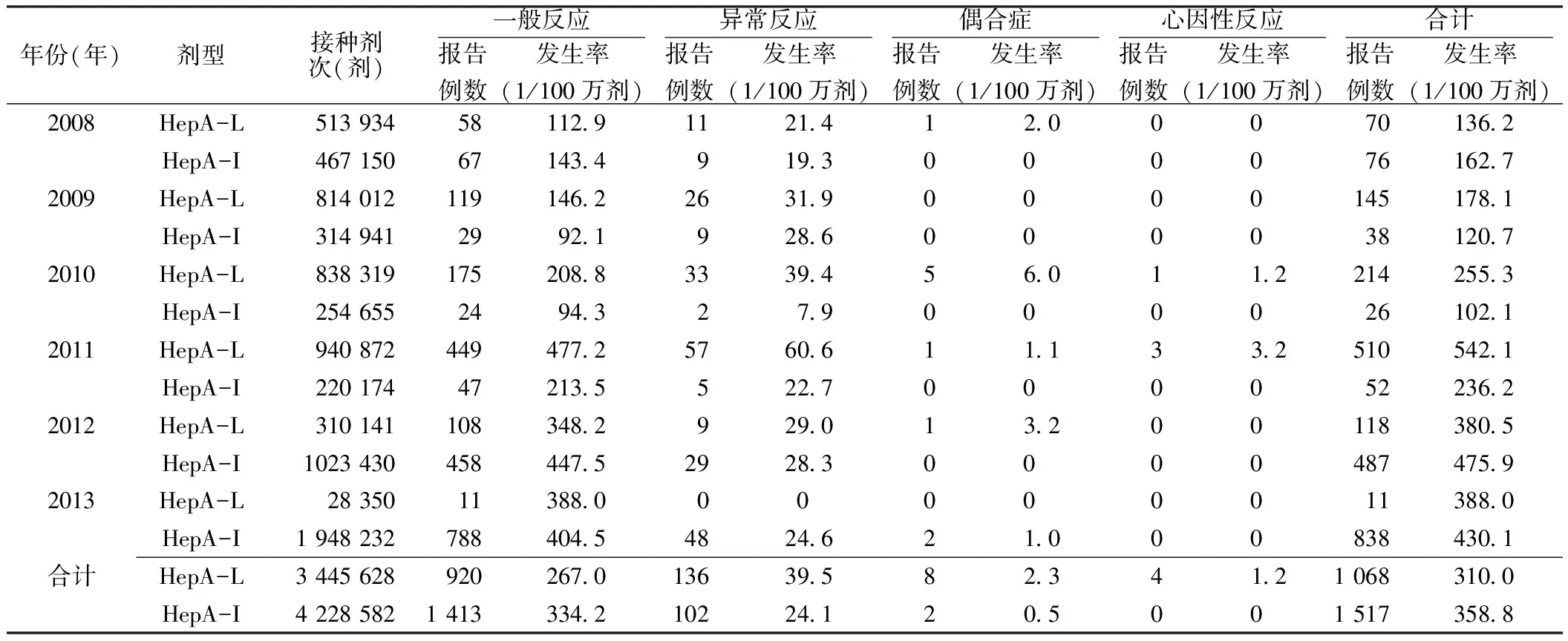
表1 江苏省2008—2013年HepA AEFI报告发生率
注:HepA-L=冻干甲型肝炎减毒活疫苗,HepA-I=甲型肝炎灭活疫苗
2.2 AEFI发生的地区分布 2008—2013年全省13个市均有HepA AEFI报告,HepA-L AEFI报告数位于前3位的是镇江市、盐城市和苏州市,合计报告565例(52.9%)。HepA-I AEFI报告数位于前3位的为镇江市、苏州市和徐州市,合计报告717例(47.3%,见图1)。
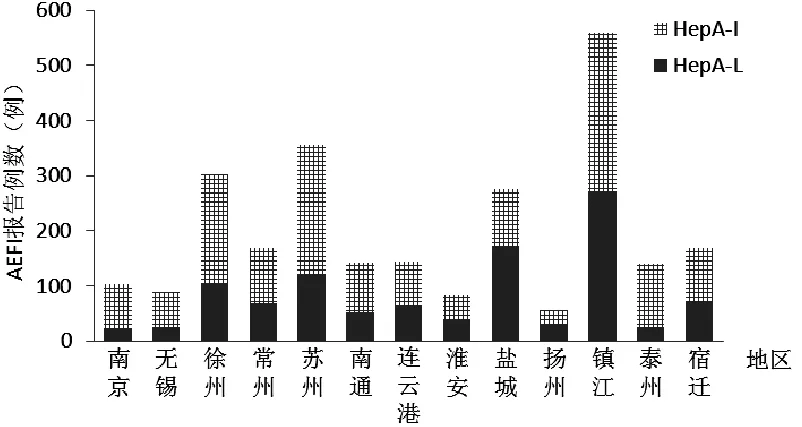
图1 江苏省2008—2013年HepA AEFI报告例数地区分布
Figure 1 Regional distribution of HepA AEFI cases in Jiangsu Province,2008—2013
2.3 AEFI发生的性别、年龄和季节分布 1 068例HepA-L和1 517例HepA-I AEFI中,男女性别比均为1.4∶1。HepA-L AEFI病例的年龄分布以1岁组为主,占83.1%。HepA-I AEFI病例的年龄分布以1岁组和2~3岁组为主,分别占57.7%和38.7%。HepA-L和HepA-I AEFI每个季节均有报告,春、夏季所占比例略高,分别为59.6%和61.6%,详见表2。
2.4 AEFI接种剂次分布 在1 068例HepA-L AEFI中,首剂接种1 051例(占98.4%);在1 517例HepA-I中,首剂接种1 047例(占69.0%),第2剂接种470例(占31.0%)。
2.5 不良反应的临床损害分布 与HepA-L和HepA-I预防接种有关的一般反应均以发热最为多见,发生率分别为222.0/100万剂和279.3/100万剂。异常反应均以过敏性皮疹为主,发生率分别为31.3/100万剂和20.1/100万剂。经AEFI调查诊断专家组调查诊断,共确诊19例严重异常反应,其中因接种HepA-L引起15例,发生率为4.4/100万剂:过敏性休克6例(1.7/100万剂)、过敏性紫癜5例(1.5/100万剂)、热性惊厥2例(0.6/100万剂)、喉头水肿1例(0.3/100万剂)和血小板减少性紫癜1例(0.3/100万剂)。因接种HepA-I引起4例,发生率为1.0/100万剂:过敏性紫癜2例(0.5/100万剂)、热性惊厥2例(0.5/100万剂,见表3)。
2.6 不良反应发生的时间间隔 HepA-L一般反应中89.8%的发热、78.3%的红肿和71.1%的硬结发生在接种后≤1 d;异常反应中,93.5%的过敏性皮疹、4/5的过敏性紫癜、5/5的荨麻疹和5/5的血管性水肿发生在接种后≤1 d,6/6的过敏性休克、喉头水肿、热性惊厥和斑丘疹发生在接种当天,1例血小板减少性紫癜发生在接种后>15 d。HepA-I一般反应中89.2%的发热、82.9%的红肿和69.6%的硬结发生在接种后≤1 d;异常反应中,87.1%的过敏性皮疹、8/10的荨麻疹、2/2的血管性水肿和2/2的过敏性紫癜发生在接种后≤1 d,2/2的热性惊厥和1/1斑丘疹发生在接种当天,详见表4。
2.7 不良反应病例转归分布 在1 056例HepA-L不良反应病例中,除1例过敏性紫癜病例转归不详外,其余均治愈或好转;1 515例HepA-I不良反应病例全部治愈或好转。19例严重异常反应病例中94.7%(18例)治愈或好转。

表2 江苏省2008—2013年HepA AEFI病例性别、年龄和季节分布〔n(%)〕
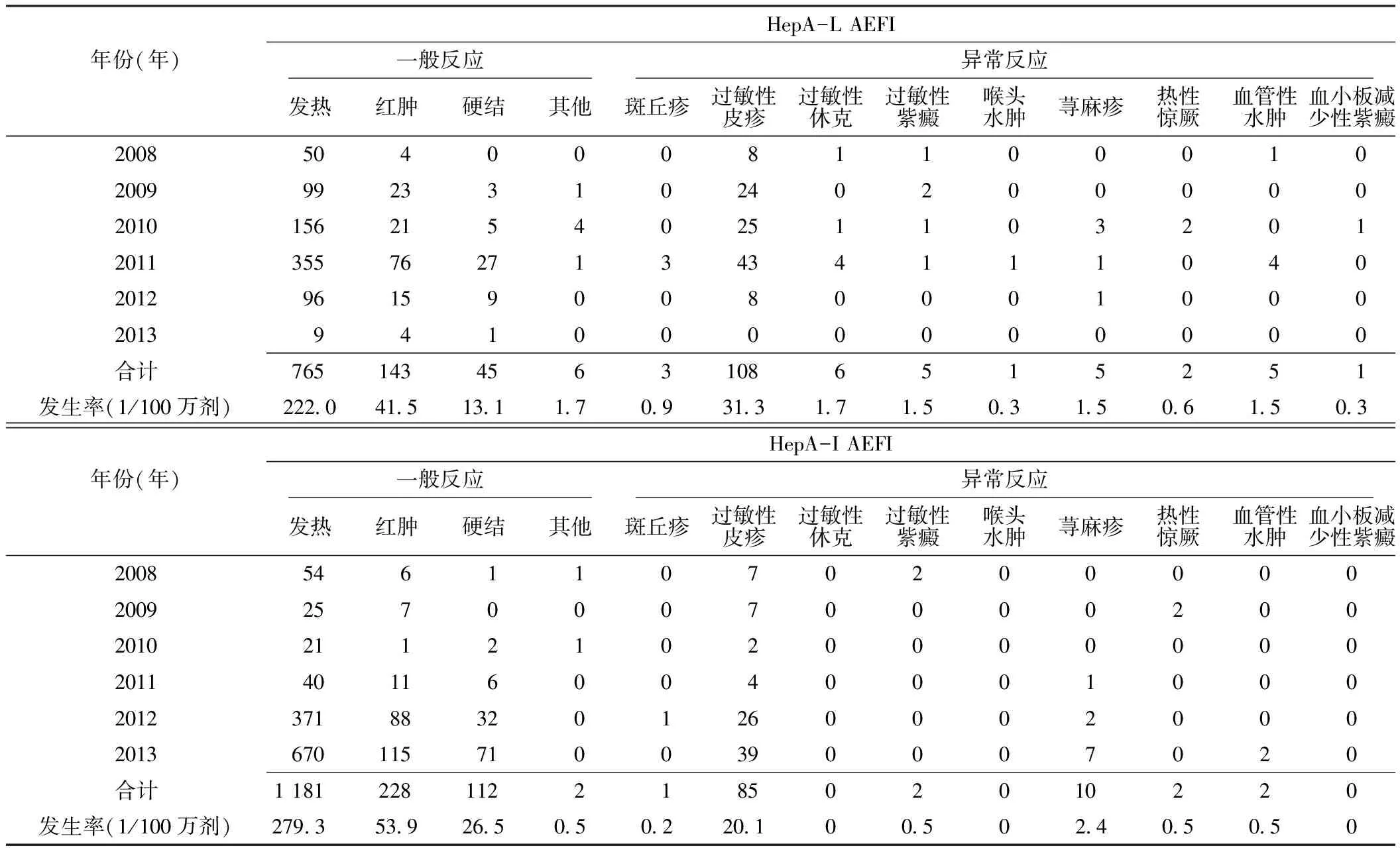
表3 江苏省2008—2013年HepA不良反应报告例数和报告发生率的临床损害分布

表4 江苏省2008—2013年HepA 不良反应报告例数按临床损害、接种到发病时间间隔分布
3 讨论
尽管现代的疫苗非常安全,但没有一种疫苗是完全没有风险的[7],预防接种后偶尔会发生不良反应,有些比较轻微,但有些也会威胁生命。因此,非常有必要开展预防接种安全性的监测。本研究对2008—2013年HepA接种后AEFI监测数据进行分析,为HepA安全性提供真实的区域性数据。
美国是最早将HepA-I列入儿童常规免疫接种范围的国家之一,其疫苗不良事件监测系统(VAERS)收集的1991—2001年的AEFI数据显示,HepA-I AEFI发生率为8.6/10万剂[8]。Schumacher等[9]对瑞士联邦公共卫生局(SFOPH)收集管理的1991—2001年AEFI监测数据分析显示,HepA-I和HepB(乙肝疫苗)AEFI报告发生率为2.2/10万剂。本研究监测数据显示,2008—2013年江苏省共报告HepA AEFI 2 585例,其中HepA-L 1 068例,平均报告发生率为310.0/100万剂;HepA-I 1 517例,平均报告发生率为358.8/100万剂,远高于美国、瑞士早期监测到的报告水平,可能与不同历史时期AEFI监测的不同发展阶段有关。武文娣等[10-12]报道的2010、2011和2012年全国HepA-L AEFI发生率(39.11/100万剂、9.39/10万剂和9.66/10万剂)、HepA-I AEFI发生率(47.06/100万剂、7.39/10万剂和15.06/10万剂)也远低于本研究报告水平,这说明江苏省AEFI监测敏感性高于同期全国平均水平。
HepA AEFI特征分析显示:全省13个市均有HepA AEFI报告,报告发生数居于首位的为镇江市。镇江丹阳市2007年承担国家AEFI主动监测项目以来,AEFI监测工作一直采用主动监测模式,而主动监测敏感性高于被动监测[13]。在性别分布上,男性略多于女性,与全国AEFI监测结果类似[10-12]。在年龄分布上,HepA-L AEFI以1岁组为主,占83.1%;HepA-I AEFI以1岁组和2~3岁组为主,分别占57.7%和38.7%。这与HepA接种的免疫程序(HepA-L,18月龄接种1剂;HepA-I,18月龄接种第1剂,24~30月龄接种第2剂)基本一致。HepA AEFI每个季节均有报告,春夏季所占比例略高,可能与天气炎热有关。在接种剂次分布上,HepA-L AEFI中首剂接种占98.4%;HepA-I AEFI首剂接种占69.0%,第2剂接种占31.0%。在发生时间间隔分布上,一般反应中,大多数反应发生在接种后≤1 d,随着发生间隔越长,发生比例逐渐降低,与一般反应的特征一致,多数为一过性反应。80.0%以上的异常反应发生在接种后1 d内,过敏性休克、喉头水肿、热性惊厥和斑丘疹发生在接种当天,仅1例血小板减少性紫癜发生在接种后15 d以上。提示HepA AEFI主要为接种后短时间内发生的不良反应,应关注接种后≤1 d的不良反应救治工作。
分析HepA AEFI发生的反应分类,以一般反应为主,其次是异常反应。分析HepA AEFI发生的原因与临床损害可见,与HepA-L和HepA-I预防接种有关的一般反应均以发热最为多见。异常反应均以过敏性皮疹为主。严重异常反应中, HepA-L共报告15例,发生率为4.4/100万剂:过敏性休克6例、过敏性紫癜5例、热性惊厥2例、喉头水肿1例和血小板减少性紫癜1例;HepA-I共报告4例,发生率为1.0/100万剂:过敏性紫癜2例、热性惊厥2例。比较HepA-L和HepA-I的不良反应报告情况,发现HepA-L一般反应报告发生率低于HepA-I,而HepA-L的异常反应报告发生率高于HepA-I,尤其表现在严重异常反应报告发生率上。武文娣等[10-12]报道的全国数据也显示了HepA-L的严重AEFI报告发生率高于HepA-I。世界卫生组织(WHO)西太平洋区2013年发布的《预防接种安全性监测指南》第2版[14]中没有给出HepA AEFI估算发生率,因此无法进行比较,不过其对HepB的过敏性休克估算发生率约为1.1/100万剂,本研究中HepA-L的过敏性休克报告发生率(1.7/100万剂)略高于该水平,HepA-I接种后未引起过敏性休克。
江苏省2008—2013年监测发现的HepA AEFI病例绝大多数为一过性反应,数天内可自愈。部分反应经过治疗后均治愈或好转,19例严重异常反应中18例治愈或好转。
本研究尚存在不足之处,即现有AEFI信息管理系统是被动监测系统,具有一定局限性,且不同地区的监测敏感性存在差异,不能较好地客观反映真实数据。
综上所述,HepA-L和HepA-I均具有较好的预防接种安全性,AEFI以一般反应为主,临床损害以发热、红肿、硬结和过敏性皮疹为主,绝大多数病例治愈或好转。异常反应主要为接种后短时间内发生的过敏反应,HepA-L仍需关注过敏性休克、喉头水肿等急性过敏反应信号的出现。今后应继续加强AEFI监测工作,提高AEFI监测的敏感性和数据利用率,达到早期发现不良事件的目的,并做出正确、迅速应对,以降低对个人健康和免疫规划的负面影响,增强公众对免疫规划信心,保障人群预防接种。
[1] 朱荣.江苏省2010年与2011年病毒性肝炎疫情对比分析[J].江苏预防医学,2012,23(3):38-40.
[2] WHO.WHO position paper on hepatitis A vaccines-June 2012[J].Wkly Epidemiol Rec,2012,87(28/29):261-276.
[3] Li H,Zhang XS,An J.Evaluation on the effect of immunization and safety of live attenuated and inactivated hepatitis A vaccine in China[J].Chinese Journal of Epidemiology,2013,34(1):24-27.(in Chinese) 李慧,张晓曙,安婧.中国甲型肝炎减毒活疫苗和灭活疫苗免疫效果与安全性评价[J].中华流行病学杂志,2013,34(1):24-27.
[4] Jiang WP,Wang YL,Chen WY,et al.Immunogenicity and safety of three consecutive lots on a inactivated hepatitis A vaccine:a double-blind,randomized and controlled trial in children[J].Chinese Journal of Epidemiology,2008,29(6):556-559.(in Chinese) 姜维平,王亚龙,陈文宇,等.连续三批甲型肝炎灭活疫苗在儿童中应用的免疫原性和安全性研究[J].中华流行病学杂志,2008,29(6):556-559.
[5] 刘卫民,何梅英,陈国翠.大规模接种甲肝减毒疫苗副反应观察[J].中国公共卫生,2004,20(8):952.
[6] Jiang M,Li B,Peng SQ,et al.Safety and serological effect of revaccination of inactivated hepatitis A vaccine and combined inactivated hepatitis A and B vaccine in healthy children[J].Chinese Journal of Vaccines and Immunization,2013,19(4):312-318.(in Chinese) 姜梅,李波,彭松青,等.健康幼儿甲型肝炎灭活疫苗及甲乙型肝炎联合灭活疫苗再免疫血清学效果及安全性研究[J].中国疫苗和免疫,2013,19(4):312-318.
[7] WHO.Global advisory committee on vaccine safety,December 2012[J].Wkly Epidemiol Rec,2013,88(6):65-72.
[8] Zhou W,Pool V,Iskander JK,et al.Surveillance for safety after immunization:vaccine adverse event reporting system(VAERS)——United States,1991-2001[J].MMWR Surveill Summ,2003,52(1):1-24.
[9] Schumacher Z,Bourquin C,Heininger U.Surveillance for adverse events following immunization(AEFI) in Switzerland——1991-2001[J].Vaccine,2010,28(24):4059-4064.
[10] Wu WD,Liu DW,Li KL,et al.Analysis on adverse events following immunization surveillance in China,2010[J].Chinese Journal of Vaccines and Immunization,2012,18(5):385-397.(in Chinese) 武文娣,刘大卫,李克莉,等.中国2010年疑似预防接种异常反应监测数据分析[J].中国疫苗和免疫,2012,18(5):385-397.
[11] Wu WD,Li KL,Zheng JS,et al.Analysis on surveillance data of adverse events following immunization in China,2011[J].Chinese Journal of Vaccines and Immunization,2013,19(2):97-109.(in Chinese) 武文娣,李克莉,郑景山,等.中国2011年疑似预防接种异常反应监测数据分析[J].中国疫苗和免疫,2013,19(2):97-109.
[12] Wu WD,Liu DW,Li KL,et al.Analysis on surveillance data of adverse events following immunization in China,2012[J].Chinese Journal of Vaccines and Immunization,2014,20(1):1-12.(in Chinese) 武文娣,刘大卫,李克莉,等.中国2012年疑似预防接种异常反应监测数据分析[J].中国疫苗和免疫,2014,20(1):1-12.
[13] Top KA,Constantinescu CM,Laflèche J,et al.Applicability of the Brighton Collaboration Case Definition for seizure after immunization in active and passive surveillance in Canada[J].Vaccine,2013,31(48):5700-5705.
[14] WHO&WPR0.Immunization Safety Surveillance:guidelines for immunization programme managers on surveillance of adverse events following immunization[S].2nd ed.Manila,2013.
(本文编辑:赵跃翠)
Analysis on the Surveillance of Adverse Events Following Immunization of Hepatitis A Vaccine in Jiangsu Province From 2008 to 2013
GAOJun,ZHANGJin-lin,MAFu-bao.
JiangsuProvincialCenterforDiseaseControlandPrevention,Nanjing210009,China
Objective To analyze the epidemiological features of adverse events following immunization(AEFI) of hepatitis A vaccine(HepA) in Jiangsu Province and to evaluate the safety of the inoculation of HepA.Methods The HepA AEFI data and HepA inoculation data of Jiangsu Province from 2008 to 2013 were collected through the AEFI information system and the Information System of the Expanded Programme on Immunization of Jiangsu Province.Descriptive epidemiology method was used to analyze relevant indicators.Results A total of 2 585 HepA AEFI cases were reported during the period,including 1 068 HepA-L AEFI cases and 1 517 HepA-I AEFI cases,and the annual average incidence was 310.0/106 and 358.8/106 respectively.For adverse events of HepA-L,the reporting rate of common adverse events was 267.0/106(920),the reporting rate of rare adverse events was 39.5/106(136).For adverse events of HepA-I,the reporting rate of common adverse events was 334.2/106(1 413),the reporting rate of rare adverse events was 24.1/106(102).People aged 1 year old accounted for 83.1% among HepA-L AEFI cases;people aged 1 years old and 2 to 3 years old accounted for 57.7% and 38.7% respectively among HepA-I AEFI cases.The male-to-female ratio was 1.4∶1 among both HepA-L and HepA-I AEFI cases.And both HepA-L and HepA-I AEFI cases were reported in each season,but the proportion was slightly higher in spring and summer,accounted for 59.6% and 61.6% respectively.The main symptoms of common adverse events were fever,red and swelling and indurations;the main diagnoses of rare vaccine reactions were anaphylactic rashes.Most adverse events happened within 1d after vaccination.Conclusion HepA-L and HepA-I have good immunization safety.Fever,red and swelling,indurations and anaphylactic rash are the predominant diagnosrs following immunization and most adverse events happen within 1d after vaccination.However,the surveillance should still focus on the anaphylactoid reactions after HepA-L immunization in future.
Hepatitis A vaccines;Mass vaccination;Adverse events following immunization
210009江苏省南京市,江苏省疾病预防控制中心
R 186
A
10.3969/j.issn.1007-9572.2015.23.025
2015-01-20;
2015-06-20)
高君,张晋琳,马福宝.2008—2013年江苏省甲型肝炎疫苗疑似预防接种异常反应监测分析[J].中国全科医学,2015,18(23):2851-2856.[www.chinagp.net]
Gao J,Zhang JL,Ma FB.Analysis on the surveillance of adverse events following immunization of hepatitis a vaccine in Jiangsu Province from 2008 to 2013[J].Chinese General Practice,2015,18(23):2851-2856.
