活血解毒方对糖尿病大鼠视网膜病变的影响研究
2015-02-21郝改梅武志黔薛晓兴李玉波
何 洁,郝改梅,武志黔,韩 静,吴 晏,薛晓兴,李玉波,王 伟
·专题研究·
活血解毒方对糖尿病大鼠视网膜病变的影响研究
何 洁,郝改梅,武志黔,韩 静,吴 晏,薛晓兴,李玉波,王 伟
目的 观察活血解毒方对糖尿病大鼠视网膜中转化生长因子-β2(TGF-β2)、Smad2及基质金属蛋白酶9(MMP-9)、基质金属蛋白酶2(MMP-2)、Ⅳ型胶原表达的影响,从TGF-β/Smads信号转导通路调控基质代谢的角度探讨活血解毒方改善糖尿病大鼠视网膜病变的可能作用机制。方法 SPF级雄性SD大鼠12只,大鼠适应性喂养1周后,按照随机数字表法选取8只大鼠以65 mg/kg的剂量一次性腹腔注射链脲佐菌素(STZ),诱导糖尿病模型。剩余4只作为正常组注射等量的柠檬酸钠溶液。1周后尾静脉采血检测血糖,以禁食12 h血糖≥16.7 mmol/L为糖尿病模型造模成功。将8只糖尿病模型大鼠按照拉丁方设计,分为模型组和活血解毒方组,各4只。活血解毒方组给予活血解毒方7.70 g/kg,1次/d,正常组和模型组予以等体积纯净水,持续16周。采用Real-time PCR法检测大鼠视网膜中TGF-β2mRNA及Smad2 mRNA的表达;Western blotting检测MMP-9、MMP-2蛋白的表达;免疫组织化学法检测Ⅳ型胶原的表达。结果 3组大鼠视网膜中TGF-β2mRNA、Smad2 mRNA表达比较,差异均有统计学意义(F=6.232,P=0.034;F=9.518,P=0.014),其中模型组和活血解毒方组视网膜中TGF-β2mRNA、Smad2 mRNA表达水平均高于正常组;活血解毒方组视网膜中TGF-β2mRNA、Smad2 mRNA表达水平均低于模型组(P<0.05)。3组大鼠视网膜中MMP-9、MMP-2蛋白表达比较,差异均有统计学意义(F=17.387,P=0.001;F=8.593,P=0.008),其中模型组和活血解毒方组视网膜中MMP-9、MMP-2蛋白表达均高于正常组(P<0.05);活血解毒方组视网膜中MMP-9、MMP-2蛋白表达均低于模型组(P<0.05)。正常组大鼠视网膜中Ⅳ型胶原表达低,呈淡棕色;模型组:视网膜Ⅳ型胶原表达升高,呈深棕褐色;活血解毒方组:视网膜Ⅳ型胶原表达呈淡褐色,较模型组表达降低。结论 活血解毒方可能通过下调TGF-β2mRNA及Smad2 mRNA的表达,干预TGF-β/Smads信号转导通路调控基质代谢,使MMP-9、MMP-2、Ⅳ型胶原的表达下调,从而改善糖尿病视网膜病变。
糖尿病视网膜病变;活血解毒方;TGF-β/Smads信号转导通路;基质代谢
何洁,郝改梅,武志黔,等.活血解毒方对糖尿病大鼠视网膜病变的影响研究[J].中国全科医学,2015,18(5):507-512.[www.chinagp.net]
He J,Hao GM,Wu ZQ,et al.Effects of huoxue jiedu recipe on retinopathy in diabetic rats[J].Chinese General Practice,2015,18(5):507-512.
糖尿病视网膜病变(diabetic retinopathy,DR)是糖尿病最严重和最常见的微血管并发症之一,是工作年龄人群主要的致盲原因[1]。研究表明,TGF-β/Smads信号转导通路可调控基质金属蛋白酶(matrix metalloproteinases,MMPs)的表达[2]。TGF-β/Smads信号转导通路在DR的病理过程中发挥着十分复杂的作用,能够调控细胞外基质(extracellulamatrix,ECM)的代谢,其中转化生长因子-β2(transforming growth factor-β2,TGF-β2)作为TGF-β的亚型之一,主要在视网膜组织中表达,Smad2蛋白是TGF-β下游信号的重要转导分子[3]。MMPs是参与ECM代谢的重要酶类[4],MMP-2、MMP-9是MMPs分布最广的两种亚型,能够降解Ⅳ型胶原等多种蛋白[5],而Ⅳ型胶原是基底膜的主要成分之一[6]。活血解毒方由鬼箭羽和黄连等中药组成,具有滋阴清热、活血化瘀的功效,是临床经验方。有研究发现,活血解毒方对糖尿病微血管病变有明显的改善作用,但其确切的作用机制尚不十分明确[7-11]。本实验通过检测TGF-β2、Smad2及MMP-9、MMP-2、Ⅳ型胶原在糖尿病大鼠视网膜中的表达,从TGF-β/Smads信号转导通路调控基质代谢的角度探讨活血解毒方影响糖尿病大鼠视网膜病变的可能机制。
1 资料与方法
1.1 动物 SPF级雄性SD大鼠30只,周龄7周,体质量160~190 g,购自北京维通利华实验动物技术有限公司,许可证号SCXK(京)2012-0001。SD大鼠在北京中医药大学实验动物中心SPF实验室饲养,室内温度20~25 ℃、相对湿度50%~60%、换气次数10~15次/h,12 h/d光照维持,昼夜循环。造模前对大鼠进行眼部及全身状况检查,以排除原发疾患,并检测血糖,确保造模前大鼠血糖值均正常。大鼠自由摄食饮水,颗粒饲料喂养,每周监测体质量,每4周检测血糖。动物模型建立前,18只大鼠死亡,共入选12只大鼠。
1.2 药品与试剂 活血解毒方由鬼箭羽和黄连等组成,由北京中医药大学中药学院制备,使用时制备成0.77 g/ml水溶液。链脲佐菌素(streptozotocin,STZ),Sigma S0130,北京创信生物公司分装。RIPA裂解液C1053、磷酸酶抑制剂P1260、HRP标羊抗兔C1309、HRP标羊抗小鼠C1308、30%丙烯酰胺溶液B1000、TEMED、4×分离胶缓冲液B1004、4×浓缩胶缓冲液B1003、封闭专用脱脂奶粉P1622、膜再生液P1650、10×电泳缓冲液B1005、10×电转缓冲液B1006、10×封闭洗涤缓冲液B1009、PVDF膜P2120、superECL Plus超敏发光液P1010、X线暗盒E1101等均为北京普利莱基因技术有限公司生产。Anti-MMP-9 antibody ab119906、Anti-MMP-2 antibody ab37150、Anti-GAPDH antibody ab8245、Anti-collagenⅣ antibody ab6586,abcam,艾博抗(上海)贸易有限公司。Total RNA提取试剂盒0960602、qPCR试剂盒0960212,北京旷博生物技术有限公司。PCR引物由生工生物工程(上海)股份有限公司北京合成部合成。免疫组化检测试剂盒(兔鼠通用型)GK500705、抗原修复液GT100411,基因科技(上海)有限公司。抗体稀释液,DakoCA9013,美国。
1.3 仪器 Optium Xceed“安妥超越”血糖仪与Optium试纸(雅培糖尿病护理有限公司),反转录仪(伯乐C1000),Real-time PCR仪(AB公司),小型转印仪(伯乐),BIO-RAD凝胶成像系统(7218R04420,美国),眼科手术剪、显微镊(苏州器械厂),OLYMPUS显微镜(TH-200)。
1.4 方法
1.4.1 动物模型的建立、分组与给药 大鼠适应性喂养1周后,禁食12 h,STZ溶解于0.1 mmol/L柠檬酸钠溶液(冰盒中新鲜配制,pH 4.5),按随机数字表法选取8只大鼠以65 mg/kg的剂量一次性腹腔注射STZ,诱导糖尿病模型。剩余4只作为正常组注射等量的柠檬酸钠溶液。1周后尾静脉采血检测血糖,以禁食12 h血糖≥16.7 mmol/L为糖尿病模型造模成功。第19周进行电镜检查,确定糖尿病模型大鼠确已发生病变,判断标准:视网膜毛细血管基底膜增厚且不连续,内皮细胞线粒体肿胀,空泡样变;膜盘间隙增宽;外核层细胞排列不规则,核染色质分布不均。将8只糖尿病模型大鼠按照拉丁方设计,分为模型组和活血解毒方组,各4只,分组原则为组间体质量和血糖值均有可比性。活血解毒方组给予活血解毒方7.70 g/kg(相当于临床用药量的7倍灌胃),1次/d,正常组和模型组予以等体积纯净水,持续16周。
1.4.2 检测指标及方法
1.4.2.1 Real-time PCR法检测TGF-β2mRNA及Smad2 mRNA在视网膜组织的表达 Trizol一步法提取总RNA。反转录反应体系:总RNA 3 μg,OligodT 1 μl,dNTP 2 μl,5×Buffer 4 μl,反转录酶1 μl,加入经DEPC处理的无菌水至20 μl;反应条件:42 ℃ 1 h,70 ℃ 5 min终止反应。反应结束后,-20 ℃冰箱保存备用。从GenBank获得目的基因mRNA的全长序列,利用引物和探针设计软件Primer 5.0设计引物序列。经过Blast分析,引物序列具有特异性。以GAPDH为内对照进行Real-time PCR反应。引物序列:GAPDH上游5′-ACCACAGTCCATGCCATCAC-3′,下游5′-TCCACCACCCTGTTGCTGTA-3′;TGF-β2上游5′- CTCCATACAGTCCCAGGTGC-3′,下游5′-GCAAGCGAAA GACCCTGAAC-3′;Smad2上游5′-ATGTCGTCCATCTTGCCATTC-3′,下游5′-AACCGTCCTGTTTTCTTTAGCTT-3′。反应体系:cDNA 1 μl,Mix 5 μl,引物0.8 μl,Rox 0.2 μl,加DEPC水至10 μl。反应条件:95 ℃预变性5 min;95 ℃变性30 s,55 ℃退火1 min,72 ℃延伸30 s,共40个循环。反应结束后,读取每份样品中目的基因的Ct值,并与其内参基因的Ct值相减得出相对Ct值,以第一个相对Ct值为基线,将后面的相对Ct值与其进行减法运算,得出n值后进行相对运算,运算法则为1/2^n。
1.4.2.2 Western blotting检测MMP-9、MMP-2蛋白在视网膜组织的表达 将所取的单眼视网膜加入RIPA裂解液约200 μl,在冰上用高速组织分散器匀浆,4 ℃ 10 000 r/min离心10 min后,转移上清液至EP管中,BCA法测定蛋白质含量。蛋白与5 μl上样缓冲液混匀,沸水浴煮10 min后点样于质量分数10%聚丙烯酰胺凝胶进行SDS-PAGE电泳,先80 V稳压电泳待样品跑出浓缩胶调电压至120 V,剪取与凝胶大小一致的PVDF膜及6张滤纸,浸于电转液中,待电泳结束,按(正极)3层滤纸→PVDF→凝胶→3层滤纸(负极)的顺序做好“三明治夹”,300 mA直流电转1.5 h。然后将PVDF膜取出至于平皿中,50 g/L脱脂奶粉37 ℃封闭1 h后,分别加入一抗MMP-9(1∶500)和MMP-2(1∶250),4 ℃反应过夜。TBST漂洗3次,10 min/次,分别加入1∶500稀释的羊抗小鼠IgG-HRP和1∶250的羊抗兔IgG-HRP,室温摇床作用2 h,TBST漂洗3次,10 min/次。加入ECL显影液显影,用Bio-Rad凝胶成像系统照相并进行光密度分析。同法检测GAPDH内参照蛋白,通过目的基因与内参基因条带的光密度比值作为MMP-9和MMP-2蛋白的相对含量分析。
1.4.2.3 免疫组织化学法检测Ⅳ型胶原在视网膜组织的表达 用4%多聚甲醛溶液(4 ℃保存)固定大鼠眼球,48 h以后经脱水、石蜡包埋、切片,采用二步法进行免疫组织化学染色。石蜡切片脱蜡,梯度酒精脱水;流水漂洗10 min,抗原微波修复;PBS洗3次(5 min/次),3% H2O2封闭15 min,流水冲洗5 min,PBS洗3次(5 min/次);滴加一抗collagenⅣ 1∶400,4 ℃,湿盒孵育过夜后,37 ℃复温45 min,PBS洗3次(5 min/次);滴加二抗,37 ℃孵育2 h,PBS洗3次(5 min/次);DAB显色至背景变黄,流水冲洗15 min;苏木精复染10 s,流水冲洗15 min;梯度酒精脱水,二甲苯透明,中性树脂封片。光学显微镜下观察、拍照。
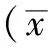
2 结果
2.1 各组视网膜中TGF-β2mRNA、Smad2mRNA表达比较 3组视网膜中TGF-β2mRNA、Smad2mRNA表达比较,差异均有统计学意义(F=6.232,P=0.034;F=9.518,P=0.014),其中模型组和活血解毒方组视网膜中TGF-β2mRNA、Smad2mRNA表达水平均高于正常组,差异有统计学意义(P<0.05);活血解毒方组视网膜中TGF-β2mRNA、Smad2mRNA表达水平均低于模型组,差异有统计学意义(P<0.05,见表1)。
表1 各组大鼠视网膜中TGF-β2mRNA、Smad2mRNA表达比较
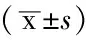
Table1ComparisonofTGF-β2mRNAandSmad2mRNAexpressionsineachretinasofratsgroup

组别例数☆TGF-β2mRNASmad2mRNA正常组30235±02160563±0178模型组32146±0692∗4725±1873∗活血解毒方组31410±0496∗△2517±0670∗△
注:与正常组比较,*P<0.05;与模型组比较,△P<0.05;☆表示数据有缺失
2.2 各组视网膜中MMP-9、MMP-2蛋白表达比较 3组大鼠视网膜中MMP-9、MMP-2蛋白表达比较,差异均有统计学意义(F=17.387,P=0.001;F=8.593,P=0.008),其中模型组和活血解毒方组视网膜中MMP-9、MMP-2蛋白表达均高于正常组,差异有统计学意义(P<0.05);活血解毒方组视网膜中MMP-9、MMP-2蛋白表达均低于模型组,差异有统计学意义(P<0.05,见表2)。
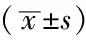
Table2ComparisonofMMP-9,MMP-2proteinexpressionsineachretinasofratsgroup
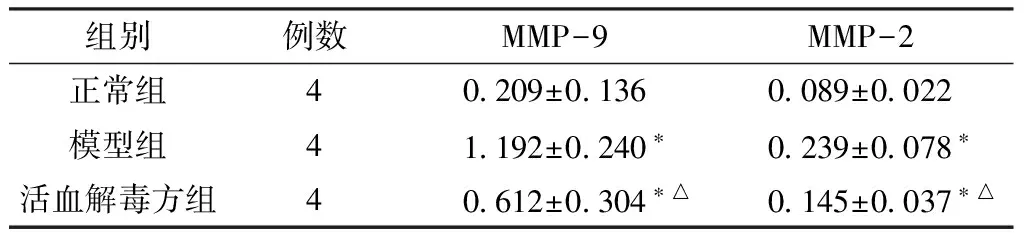
组别例数MMP-9MMP-2正常组40209±01360089±0022模型组41192±0240∗0239±0078∗活血解毒方组40612±0304∗△0145±0037∗△
注:与正常组比较,*P<0.05;与模型组比较,△P<0.05;MMP-9=基质金属蛋白酶9,MMP-2=基质金属蛋白酶2
2.3 各组视网膜中Ⅳ型胶原的表达 Ⅳ型胶原阳性细胞表现为胞质着色呈棕褐色,主要在神经节细胞层胞质和血管内皮细胞有阳性表达,糖尿病组大鼠随着病情发展,视网膜内核层细胞也有阳性表达。镜下可见:正常组大鼠视网膜中Ⅳ型胶原表达低,呈淡棕色;模型组:视网膜Ⅳ型胶原表达升高,呈深棕褐色;活血解毒方组:视网膜Ⅳ型胶原表达呈淡褐色,较模型组表达降低(见图1)。
3 讨论
视网膜微循环障碍是DR发生的基础[3],其病理改变过程为毛细血管内皮细胞间连接松弛,通透性增加,基底膜增厚;周细胞丢失,管壁空洞样变;内皮细胞过度增殖,屏障功能损害,血液成分渗出,毛细血管闭塞,引起视网膜水肿及新生血管形成,同时伴随纤维组织增生等改变[12]。
TGF-β是一种多功能双向细胞因子,调节多种靶基因表达,可抑制内皮细胞增殖,也可促进新生血管管腔形成,还可以刺激ECM合成,促使ECM沉淀,刺激胶原蛋白合成增多,在DR的病理过程中发挥着十分重要的作用。TGF-β有多种亚型,在视网膜组织中主要表达TGF-β2。Smad2蛋白是TGF-β下游信号的重要转导分子,在TGF-β/Smad信号转导通路中发挥着重要作用[3,13]。有研究发现,TGF-β2可以提高α平滑肌肌动蛋白的表达,而α平滑肌肌动蛋白表达的上调可以促使Smad2发生核内转移,使视网膜周细胞由生长增殖状态到生长抑制状态,退出生长周期[14-15]。说明Smad2在DR视网膜新生血管形成中起着重要作用。Ochiai等[16]发现糖尿病患者玻璃体中总TGF-β2和活化TGF-β2水平显著高于正常对照组,本实验结果与之相符。
ECM是DR增生膜的主要成分,MMP-9、MMP-2是参与ECM代谢的关键酶类,其高表达能够分解ECM产物,有助于血管内皮细胞冲破基底膜,向间质组织内部进一步伸展[17]。同时,MMPs分子能够分解Ⅳ型胶原[18],从而破坏内皮细胞间的紧密连接,为新生血管生成创造空间[17]。而基底膜和间质胶原蛋白的降解产物对血管内皮细胞也有趋化作用,有利于血管内皮细胞的定向迁移,从而形成新生血管。基底膜主要由Ⅳ型胶原、层粘连蛋白等构成,是位于毛细血管周围特殊形式的ECM。基底膜增厚是DR的特征性改变之一。糖尿病代谢紊乱使Ⅳ型胶原合成增加,分解减慢,并在基底膜沉积[6]。Kowluru等[19]发现在患糖尿病2个月和12个月的大鼠体内,MMP-9激活,高血糖诱发的MMP-9活化会加快视网膜毛细血管细胞凋亡,这是糖尿病视网膜病变的前兆。赵宏等[20]用反转录聚合酶链反应(RT-PCR)和放射免疫方法分别检测20例PDR和10例正常对照玻璃体切除物中MMP-2、MMP-9 mRNA的表达与MMP-2、MMP-9的含量,结果PDR玻璃体切除物中MMP-2、MMP-9 mRNA与MMP-2、MMP-9的含量均高于正常对照组。本实验用Western blotting检测MMP-9、MMP-2蛋白在视网膜组织中的表达结果与之相符。魏玲格等[6]应用光镜、免疫组织化学、电镜等技术,研究不同时间点SD大鼠视网膜Ⅳ型胶原蛋白和毛细血管基底膜的厚度变化,结果显示随着糖尿病病程的发展,视网膜毛细血管基底膜不断增厚并伴有Ⅳ型胶原蛋白的增加,本实验结果与之相符。

注:A为正常组;B为模型组;C为活血解毒方组
图1 各组大鼠视网膜中Ⅳ型胶原的表达(苏木精染色,×400)
Figure 1 Expression of collagen Ⅳ in retinas of rats groups
中医称DR为消渴目病,病机以气阴两虚为基础,肾阴亏损、肺胃津亏,从而燥热内生,阴虚燥热,烧伤脉络致血瘀脉外,血行不畅、痰瘀互结、目络瘀阻,治宜滋阴补肾、益气养阴、活血化瘀[21]。活血解毒方是临床经验方,由鬼箭羽和黄连等中药组成,具有滋阴清热、活血化瘀的功效。前期研究发现,活血解毒方可降低糖化血红蛋白[11],同时还能够降低视网膜血管内皮生长因子(VEGF)的表达,增加色素上皮衍生因子(PVDF)的表达[7],抑制血管紧张素Ⅱ(AngⅡ)及内皮素-1(ET-1)的表达[9],能改善DR血流状况,抑制毛细血管增生,从而改善由于高血糖引起的糖尿病视网膜微循环障碍[8],对糖尿病微血管病变有明显的改善作用。本实验表明,活血解毒方改善糖尿病大鼠视网膜功能的作用可能与下调TGF-β2mRNA及Smad2 mRNA的表达,干预TGF-β/Smads信号转导通路调控基质代谢,从而下调MMP-9、MMP-2、Ⅳ型胶原的表达有关。但是TGF-β/Smads信号转导通路调控基质代谢是一个十分复杂的过程,仍然需要进一步研究与之相关的Smad7蛋白、基质金属蛋白酶抑制物-1(TIMP-1)、Ⅰ型胶原等表达的变化,以期阐明DR的发病机制,为活血解毒方用于临床治疗DR提供可靠的实验依据。
[1]Johnstone MT,Veves A.糖尿病与心血管疾病[M].孙丰雷,译.济南:山东科学技术出版社,2008:261.
[2]Mo N,Li ZQ,Li J,et al.Curcumin inhibits TGF-β1-induced MMP-9 and invasion through ERK and Smad signaling in breast cancer MDAMB-231 cells[J].Asian Pac J Cancer Prev,2012,13(11):5709-5714.
[3]Cao D,Liu L.Effects of TGF-β/Smads signal pathway on diabetic retinopathy[J].International Journal of Ophthalmology,2005,6(5):532-536.(in Chinese) 曹丹,柳林.TGF-β/Smads信号转导通路与糖尿病视网膜病变[J].国际眼科杂志,2005,6(5):532-536.
[4]Shi CS,Shi L.Effects of MMPs on diabetic retinopathy[J].China Foreign Medical Treatment,2009,28(25):156-157.(in Chinese) 史春生,石磊.MMPs与糖尿病视网膜病变[J].中外医疗,2009,28(25):156-157.
[5]Lan L,Hui YN,Zeng GW.Inhibitive effects of angiogenin-1 on retinal capillaries lesion,matrix metalloproteinase and vascular endothelial growth factor of diabetes rats[J].Recent Advances in Ophthalmology,2012,32(10):926-930.(in Chinese) 兰兰,惠延年,曾光伟.血管生成素-1对糖尿病大鼠视网膜微血管病变、基质金属蛋白酶和血管内皮生长因子的抑制作用[J].眼科新进展,2012,32(10):926-930.
[6]Wei LG,Wang CL,Duan HJ.Pathological research in experimental diabetes in rats[J].Chinese Journal of Ophthalmology,2002,38(9):523-525.(in Chinese) 魏玲格,王长龄,段惠军.实验性糖尿病视网膜微血管病变的病理研究[J].中华眼科杂志,2002,38(9):523-525.
[7]Yao Q,Han J,Huang LM,et al.Effect of Huoxue Jiedu Formula on expression of pigment epithelium derived factor in retina of rats with diabetes[J].China Journal of Experimental Traditional Medical Formulae,2011,17(23):162-165.(in Chinese) 姚青,韩静,黄黎明,等.活血解毒方对糖尿病大鼠视网膜PEDF表达的影响[J].中国实验方剂学杂志,2011,17(23):162-165.
[8]Yao Q,Han J,Yu JD,et al.Effects of Huoxue Jiedu Recipe on retinopathy in diabetic rats[J].Chinese Journal of Integrated Traditional and Western Medicine,2012,32(3):362-366.(in Chinese) 姚青,韩静,余俊达,等.活血解毒方对糖尿病大鼠视网膜病变的影响[J].中国中西医结合杂志,2012,32(3): 362-366.
[9]Yao Q,Han J,Huang LM,et al.Effect of Huoxue Jiedu Formula on endothelin-1 in retina of diabetic rats [J].Chinese Journal of Experimental Traditional Medical Formulae,2012,18(20):169-172.(in Chinese) 姚青,韩静,黄黎明,等.活血解毒方对糖尿病大鼠视网膜病变内皮素-1表达的影响[J].中国实验方剂学杂志,2012,18(20):169-172.
[10]Yao Q,Han J,Huang LM,et al.Effect of Huoxue Jiedu Formula on vascular endothelial growth factor in retina of diabetic rats[J].China Journal of Traditional Chinese Medicine and Pharmacy,2012,27(5):1277-1279.(in Chinese) 姚青,韩静,黄黎明,等.活血解毒方对糖尿病大鼠视网膜血管内皮生长因子表达的影响[J].中华中医药杂志,2012,27(5):1277-1279.
[11]Yu JD,Han J,Pan Q,et al.The influence of herbal extracts acting on GLUT-1 in red blood cells in SD diabetic rats[J].Journal of Jiangxi University of Traditional Chinese Medicine,2010,22(4):58-60.(in Chinese) 余俊达,韩静,潘秋,等.活血清热方对糖尿病大鼠红细胞中葡萄糖转运蛋白1的影响[J].江西中医学院学报,2010,22(4):58-60.
[12]Armulik A,Abramsson A,Betsholtz C.Endothelial/pericyte interactions[J].Circ Res,2005,97(6):512-523.
[13]刘绍燕.密蒙花方防治糖尿病视网膜病变TGF-β/Smad信号转导机制研究[D].北京:中国中医科学院,2009.
[14]Spirin KS,Saghizadeh M,Lewin SL,et al.Basement membrane and growthfactor gene expression in normal and diabetic human retinas[J].Curr Eye Res,1999,18(6):490-499.
[15]Papetti M,Shujath J,Riley KN,et al.FGF-2 antagonizes the TGF-beta1-mediated induction of pericyte alpha-smooth muscle actin expression:a role formyf-5 and Smad-mediated signaling pathways[J].Invest Ophthalmol Vis Sci,2003,44(11):4994-5005.
[16]Ochiai Y,Ochiai H.Higher concentration of transforminggrowthfactor-beta in aqueous humor of glaucomatouseyes and diabetic eyes[J].Jpn J Ophthalmol,2002,46(3):249-253.
[17]Miyata Y,Iwata T,Ohba K,et al.Expression of matrix metalloproteinase-7 on cancer cells and tissue endothelial cells in renal careinoma:prognostic implications and clinical significance for invasion and metastasis[J].Clin Cancer Res,2006,12:6998-7003.
[18]Feng S,Song JD.Extracellular matrix degrading enzymes involved in tumor invasion and metastasis[J].Cancer Research on Prevention and Treatment,1999,26(1):72- 74.(in Chinese) 冯树,宋今丹.参与肿瘤侵袭和转移的细胞外基质降解酶[J].肿瘤防治研究,1999,26(1):72-74.
[19]Kowluru RA.Role of matrix metalloproteinase-9 in the development of diabetic retinopathy and its regulation by H-ras[J].Invest Ophthalmol Vis Sci,2010,51(8):4320-4326.
[20]Zhao H,Zhang XF.Expression of MMP-2 and MMP-9 in vitrectomy specimens with proliferative diabetic retinopathy[J].Journal of Zhengzhou University,2007,42(3):556-557.(in Chinese) 赵宏,张效房.增生性糖尿病视网膜病变玻璃体切除物中MMP-2和MMP-9的表达[J].郑州大学学报,2007,42(3): 556-557.
[21]Yuan W,Jin M,Pan L,et al.Effect of Yiqi Huoxue therapy on vascular endothelial growth factor in retina of diabetic rats[J].China Journal of Traditional Chinese Medicine and Pharmacy,2010,25(5):758-760.(in Chinese) 苑维,金明,潘琳,等.益气活血方对糖尿病大鼠视网膜微血管病变血管内皮生长因子表达的影响[J].中华中医药杂志,2010,25(5):758-760.
(本文编辑:贾萌萌)
Effects of Huoxue Jiedu Recipe on Retinopathy in Diabetic Rats
HEJie,HAOGai-mei,WUZhi-qian,etal.
BasicMedicalCollege,BeijingUniversityofChineseMedicine,Beijing100029,China
Objective To observe the effects of Huoxue Jiedu Recipe(HJR) on TGF-β2,Smad2,MMP-9,MMP-2,and collagen Ⅳ in diabetic rats with retina to explore possible mechanism of HJR in improving retinopathy of diabetic rats through TGF-β/Smads signal transduction pathways regulating matrix metabolism.Methods 12 SPF male SD rats were enrolled in this study.Eight rats,chosen randomly after 1 week of adaptive feeding,were given single intraperitoneal injection of streptozotocin(STZ)in a dose of 65 mg/kg,to induce diabetic models.The rest 4 rats,as control group,were given equal amount of sodium citrate.The 8 diabetic models were divided,according to latin square design,into groups model,HJR,4 in each.HJR group were given HJR,7.70 g/kg,1 time/d,groups control and model given equal volume of purified water,16 weeks.Real-time PCR method was used to determine the expressions of TGF-β2mRNA and Smad2 mRNA,the Western blotting used to detect the expressions of MMP-9,MMP-2 proteins,immunohistochemistry used to measure the expression of collagen Ⅳ.Results There was significant difference in the expressions of TGF-β2mRNA and Smad2 mRNA among 3 groups(F=6.232,P=0.034;F=9.518,P=0.014),thereinto higher in groups model and HJR than in control group,lower in HJR group than in model group(P<0.05).There was difference in MMP-9,MMP-2 expressions among 3 groups(F=17.387,P=0.001;F=8.593,P=0.008),thereinto higher in groups model and HJR than in control group(P<0.05),lower in HJR group than in model group(P<0.05).The expression of collagen Ⅳ was low,assuming hazel in control group;high,assuming dark brown in model group;lower in HJR group than in model,assuming pale brown.Conclusion HJR can intervene,by down-regulating the expressions of TGF-β2mRNA and Smad2 mRNA,TGF-β/Smads signal transduction pathways regulating matrix metabolism to down-regulate the expressions of MMP-9,MMP-2,collagen Ⅳ to improve diabetic retinopathy.
Diabetic retinopathy;Huoxue jiedu recipe;TGF-β/Smad signaling transduction pathway;Matrix metabolism
国家科技部“十二五”支撑计划项目(2012BAI29B07);北京中医药大学在读研究生项目(2014-JYBZZ-XS-024)
100029 北京市,北京中医药大学基础医学院(何洁,郝改梅,武志黔,薛晓兴,王伟),科研实验中心(韩静,吴晏);中国中医科学院中医基础理论研究所(李玉波)
R 587.26
A
10.3969/j.issn.1007-9572.2015.05.006
2014-10-20;
2014-12-10)
