松针纤维素降解菌系筛选及产酶条件研究
2015-02-20王宏燕赵承森
王宏燕,张 珏,赵承森
(东北农业大学资源与环境学院,哈尔滨 150030)
松针是松科松属植物针叶,主要来源于黑松、油松和马尾松等[1]。松针是一种可持续利用天然再生资源。通过合理利用废弃松针资源,以之用作土壤改良剂,能改善土壤退化,提高土壤生物多样性。纤维素是松针细胞重要组成成分之一。纤维素属于大分子聚合物,是分布最广的碳水化合物[2]。由于纤维素具有水不溶性的高结晶结构,外围被木质素包围,难以大量降解。因此,筛选高效纤维素降解菌尤为重要。关于纤维素降解菌筛选研究很多,有关纤维素酶产生菌报道中对纤维素分解活力较强的菌株为真菌属菌株,国内对产纤维素酶能力较强的单一菌种研究较多,菌种混合发酵研究较少[3-6]。
本研究从大兴安岭松林区松针腐殖土中筛选得到3株高纤维素酶活的纤维素降解菌,并对其进行组合培养,得到优势组合,对该组合产酶条件进行研究,可为合理利用废弃松针资源提供理论依据。
1 材料与方法
1.1 材料
1.1.1 菌株来源
大兴安岭松林区松针腐殖土土样,4℃保存。
1.1.2 松针来源
大兴安岭松林区松树针叶,将新鲜无霉变松针洗净烘干,粉碎,过20目筛,备用。
1.1.3 培养基
羧甲基纤维素钠培养基:KH2PO40.5 g,CaCl20.07 g,(NH4)2SO40.4 g,CuSO40.005 g,MgSO4·7H2O 0.07 g,Na2HPO40.5 g,ZnCl20.001 g,CMC-Na 15.0 g,蒸馏水1 000 mL,121℃灭菌20 min。
马铃薯葡萄糖培养基:马铃薯葡萄糖水26.0 g,蒸馏水1 000 mL,121℃灭菌20 min。
产酶培养基:(NH4)2SO41.4 g,KH2PO42 g,尿素0.3 g,MgSO4· 7H2O 0.3 g,CaCl20.3 g,FeSO4·7H2O 0.0075 g,MnSO4· 7H2O 0.0025 g,ZnSO4·7H2O 0.002 g,CuSO4· 8H2O 0.003 g,蒸馏水1 000 mL,121℃灭菌20 min。
1.2 方法
1.2.1 菌株富集和纯化
将从菌源地采样得来的土壤样品取5.0 g加入盛有100 mL无机盐培养基的250 mL三角瓶中,激活菌源土中的菌种,将三角瓶置于28℃、140 r·min-1摇床上振荡培养,重复传接Ⅴ代。将第Ⅴ代菌液按照一系列不同浓度稀释,将10-4、10-5、10-63种浓度菌液在无机盐琼脂培养基平板上涂布,每个稀释度涂3大板块,恒温培养,反复划线涂布至长出单菌落,镜检确定为纯净单菌体后,接种在保藏培养基上进行保存。
1.2.2 松针纤维素降解菌筛选
初筛采用刚果红纤维素琼脂培养基鉴别法,经比较选取D/d较大的菌落进行复筛。复筛采用酶活测定方法,分别测量CMC、滤纸、微晶纤维素3种酶活[7],连续测量8 d。根据酶活力大小,得到优势菌株。
粗酶液制备:接种3.75 mL种子培养基中的菌液至装有75 mL液体发酵培养基的150 mL三角瓶中,置于28℃、140 r·min-1摇床培养,收取菌液至离心管中,4℃、6 000 r·min-1离心10 min,取上清液即为粗酶液。
酶活定义:在pH 5.0,50℃条件下,1 mL粗酶液在1 min内水解它的作用底物生成1 μg葡萄糖的酶活性,称为1个纤维素酶活力单位(IU)。
1.2.3 组合菌群产酶条件研究
将复筛获得的松针降解菌进行组合培养,按体积比1∶1接种,通过测定CMC、滤纸和微晶纤维素3种酶活性,将其与单菌株3种酶活性进行比较,筛选出最佳组合,进行产酶条件研究。
以松针为唯一碳源,选择豆饼粉、玉米面、尿素、(NH4)2SO4、NH4NO3、NH4Cl、NaNO3、KNO38种不同氮源进行氮源对产酶影响的试验。每组3个重复。得到最佳氮源。
以松针为碳源,硝酸钠为氮源,分别研究在以3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0作为起始培养pH时的产酶情况。每组3个重复。得到最佳起始pH。
当以松针为碳源,硝酸钠为氮源,培养基起始pH 6.0时,在酶反应体系中加入聚乙二醇400、吐温20、吐温60和吐温80等表面活性剂,进行表面活性剂对产酶影响的试验。每组3个重复。得到最优表面活性剂。
2 结果与分析
2.1 松针降解菌的初筛
在刚果红纤维素培养基上经刚果红染色后,共有23株菌株有水解圈,以培养3 d后透明圈直径与菌落直径之比大于2为筛选原则,初步筛选得到9株松针降解菌,结果见表1。
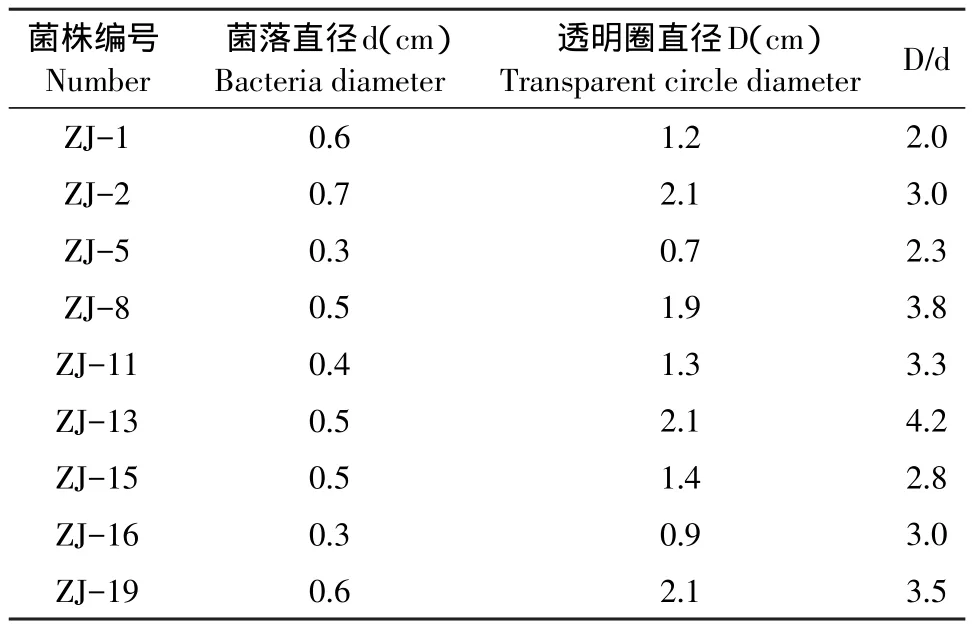
表1 松针降解菌初筛结果Table 1 Pine needles degrading bacteria screening results
2.2 松针降解菌的复筛
将初筛获得的9株菌分别进行CMC、滤纸和微晶纤维素酶活力测定,结果见图1~3。
由图1可知,从第1~8天,9株菌纤维素酶活力均有两个峰值,其中ZJ-5峰值出现在第3和6天,ZJ-15峰值出现在第4和7天,其余7株菌的峰值均出现在第4和6天。ZJ-13和ZJ-8的CMC活性较高,达到40 IU以上水平,分别是47.68和44.39 IU。
由图2可知,从第1~7天,9株菌的滤纸酶活力均有2个峰值,其中ZJ-1的峰值出现在第2天和第4天,ZJ-2、ZJ-5、ZJ-8、ZJ-15和ZJ-19峰值出现在第3和5天,ZJ-11、ZJ-13和ZJ-16峰值出现在第2和5天。ZJ-8和ZJ-13滤纸酶活性较高,达到30 IU以上水平,分别是31.15和30.05 IU。
由图3可知,从第1~7天,9株菌的微晶纤维素酶活力均有两个峰值,其中ZJ-13峰值出现在第2和5天,ZJ-2、ZJ-5、ZJ-8和ZJ-15峰值出现在第3天和第5天,ZJ-1、ZJ-11、ZJ-16和ZJ-19峰值出现在第3天和第6天。ZJ-13、ZJ-19和ZJ-8微晶纤维素酶活性较高,达到70 IU以上水平,分别是92.93、75.28和73.25 IU。
从各菌株3种纤维素酶活比较结果来看,确定ZJ-8、ZJ-13和ZJ-19为松针纤维素降解高效菌株。
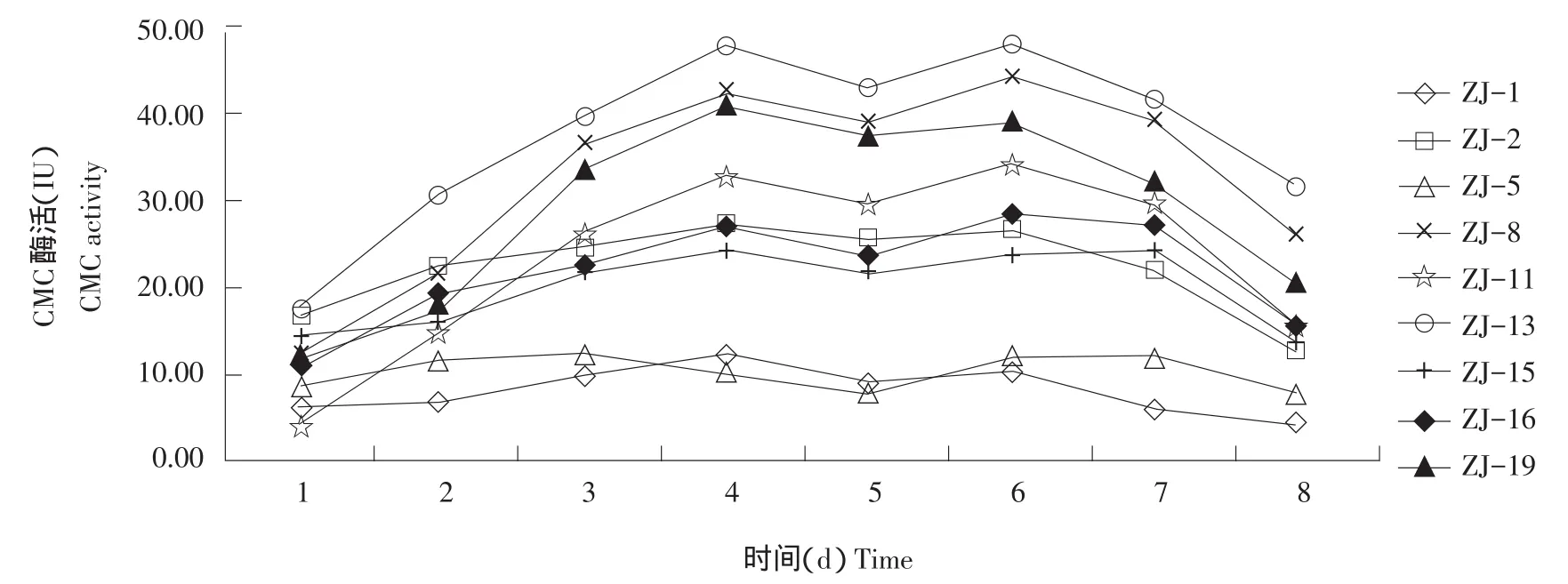
图1 松针降解菌CMC酶活Fig.1 CMC activity of pine needles degrading bacteria
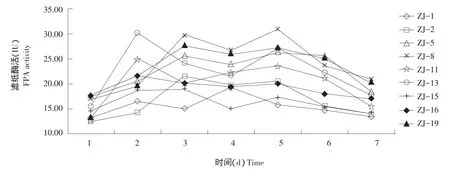
图2 松针降解菌滤纸酶活力Fig.2 FPA activity of pine needles degrading bacteria
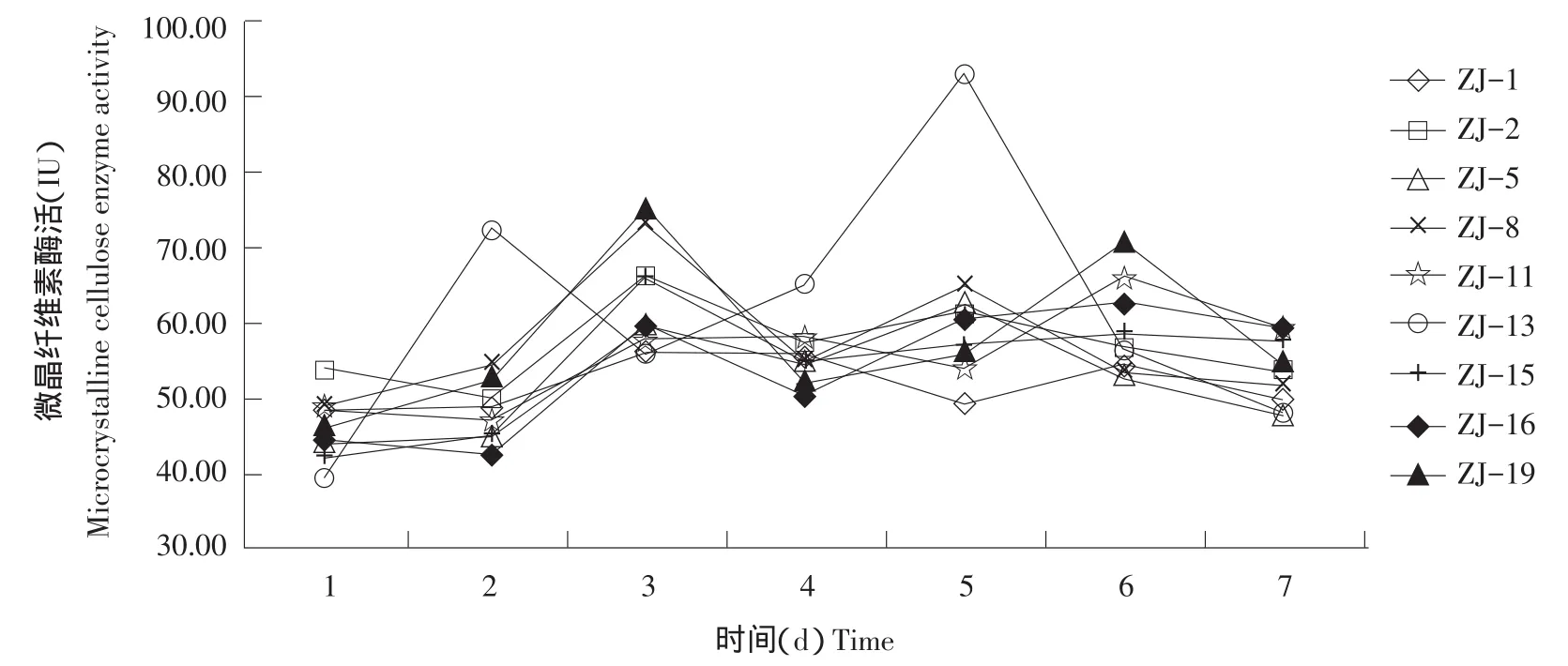
图3 松针降解菌微晶纤维素酶活Fig.3 Microcrystalline cellulose enzyme activity of pine needles degrading bacteria
2.3 菌株组合培养与单独培养的酶活性比较
由图4~6可知,多数组合培养的菌群酶活力均高于单独培养菌株酶活力,可能是不同菌株间产生协同效应,提高菌株发酵产酶能力。不是所有组合菌群产酶能力均有提高,组合ZJ-13/ZJ-19的FPA和微晶纤维素酶活力较单独培养的菌株ZJ-13和ZJ-19有所下降,可能是菌株间产生拮抗作用,互相影响产酶能力。
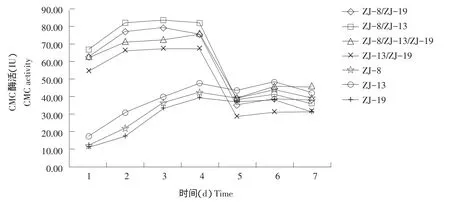
图4 菌株单独培养和组合培养的CMC酶活Fig.4 Strains cultured alone and mixed cultured of CMC activity
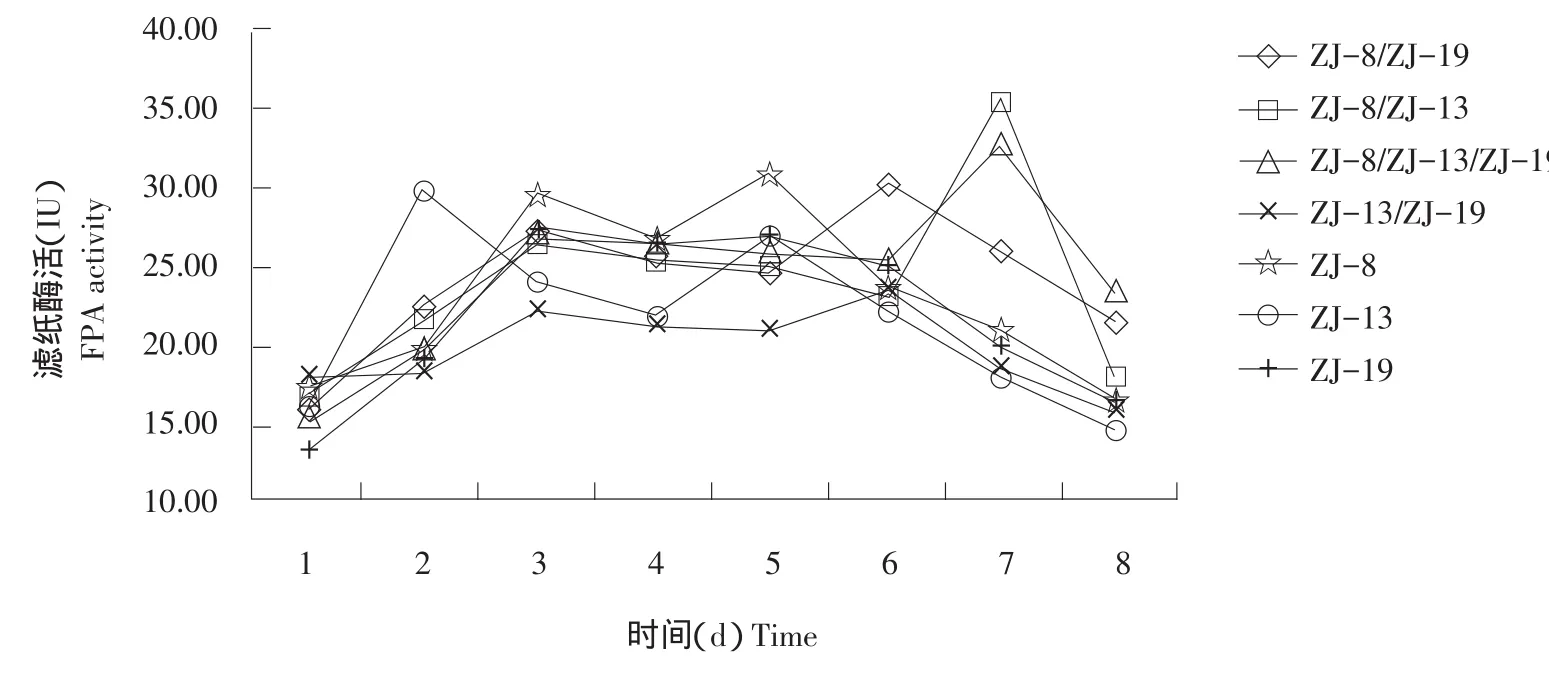
图5 菌株的单独培养与组合培养的滤纸酶活力Fig.5 Strains cultured alone and mixed cultured of FPA activity
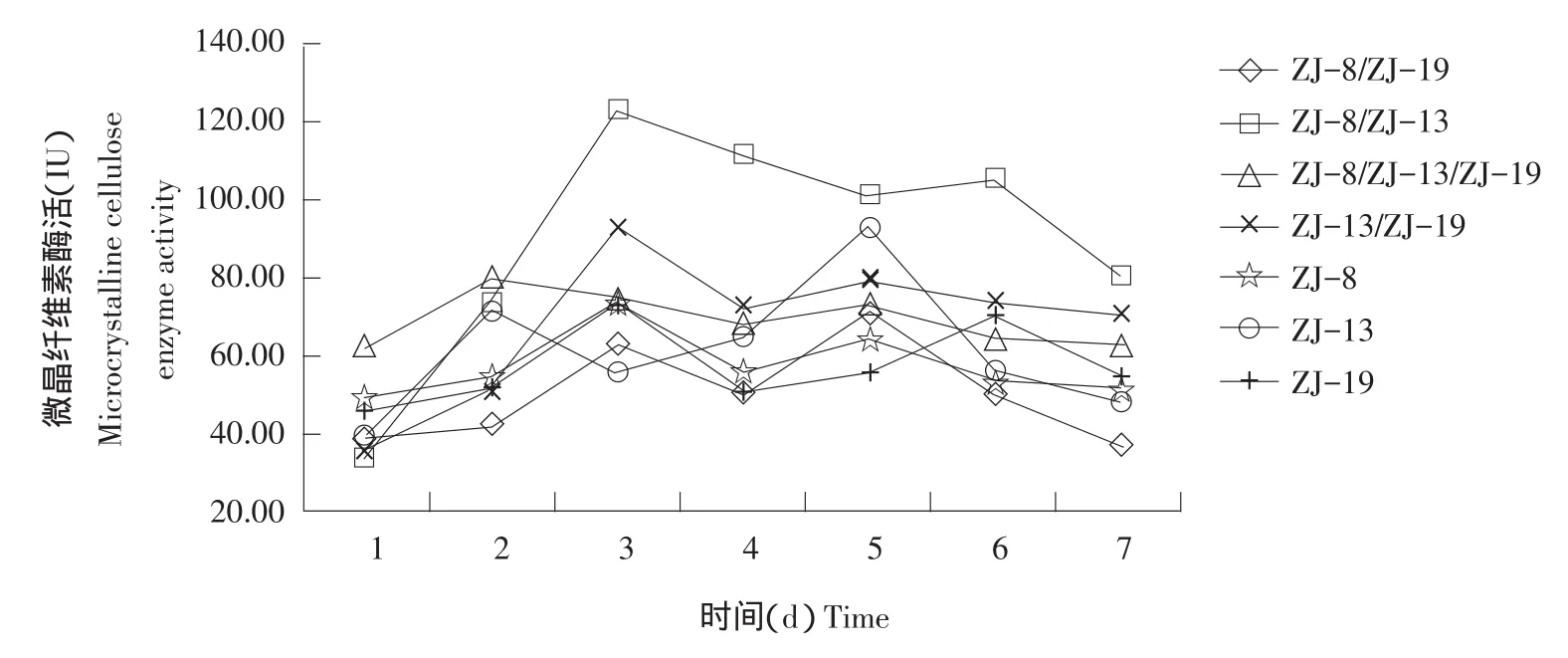
图6 菌株单独培养与组合培养的微晶纤维素酶活力Fig.6 Strains cultured alone and mixed cultured of microcrystalline cellulose enzyme activity
菌株组合ZJ-8/ZJ-13的CMC、滤纸和微晶纤维素酶活较单独培养的菌株提高最明显,其CMC酶活力较ZJ-8和ZJ-13单独培养时分别提高87.85%和74.90%,FPA酶活力较ZJ-8和ZJ-13单独培养时分别提高15.10%和19.26%,微晶纤维素酶活力较ZJ-8和ZJ-13单独培养时分别提高67.30%和31.86%。可确定组合ZJ-8/ZJ-13为最优组合。
2.4 组合菌群产酶条件的研究
2.4.1 不同氮源对产酶的影响
以松针为唯一碳源,分别以豆饼粉、玉米面、尿素、(NH4)2SO4、NH4NO3、NH4Cl、NaNO3、KNO3作为氮源进行液态发酵,测定CMC、FPA和微晶纤维素3种酶活力。结果见图7。
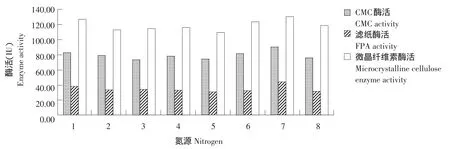
图7 不同氮源对产酶的影响Fig.7 Effect of different nitrogen sources on enzyme production
由图7可知,组合菌群在以硝酸钠为氮源的培养基中,3种酶活均达到最高,分别为90.27、43.92和131.61 IU。因此,最佳氮源为硝酸钠。
2.4.2 不同起始pH对产酶的影响
以松针为碳源,硝酸钠为氮源,用pH分别为 3.0、4.0、5.0、6.0、7.0、8.0、9.0和10.0的缓冲溶液配置液体培养基进行培养,测定CMC、FPA和微晶纤维素酶活力。结果见图8。
由图8可知,组合菌群在起始pH 3.0~10.0均有酶活力,pH 6.0时,3种酶活均达到最高,分别为94.90、46.70和136.56 IU。因此,培养基最适起始pH 6.0。
2.4.3 培养基中添加不同表面活性剂对产酶的影响
当以松针为碳源,硝酸钠为氮源,培养基起始pH 6.0时,在酶反应体系中加入聚乙二醇400、吐温20、吐温60和吐温80等表面活性剂进行培养,测定CMC、FPA和微晶纤维素酶活力。结果见图9。
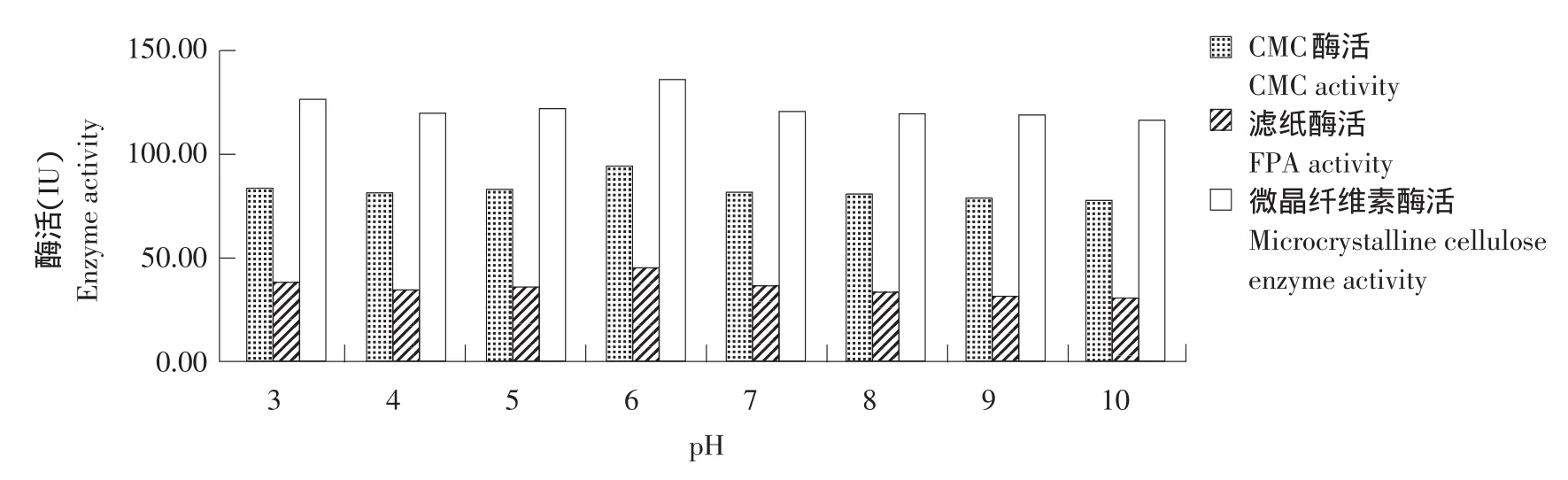
图8 不同起始pH对产酶的影响Fig.8 Effect of different initial pH on enzyme production
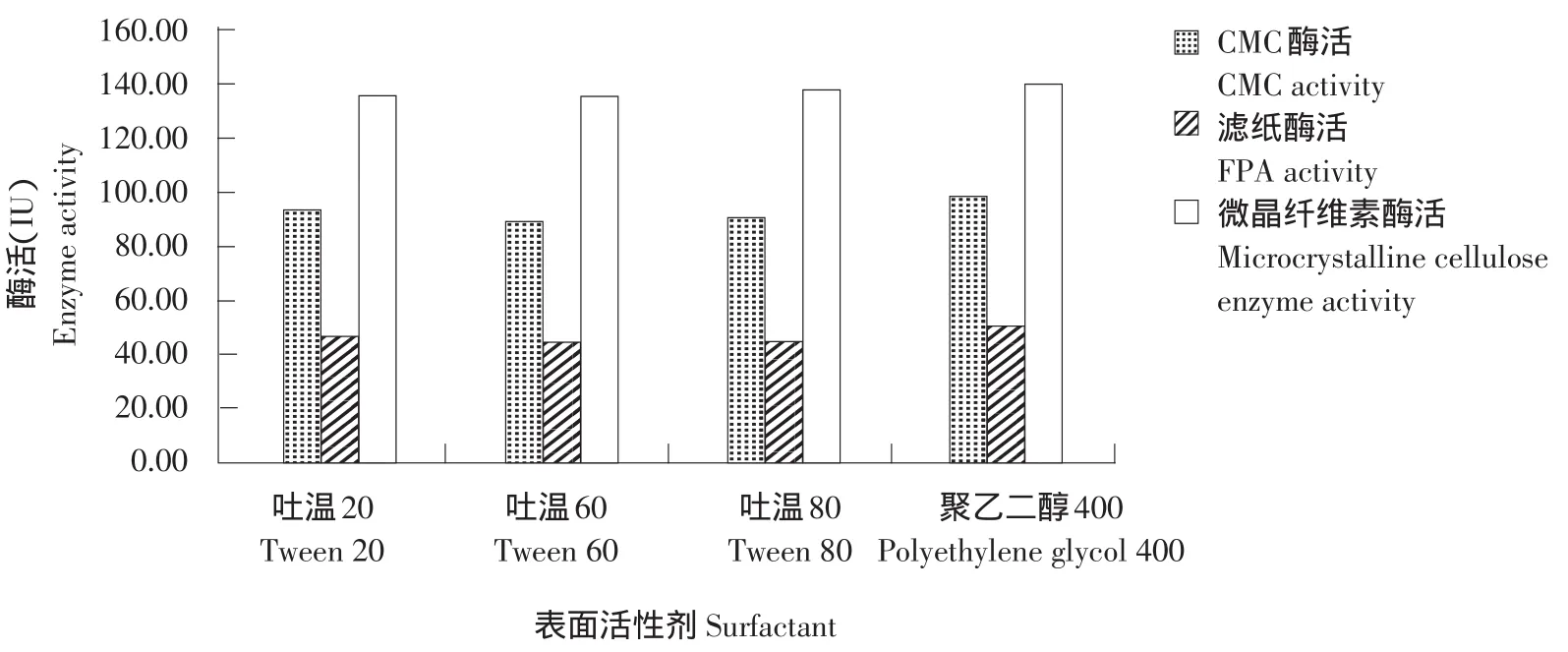
图9 添加不同表面活性剂对产酶的影响Fig.9 Effect of different surfactants on enzyme production
由图9可知,组合菌群在4种表面活性剂作用下酶活力均有所提高,在加入聚乙二醇400时酶活最佳,3种酶活均达到最高,分别为98.03、50.84和140.06 IU,因此培养基中添加最佳表面活性剂为聚乙二醇400。
3 讨 论
松针富含叶绿素、胡萝卜素、维生素、蛋白质、氨基酸等多种成分,具有生理活性作用和营养保健作用[8-9]。在初筛、复筛松针纤维素高效降解菌株过程中发现,每个菌株产酶高峰时间不同,但均有两个峰值,每个菌株在达到第2个峰值后,酶活力均缓慢下降。
崔宗均等未使用传统微生物纯培养分离方法,筛选得到高效而稳定的纤维素分解混合菌群,该混合菌群在高温环境中表现出较强的分解能力[10]。文少白等以香蕉杆为唯一碳源培养无花果曲霉和康宁木霉,结果发现内切酶(CMC)和纤维素全酶(FPA)活性分别比2种菌单独培养时提高[11]。因此,在筛选得到3株高效降解菌株后,组合培养研究。通过对松针降解过程中单菌株和组合菌群的CMC、FPA和微晶纤维素3种酶活性测定可见,多数组合产酶能力提高,可能是菌株间互补作用使产酶能力提高,但得到最优组合为ZJ-8/ZJ-13,而非ZJ-8/ZJ-13/ZJ-19。可见,并非所有高效菌株混合的产酶效果最好,尤其是组合ZJ-13/ZJ-19的酶活力与单菌株相比下降,这可能是菌株间拮抗作用导致。所以在研究组合菌群时,要注意菌株间是否存在拮抗作用。
对该组合产酶条件的研究发现,该组合分泌的纤维素酶在pH 3.0~10.0均有活力,说明此组合分泌的纤维素酶pH范围广泛,在偏酸性条件下比在碱性条件下活力高。研究在培养基中加入表面活性剂对产酶影响,表面活性剂应用在纺织工业中对酶的活性产生影响[12],试验中作为无机非离子型表面活性剂聚乙二醇400对组合菌群有较好促进酶生产效果。由于滤纸结构中包括结晶型纤维素和非结晶型纤维素,所以通常采用FPA衡量纤维素菌酶系的综合降解能力。此外,在有表面活性剂存在条件下,表现出较好适应性。表面活性剂虽可提高纤维素分子溶解度,使酶和纤维素分子更有效接触,但可能通过改变离子强度、螯合金属离子等方式影响酶活性部位微环境或者可能因表面活性剂改变细胞膜通透性,造成菌体内外环境失衡,影响其菌体生长和产酶。
4 结论
本试验研究表明,单独培养菌株获得的纤维素分解菌在功能发挥上受很大限制,将筛选出的3株高效松针纤维素降解菌ZJ-8、ZJ-13和ZJ-19分别进行单独培养和混合发酵培养,经产酶酶活性测定,多数组合酶活力均高于单独培养菌株的酶活力,可能是不同菌株间产生协同效应,提高菌株发酵产酶能力。但并非所有组合菌群产酶能力均有提高,组合ZJ-13/ZJ-19的FPA和微晶纤维素酶活力较单独培养的菌株ZJ-13和ZJ-19下降,这可能是菌株之间产生拮抗作用,互相影响产酶能力。其中,酶活力最高的组合为ZJ-8/ZJ-13,通过对组合ZJ-8/ZJ-13液态发酵条件研究发现,氮源为硝酸钠和豆饼粉时3种酶活力大小相差不明显,但是考虑到豆饼粉价格高于硝酸钠,粉碎过程较复杂,确定硝酸钠为最佳氮源进行后续试验,此组合分泌的纤维素酶pH范围广泛。经形态学观察初步鉴定3株菌均为真菌,这也是组合菌群在偏酸性条件下比碱性条件下酶活力高的原因之一。试验中作为无机非离子型表面活性剂的聚乙二醇400对组合菌群促进酶生产具有良好效果。
[1]刘晓庚,陈梅梅.我国松针的开发利用研究及进展[J].粮食与食品工业,2003(3):26-29.
[2]AdsulM G,Bastawde K B,Varma A J,et al.Strain improvement ofPenicillium janthinellumNCIM1171 for increased cellulase production[J].BioresourceTechnology,2007,98(7):1467-1473.
[3]汪维云,朱金华,吴守一.纤维素科学及酶的研究进展[J].江苏理工大学学报,1998,19(3):20-28.
[4]史玉英,沈其荣,娄无忌.纤维素分解菌的分离和筛选[J].南京农业大学学报,1996,19(3):59-62.
[5]Hart T D,De L F,Kinsey G,et al.Strategies for the isolation of celluolytic fungi for composting of wheat straw[J].World Journal of Microbiology&Biotechnology,2002,18:471-480.
[6]洪洞,黄秀莉.纤维素酶的应用[J].生物学通报,1997,32(12):18-19.
[7]刘洁,李宪臻,高培基.纤维素酶测定方法评述[J].工业微生物,1994,24(4):27-32.
[8]田建华.松针的组成成分及其主要生理功能[J].山西林业科技,2006,6(2):5-7.
[9]谢济运.松针有效成分的提取与分析研究进展[J].安徽农业科学,2011,39(22):13498-13512.
[10]崔宗均,李美丹,朴哲.一组高效稳定纤维素分解菌复合系MC1的筛选及功能[J].环境科学,2002,23(3):36-39.
[11]文少白,张桂花,李勤奋.五种菌对香蕉茎秆纤维素降解能力比较及菌群构建[J].环境科学与技术,2011,34(3):46-49.
[12]张增强,朱江波.表面活性剂对牛仔布生化酶洗效果的影响[J].纺织科技进展,2007(4):40-41.
