筛选自人卵巢癌细胞系HO8910的干细胞生物学特性分析
2015-02-19方丽莎许君仇影影闫洪超林小满黄红香韩秋峪徐州医学院江苏徐州006徐州医学院附属医院
方丽莎,许君,仇影影,闫洪超,林小满,黄红香,韩秋峪(徐州医学院,江苏徐州006;徐州医学院附属医院)
筛选自人卵巢癌细胞系HO8910的干细胞生物学特性分析
方丽莎1,许君1,仇影影1,闫洪超2,林小满2,黄红香2,韩秋峪2
(1徐州医学院,江苏徐州221006;2徐州医学院附属医院)
摘要:目的探讨筛选自人卵巢癌细胞系HO8910干细胞的生物学特性。方法将前期筛选卵巢癌细胞系HO8910的干细胞在无血清培养基中进行传代培养,以HO8910细胞作为对照。体外观察两种细胞的球体形成能力;将两种细胞接种于含血清培养基,观察其分化能力,并检测干细胞相关标记物;采用药敏试验检测两种细胞对顺铂、多柔比星及米托蒽醌的敏感性;将无血清培养基中进行传代培养的两种细胞接种于NOD/SCID裸鼠,观察其体内成瘤情况。结果HO8910细胞在无血清培养基中的球体形成能力明显低于卵巢癌细胞(P<0.05)。卵巢癌干细胞分化前CD133、CD117阳性表达率明显高于分化后(P均<0.05)。卵巢癌干细胞分化后ABCG2、Nanog、Oct4、BCRP、E-cadherin表达均低于分化前(P均<0.05),与HO8910细胞分化前后上述指标比较差异均无统计学意义(P均>0.05)。0.25、0.5 μg/mL顺铂,0.5、1.5 μmol/L多柔比星,0.05、0.25 μg/mL米托蒽醌作用于卵巢癌干细胞、HO8910细胞48 h时,卵巢癌干细胞的相对活性均高于HO8910细胞(P均<0.05)。裸鼠接种1×103个卵巢癌干细胞即可成瘤;随着干细胞接种数量的增加,成瘤比率逐渐增加,成瘤时间逐渐缩短(P均<0.05)。结论筛选自人卵巢癌细胞系HO8910的卵巢癌干细胞具有自我更新和分化、体内成瘤、高表达干细胞基因以及对化疗耐药等特性,符合肿瘤干细胞的理论标准。
关键词:卵巢肿瘤;卵巢癌;肿瘤干细胞; HO8910细胞系; NOD/SCID裸鼠
Identification of biological characteristics of human ovarian cancer cell line HO8910-derived stem cells
FANG Li-sha1,XU Jun,QIU Ying-ying,YAN Hong-chao,LIN Xiao-man,
HUANG Hong-xiang,HAN Qiu-yu
(1 Xuzhoumedical College,Xuzhou 221002,China)
Abstract:ObjectiveTo identify the biological characteristics of human ovarian cancer cell line HO8910-derived stem cells.Methods The pre-screening of ovarian cancer cell line HO8910-derived stem cells were subcultured(HO8910 cells were used as the control group)in serum-freemedium.The capacities of forming spheroids and self-renew were observed.Then ovarian cancer stem cells(CSCs)were seeded inmedium containing serum and cultured to observe thedifferentiation capacity,and the stem cell-specificmarkers were also tested.We tested the sensitivity of stem cells to cisplatin,doxorubicin andmitoxantrone by usingdrug susceptibility test.Finally,we inoculated the ovarian CSCs after passaging from culturing in serum-freemedia to NOD/SCID(non-obesediabetic/severe combined immunodeficientmice)mice in order to observe the tumorigenicity in vivo.Results The forming spheroid capacity of HO8910 cells in the serum-freemedium was significantly lower than that of the ovarian cancer cells(P<0.05).The positive expression rates of CD133 and CD117 in the ovarian CSCs beforedifferentiation were higher than those afterdifferentiation(all P<0.05).The expression of ABCG2,Nanog,Oct4,BCRP and E-cadherin in the ovarian CSCs afterdifferentiation was lower than that beforedifferentiation(all P<0.05).No statistical significance was found in the above indexes before and after HO8910 cellsdifferentiation(all P>0.05).The relative activities in the ovarian CSCs were higher than in HO8910 cells when they were respectively treated with 0.25 and 0.5 μg/mL cisplatin,0.5 and 1.5 μmol/Ldoxorubicin and 0.05 and 0.25 μg/mLmitoxantrone for 48 h(all P<0.05).The tumor formed when the nudemouse was inoculated with 1×103ovarian CSCs.With the increase of inoculated stem cells,the tumor formation ratio was gradually increased(all P<0.05),and the time was gradually
shortened(all P<0.05).Conclusion The ovarian CSCsderived from human ovarian cancer cell line HO8910 have the abilities of self-renew,differentiation,in vivo tumorigenicity,highly expressed stem cell genes andmultidrug resistance,whichmeet the standard of tumor stem cell theory.
Key words:ovarian neoplasms; ovarian carcinoma; tumor stem cells; HO8910 cell line; NOD/SCID nudemouse
肿瘤干细胞是一类具有自我更新能力的细胞,能够进行无限增殖和多向分化,被认为是肿瘤发生、侵袭、转移、耐药以及复发的根源[1,2]。近年来,随着肿瘤干细胞的研究进展,人们开始从新的角度重新认识卵巢癌的生物学行为。本课题组前期以人卵巢低分化浆液性囊腺癌细胞株HO8910为研究对象,采用紫杉醇结合无血清培养基悬浮培养,并通过体外及体内实验成功筛选出具有CD+133、CD+117特征的人卵巢癌干细胞[3]。本研究探讨筛选自人卵巢癌细胞系HO8910的干细胞的生物学特性。
1 材料与方法
1.1材料细胞:人卵巢低分化浆液性囊腺癌细胞株HO8910及其来源的具有CD+133、CD+117特征的人卵巢癌干细胞,由徐州医学院附属医院妇产科实验室提供。动物: NOD/SCID雌性裸小鼠,鼠龄4~6周,购自中国科学院上海实验动物中心。主要试剂: RPMI 1640培养基(美国Hyclone公司),胎牛血清(杭州四季青生物工程材料有限公司),含有表皮生长因子、碱性成纤维生长因子、Noggi及白细胞抑制因子的无血清培养基(美国Sigma公司),CD133、CD117、ABCG2、Nanog、Oct4、BCRP及E-cadherin一抗(美国Chemicon公司),顺铂、多柔比星及米托蒽醌(上海信裕生物科技有限公司)。
1.2细胞培养人卵巢癌干细胞采用含有EGF、bFGF、Noggi及LIF的无血清培养基,于37℃、5% CO2、饱和湿度的恒温密闭培养箱内传代培养。HO8910细胞采用常规RPMI 1640培养基加10%胎牛血清,于37℃、5% CO2、饱和湿度的恒温密闭培养箱内传代培养。
1.3卵巢癌干细胞体外连续球体形成能力检测取前期冻存保留的干细胞球体,体外复苏。PBS洗涤两遍后,0.25%胰酶消化并制成单细胞悬液,洗去胰酶后重悬于无血清培基中培养,观察球体形成的时间和大小。待球体形成后,将球体再次消化并吹打成单细胞悬液,在相同条件下重新予以悬浮培养,观察再次形成球体的时间和大小。连续传代4次,进行后续实验。
1.4卵巢癌干细胞的自我更新能力检测采用0.25%胰酶分别消化干细胞球体和HO8910细胞成单个细胞悬液,台盼蓝染色进行活细胞记数后,采用无血清培养基分别稀释细胞悬液至密度为1×103个/mL。混匀后,用移液枪将两种细胞悬液分别转移到96孔板,每组各20孔,每孔100 μL(平均每孔含100个细胞)。每孔分别再添加100 μL无血清培养基,静置培养,以后每天添加25 μL培养基,7d后计数每孔形成球体数。
1.5卵巢癌干细胞的分化能力检测取传代培养的干细胞球体或常规培养的HO8910细胞,0.25%胰酶消化并反复吸打成细胞悬液,直接接种到含10%胎牛血清的RPMI 1640培养基中,使其贴壁生长并分化,显微镜下观察其分化情况。流式细胞仪检测分化前后CD133、CD117表达,Western blotting法检测分化前后ABCG2、Nanog、Oct4、BCRP及E-cadherin表达情况。
1.6卵巢癌干细胞对化疗药物的敏感性检测取传代培养的干细胞球体(实验组)或常规培养的HO8910细胞(对照组),0.25%胰酶消化并反复吸打成细胞悬液,台盼蓝染色进行活细胞计数后,将干细胞接种于含有无血清培养基的96孔板中(6 000 个/孔),分别加入顺铂、多柔比星和米托蒽醌。每种药物取其半数抑制浓度(IC50)附近2个梯度的浓度,顺铂0.25、0.5 μg/mL,多柔比星0.5、1.5 μmol/ L,米托蒽醌0.05、0.25 μg/mL,每个药物浓度设5个复孔。继续培养48 h后将培养基吸去,加入10% CCK-8,并设立调零孔(只加入CCK-8试剂、不含细胞)。置于培养箱中孵育2 h后,用紫外分光光度仪测定450 nm处的光密度(OD)值。细胞相对活性=(OD实验组-OD调零孔)/(OD对照组-OD调零孔)。细胞相对活性越低说明药物敏感性越高。
1.7卵巢癌干细胞在裸鼠体内的成瘤能力检测取传代培养的干细胞球体,0.25%胰酶消化并反复吸打成细胞悬液,台盼蓝染色进行活细胞计数。按2×105、2×104、2×103、1×103个/mL的密度梯度分别接种于5只NOD/SCID雌性裸鼠。每只裸鼠右腋窝皮下接种卵巢癌干细胞,左腋窝皮下接种相同数量的常规培养的HO8910细胞。每周2次观察肿瘤生长情况。成瘤能力用成瘤比率(成瘤的裸鼠数/接种的裸鼠数)和成瘤时间(从细胞接种到有可触及的瘤体形成的时间)表示。当瘤体积达到1 cm3左右或接种后4个月仍未成瘤,将裸鼠处死,手术摘
取成瘤裸鼠皮下的瘤组织。用PBS将瘤组织表面的血液冲洗干净,用灭菌后的眼科剪将组织块尽量剪碎,使碎片直径不超过1mm。将剪碎的组织倒入50mL离心管中,用30mL PBS重悬,1 200 r/min离心5min,去除上清液;用配制好的含有胶原酶Ⅳ(终浓度为1mg/mL)、0.04%dNA酶I的培养基重悬沉淀物,置于37℃恒温水浴摇床中消化2 h。再将消化好的细胞悬液经100 μm滤网过滤,离心,PBS洗涤1次。接种至无血清培养基中培养,待形成球体后,按照上述方法及浓度再次接种于NOD/ SCID雌性裸鼠体内,以常规培养的HO8910细胞作为对照,观察其连续成瘤能力。
1.8统计学方法采用SPSS13.0统计软件。计量资料以珋x±s或中位数表示,组间比较采用t检验或方差分析;计数资料比较采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1卵巢癌干细胞体外连续球体形成能力观察复苏后第1次传代的卵巢癌干细胞在无血清培养基培养条件下从第4天开始形成细胞球体,第9天达到平台期。经过连续传代后依然能够形成球体,培养到第4代时,卵巢癌干细胞从第2天开始形成细胞球体,第5天达到平台期,且直径较第1代明显增大。见插页Ⅰ图1。
2.2卵巢癌干细胞的自我更新能力100个HO8910细胞在无血清培养基中可形成(5.36± 1.28)个细胞球体,100个卵巢癌干细胞形成的细胞球体数为(39.61±3.52)个,两者比较P<0.05。
2.3卵巢癌干细胞的分化能力将吹打成细胞悬液的卵巢癌干细胞转移到含血清培基中,4 h后部分细胞开始贴壁分化,但仍有部分细胞维持球体状态,贴壁细胞的形态与HO8910细胞相似; 24 h后可见几乎所有的细胞均贴壁生长;见插页Ⅰ图2。卵巢癌干细胞分化前CD133、CD117阳性表达率分别为87.1%、79.3%,分化后分别为19.6%、21.4%,分化前后比较,P均<0.05; HO8910细胞分化后CD133、CD117阳性表达率分别为16.9%、19.1%,与卵巢癌干细胞分化后比较,P均>0.05。卵巢癌干细胞分化后ABCG2、Nanog、Oct4、BCRP、E-cadherin表达均低于分化前(P均<0.05),与HO8910细胞分化后比较差异均无统计学意义(P均>0.05);见表1。
表1 卵巢癌干细胞、HO8910细胞分化前后干细胞标志物表达比较(OD值,)

表1 卵巢癌干细胞、HO8910细胞分化前后干细胞标志物表达比较(OD值,)
注:与同组分化前比较,*P<0.05。
细胞ABCG2 Nanog Oct4 BCRP E-cadherin卵巢癌干细胞分化前 0.77±0.32 0.82±0.04 0.81±0.36 0.87±0.18 0.37±0.17分化后 0.31±0.71* 0.27±0.21* 0.25±0.33* 0.39±0.92* 0.69±0.12*HO8910细胞分化前 - - - - -分化后 0.28±0.01 0.23±0.11 0.21±0.79 0.42±0.69 0.73±0.02
2.4卵巢癌干细胞对化疗药物的敏感性0.25、0.5 μg/mL顺铂,0.5、1.5 μmol/L多柔比星,0.05、0.25 μg/mL米托蒽醌作用卵巢癌干细胞、HO8910细胞48 h时,卵巢癌干细胞的相对活性均高于HO8910细胞(P均<0.05)。见表2。
表2 顺铂、多柔比星、米托蒽醌作用下卵巢癌干细胞、HO8910细胞相对活性比较()
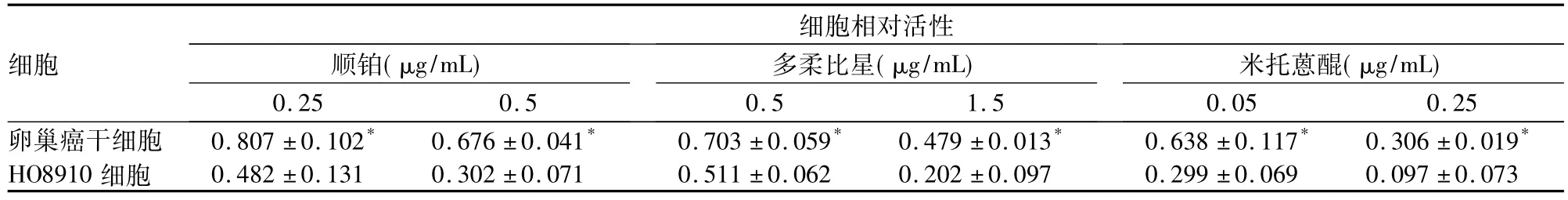
表2 顺铂、多柔比星、米托蒽醌作用下卵巢癌干细胞、HO8910细胞相对活性比较()
注:与HO8910细胞比较,*P<0.05。
细胞细胞相对活性顺铂(μg/mL)0.25 0.5多柔比星(μg/mL)0.5 1.5米托蒽醌(μg/mL)0.05 0.25卵巢癌干细胞 0.807±0.102* 0.676±0.041* 0.703±0.059* 0.479±0.013* 0.638±0.117* 0.306±0.019*HO8910细胞 0.482±0.131 0.302±0.071 0.511±0.062 0.202±0.097 0.299±0.069 0.097±0.073
2.5卵巢癌干细胞在裸鼠体内的成瘤能力裸鼠接种1×103个卵巢癌干细胞即可成瘤,成瘤比率为2/5,成瘤时间为47~53d;随着干细胞接种数量的增加,成瘤比率逐渐增加(P均<0.05),成瘤时间逐渐缩短(P均<0.05)。裸鼠接种至少2×104个HO8910细胞才能成瘤。接种2×104个卵巢癌干细胞的成瘤比率比明显高于接种2×104个HO8910细胞的成瘤比率(P<0.05),且成瘤时间缩短(P<0.05)。将接种卵巢癌干细胞成瘤的瘤组织制成细胞悬液,重悬于无血清培养基中培养,培养7d形成细胞球体,将球体消化制成单细胞悬液后,再次接种于裸鼠体内。结果显示,裸鼠接种1×103个卵巢癌干细胞即可成瘤,成瘤比率为1/5,成瘤时间为51d;随着干细胞接种数量的增加,成瘤比率逐渐增加(P均<0.05),成瘤时间逐渐缩短(P均<0.05)。裸鼠至少接种2×104个HO8910细胞才能成瘤。裸鼠接种2×104个卵巢癌干细胞的成瘤比率高于
接种2×104个HO8910细胞的成瘤比率(P<0.05),且成瘤时间缩短(P<0.05)。见表3。

表3 接种不同数量卵巢癌干细胞、HO8910细胞的成瘤比率及时间比较
3 讨论
目前的研究表明,肿瘤干细胞具有自我更新能力、分化潜能、表达干细胞标志基因、对化疗药物抵抗、免疫缺陷鼠体内成瘤等生物学特性[4~10]。本研究对前期筛选出来的卵巢癌干细胞的生物学特性进行检测,结果表明,卵巢癌干细胞与普通HO8910细胞比较,具有更强的球体形成能力,且在体外能够连续形成细胞球体,提示卵巢癌干细胞在体外具有很强的自我更新能力。在含血清培养基中培养的卵巢癌干细胞能够分化成为与HO8910细胞相似的细胞,分化后的干细胞标记物CD133、CD117、ABCG2、Nanog、Oct4及BCRP表达均低于分化前,分化潜能标志物E-cadherin表达高于分化前,且分化后各标记物表达与HO8910细胞差异均无统计学意义,提示卵巢癌干细胞具有较强的分化潜能,符合卵巢癌起源于卵巢干细胞的观点。
肿瘤干细胞区别于成熟、分化细胞的特性之一就是对化疗药物抵抗[11]。本研究选用治疗卵巢癌的一线化疗药物顺铂,以及在其他类型肿瘤干细胞研究中使用最多的药物多柔比星和米托蒽醌,以对比研究卵巢癌干细胞和HO8910细胞药物敏感性的差异。结果显示,卵巢癌干细胞具有明显的多药耐药特性,与其他类型肿瘤研究结果相符[12,13]。因此推测,在临床治疗中,化疗药物虽然杀死了卵巢癌患者体内绝大多数的肿瘤细胞,但仍有极少比例的卵巢癌干细胞能够耐受药物的杀伤力,经过一段时间的自我修复后又开始大量增殖,最终导致肿瘤复发。
本研究我们分别将卵巢癌干细胞和HO8910细胞接种于NOD/SCID雌性裸鼠,观察其体内成瘤能力。结果显示,卵巢癌干细胞成瘤能力至少为HO8910细胞的20倍,而且经过体内传代后的卵巢癌干细胞仍具有连续形成肿瘤的能力,进一步说明卵巢癌干细胞在体内依然具有自我更新和分化能力,其一方面通过自我更新以维持其比例保持恒定,另一方面分化形成大量的HO8910细胞。卵巢癌干细胞经过体内的自我更新和分化后,重新形成了由少数强致瘤性的干细胞和多数弱致瘤性的HO8910细胞构成的表型和功能异质性的细胞群体,在经无血清培养基筛选后保留的少数强致瘤性的干细胞依然可以形成细胞球体,并具有在裸鼠体内连续形成肿瘤的能力。
综上所述,来自人卵巢癌细胞系HO8910的卵巢癌干细胞具有自我更新和分化、体内成瘤、高表达干细胞基因以及对化疗耐药等特性,符合肿瘤干细胞的理论标准。
参考文献:
[1]Gangemi R,Paleari L,Orengo AM.Cancer stem cells: a new paradigm for understanding tumor growth and progression anddrug resistance[J].Currmed Chem,2009,16(12): 1688-1703.
[2]Ghadially R.The role of stem and circulating cells in cancermetastasis[J].J Surg Oncol,2011,103(2): 555-557.
[3]闫洪超,于楠,仝建业,等.人卵巢癌HO8910细胞株中干细胞的筛选及生物学特性鉴定[J].江苏医药,2012,38(3): 431-435.
[4]Zhang S,Balch C,ChanmW,et al.Identification and characterization of ovarian cancer-initiating cells from primary human tumors [J].Cancer Res,2008,68(4): 4311-4320.
[5]Gupta PB,Chaffer CL,Weinberg RA.Cancer stem cells:mirage or reality[J].Natmed,2009,15(11): 1010-1012.
[6]Abdul Khalek FJ,Gallicano GI,Mishra L.Colon cancer stem cells [J].Gastrointest Cancer Res,2010,(Suppl 1): S16-S23.
[7]Suzuki Y,Ishii H,Sekimotom.Cancer stem cell[J].Nihon Rinsho,2011,69(Suppl 3): 98-102.
[8]Ghaffari S.Cancer,stem cells and cancer stem cells: old ideas,newdevelopments[J].F1000med Rep,2011,(3): 23.
[9]Natarajan TG,Ganesan N,Fitzgerald KT.Cancer stem cells andmarkers: newmodel of tumorigenesis with therapeutic implications [J].Cancer Biomark,2010,9(1-6): 65-99.
[10]Maitland NJ,Collins AT.Cancer stem cells-a therapeutic target [J].Curr Opinmol Ther,2010,12(6): 662-673.
[11]Stevenson K,McGlynn L,Shiels PG.Stem cells: outstanding potential and outstanding questions[J].Scottmed J,2009,(54): 35-37.
[12]Roy S,Majumdar AP.Cancer Stem Cells in Colorectal Cancer: Genetic and Epigenetic Changes[J].J Stem Cell Res Ther,2012,17(7): 10342.
[13]Cetin I,Topculm.Cancer stem cells in oncology[J].J BUON,2012,17(6): 644-648.
收稿日期:( 2014-12-03)
通讯作者简介:闫洪超(1973-),男,主任医师,教授,主要研究方向为妇科肿瘤。E-mail: yanhongchao898@ sina.com
作者简介:第一方丽莎(1987-),女,住院医师,主要研究方向为妇科肿瘤。E-mail: 120335540@ qq.com
文章编号:1002-266X(2015)36-0017-04
文献标志码:A
中图分类号:R73-3
doi:10.3969/j.issn.1002-266X.2015.36.006
