抑癌基因TSPYL5在胃癌中的表达及与远期生存的关系
2015-02-19夏建国丁永斌
翟 競, 姜 红, 夏建国, 丁永斌, 魏 尉
抑癌基因TSPYL5在胃癌中的表达及与远期生存的关系
翟競,姜红,夏建国,丁永斌,魏尉

作者单位: 210029江苏南京,江苏省中医院消化肿瘤外科(翟競);210029江苏南京,江苏省人民医院
普外科(姜红,夏建国,丁永斌);210009江苏南京,江苏省肿瘤医院普外科(魏尉)
第一作者: 翟競,女,硕士研究生,住院医师,研究方向:消化系肿瘤的研究,E-mail:birthday0429@163.com
【摘要】目的研究胃癌组织及其邻近胃组织中睾丸特异性Y样蛋白5(testis-specific Y-like protein 5,TSPYL5)的表达与预后及多个临床病理变量之间的关系,同时分析其是否在胃癌远期生存的危险因素中具有意义。方法采用RT-PCR方法检测44例胃癌组织、癌旁胃正常黏膜组织中TSPYL5 mRNA 的表达,分析其表达与胃癌相关临床病理变量的关系。结果与癌旁组织相比,胃癌组织中TSPYL5表达明显下调的有24例,占总数的54.5%。TSPYL5的表达与TNM分期、淋巴转移及是否远处转移有关,而与肿瘤的浸润深度、大小及患者性别、年龄等无关(P<0.05)。肿瘤组织与癌旁组织的TSPYL5表达量相比,其表达下调者的DFS远低于无明显变化及上调者(P=0.01)。经单因素和多因素COX分析表明,TSPYL5可作为胃癌的独立预测因素(P<0.001)。结论TSPYL5作为抑癌基因,其表达缺失参与了胃癌的发生发展,同时TSPYL5可作为判断胃癌预后的重要分子标志。
【关键词】TSPYL5;抑癌基因;甲基化;胃癌;预后
The relationship between expression and long term survival of tumor suppressor gene TSPYL5 in gastric cancerZHAIJing1,JIANGHong2,XIAJianguo2,DINGYongbin2,WEIWei3(1.DepartmentofDigestiveTumorsSurgery,JiangsuProvinveHospitalofTCM,Nanjing210029,China;2.DepartmentofGeneralSurgery,JiangsuProvinceHospital,Nanjing210029,China;3.DepartmentofGeneralSurgery,JiangsuCancerHospital,Nanjing210009,China)
Correspondingauthor:WEIWei,E-mail:weiwei_DR@126.com
Abstract:ObjectiveTo study the relationship between the expression of TSPYL5(testis-specific Y-like protein 5,TSPYL5)in gastric carcinoma and adjacent gastric tissues and the long term survival. Our study is to investigate the clinical significances of expression of TSPYL5 in gastric cancer.MethodsThe mRNA level of TSPYL5 in 44 matched samples comprising primary gastric carcinoma and paired non-cancerous mucosa were detected and compared by quantitative RT-PCR. Then the correlations of mRNA level of TSPYL5 with the clinicopathological characteristics and prognosis of patients with gastric cancer were analyzed.ResultsThe rate of TSPYL5 mRNA in the primary gastric cancer tissues was significantly higher than that in the adjacent non-cancerous tissues(54.5%).mRNA expression of TSPYL5 was associated with certain clinical-pathologic variables such as advancing TNM stage, lymphatic metastasis, distant metastasis. We obtained the expression levels ratio of cancer tissue and adjacent non-cancerous tissues and found the lower ratio with a lower Disease-Free Survival(DFS)(P<0.001).TSPYL5,as a tumor suppressor gene, remained a statistically-significant prognostic marker in the COX regression analysis.ConclusionDown-expression of TSPYL5 had a significant effect on development and progress in gastric cancer,which can be used to prognose gastric carcinoma.
Keywords:TSPYL5; tumor suppressor gene; methylation; gastric cancer; prognostic
中国是胃癌高发的地域之一,每年新发病例约占全球总数的一半,死亡率更是高居前列。目前胃癌的发生发展与众多因素有关,本实验通过检测人胃癌组织和正常组织TSPYL5的mRNA表达,以及经行5年生存率的远期随访来研究TSPYL5的表达和胃癌发生发展及预后的关系,为今后研究胃癌的发病机制、检测监测以及治疗等方面提供新的研究方向。
1材料与方法
1.1病例选择入组标准:(1)选用江苏省人民医院2008年4月至2008年12月胃肠外科行胃癌根治术切除的胃癌患者46例,其中男28例,女18例,年龄39~78(平均59.13)岁。(2)入组者均通过手术治疗,采用标准的D2根治术,全部随访患者未出现并发症,无围手术期死亡。(3)均未进行术前新辅助化疗。入选患者中1例在术后18个月死于脑血管意外,1例在术后3个月死于大面积心肌梗死。失访和非本病死亡病例不纳入统计,实际统计患者44例。
1.2实时荧光定量RT-PCR按Invitrogen公司TRIzol试剂盒说明方法提取组织总RNA。按逆转录试剂盒说明方法进行逆转录合成cDNA,-20 ℃冻存备用。合成TSPYL5引物:上游引物为5′-TGGGAACAGCGGGAACCGT-3′,下游引物为5′-CTGCATCCCTCTCTTCCTTC-3′;内参照β-actin的上游引物为5′-CTCACGAAACTGGAATAAGC-3′下游引物为5′-AAGCCACACGTACTAAAGGT-3′。PCR 反应体系:ddH2O 15.4μl,buffer 2μl,dNTP 0.4μl,cDNA 1μl,上/下游引物(10pmol/L)各0.5μl,Taq plus 0.2μl,反应总体积为20μl。PCR反应条件为:94℃预变性5min,94℃变性1min,58℃退火1min,72℃延伸1min,扩增35个循环,72℃7min。β-actin的PCR反应时退火温度为56℃,其余同前。扩增产物经琼脂糖凝胶电泳20min后,于凝胶成像及分析仪上进行成像分析,于218bp处出现目的条带判为TSPYL5 mRNA阳性表达。我们得到样品中TSPYL5基因及β-actin基因的Ct值,并通过β-actin的Ct值对TSPYL5基因进行差值校正,最终得到相对表达量。
1.3统计方法应用配对t检验来分析mRNA表达差异。无病生存率(DFS)应用生存曲线以图表的形式展现,并且应用Log-rank检验检测组间生存差异。患者及相关的临床变量与其无病生存期之间的关系应用COX比例风险模型来评估。所有的分类数据均应用χ2或Fisher精确概率检验进行计算,数据分析应用SPSS22.0软件,双侧检验P<0.05认为差异具有统计学意义。
2结果
2.1癌组织及癌旁组织TSPYL5表达情况根据癌组织及癌旁组织之间TSPYL5表达量的比较,得出其表达下调者24例,表达上调者8例,无差异者12例,大多数的肿瘤组织中其表达水平明显低于相应的癌旁组织(P<0.05)。
2.2TSPYL5的表达与临床病理各变量之间的关系根据我们的统计分析,TSPYL5的表达和TNM分期以及是否出现远处转移、淋巴结转移相关,而与肿瘤本身浸润的深度无关。在TNM分期中,越是早期的患者TSPYL5的表达缺失就越明显,而到了晚期反而出现了TSPYL5的再表达,特别是有远处转移的患者,TSPYL5均出现了表达上调(表1)。由此提示,TSPYL5的表达缺失在肿瘤发生发展的早期起关键的作用,而在肿瘤的晚期由于其出现了再表达,我们推测其抑癌作用不明显甚至出现缺失。
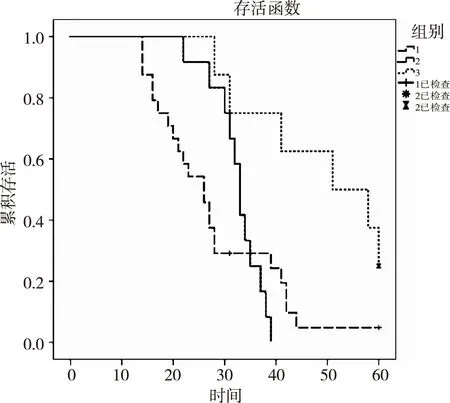
2.3TSPYL5的表达与预后的关系为了便于TSPYL5表达程度变化的统计,我们将癌组织中TSPYL5的表达量与癌旁组织中TSPYL5的表达量相比,得到的比值定义为T,继而我们根据T值的大小,将所有44例数据分成3组进行预后的分析,其中1组为T≤0.5(即下调);2组为0.5 2.4单变量及多变量分析单因素COX模型分析显示DFS与肿瘤TNM分期(P=0.001),是否淋巴结转移(P=0.005),以及TSPYL5的表达(P=0.019)有关;应用COX回归模型对有意义的预后相关因素进行多因素生存分析后显示,TSPYL5的表达可作为大肠癌预后的独立预测因素(P<0.001)(表2)。 表1 TSPYL5 mRNA表达量与临床病理特点之间的联系 图1 生存曲线 3讨论 胃癌的发生发展与众多因素有关,抑癌基因的甲基化作为表观遗传学最重要的修饰方式之一,最近成为研究的新热点[1-2]。TSPYL5基因属于TSPYL家族中的一员,根据现有的研究显示,TSPYL5在许多肿瘤中都出现表达的缺失或者下调[3],因此TSPYL5被认为是一种新的抑癌基因[4]。作为新的抑癌基因,我们对其作用机制尚不十分了解,有观点认为TSPYL5存在启动子高甲基化相关的表达沉默,正是这种表达沉默导致肿瘤组织的发生发展。在针对乳腺癌患者的研究表明,TSPYL5存在表达下调[5],他是通过作用于泛素特异性蛋白酶7 ubiquitin-specific protease 7(USP7;also known as herpesvirus-associated ubiquitin-specific protease;HAUSP)来降低P53蛋白的水平,从而抑制P53靶基因的活性[6]。Kim等[7]研究发现TSPYL5在原发神经胶质瘤中存在启动子的高甲基化(接近100%),同时其表达下调,但在正常的脑组织中几乎没有甲基化。Vachani等[8]在头颈肺部鳞状细胞癌的研究中也发现TSPYL5存在明显的表达下调。作为一个新兴的抑癌基因TSPYL5已经越来越受到人们的重视,关于TSPYL5的研究也越来越多,但很少有关于TSPYL5表达量与胃癌预后的相关分析的报道。本研究收集了江苏省人民医院2008年资料完整的44例病例作为研究对象,从每个研究对象的成对标本中(癌组织与癌旁组织)提取mRNA,并通过RT-PCR的方法获得每个组织中TSPYL5的mRNA表达量,从而对TSPYL5的表达量与生存期之间的关系进行了系统的研究。 表2 胃癌预后单变量及多变量的分析 Jung等[9]对9种胃癌细胞株及胃癌组织中TSPYL5的研究认为,其表达沉默以及其启动子高甲基化与胃癌密切相关。我们的研究也显示,大多数的胃癌肿瘤组织中TSPYL5的表达水平明显低于相应的癌旁组织,这表明TSPYL5基因低表达可能与胃癌的发生、发展有密切关系,从而也进一步突出了TSPYL5作为抑癌基因需要深入研究的重要性。本研究表明,TSPYL5的表达量与肿瘤的浸润深度及T分期无明显相关性,但是无淋巴结转移患者TSPYL5的表达明显低于有淋巴结转移的患者,存在远处转移的患者TSPYL5表达高于无转移患者。这些均提示TSPYL5参与了胃癌的发生发展过程。在生存预后方面,我们可以看出,生存曲线中前12个月的DFS几乎相同,之后3条曲线逐渐分开,随后R值越高的组,其DFS也越高,且具有统计学意义。进一步的研究显示,作为单变量包括TSPYL5在内的3个临床变量与预后相关(肿瘤的临床TNM分期,淋巴结转移情况以及TSPYL5的表达量),而其中只有TSPYL5的表达量可作为胃癌预后的独立因素(P<0.001)。值得注意的是,TSPYL5的表达在Ⅰ、Ⅱ期的患者中要低于Ⅲ、Ⅳ期,这与一般抑癌基因不同,同时COX模型分析中远处转移这一在TSPYL5表达量中存在统计学意义的临床变量对胃癌患者的远期预后却无统计学影响。结合TSPYL5存在启动子甲基化所致的基因失活理论,我们推测TSPYL5在肿瘤早期发展中作用较明显,在肿瘤发展的中晚期可能出现部分TSPYL5无意义的再表达。TSPYL5即使出现表达量的上升但对远期预后没有影响,相对于远处转移,淋巴结的转移出现较早,因此淋巴结是否转移是一个判断TSPYL5表达量与预后相关的临床变量。本实验的一个重要意义在于阐明了TSPYL5的表达量对胃癌预后判断的重要作用,同时也证明了TSPYL5的表达量在肿瘤的早期存在表达缺失,到了肿瘤晚期有部分重新表达的可能,这使得TSPYL5不仅仅可作为一个判断预后指导治疗的新的基因靶点,也是一个早期筛查的更为特异性的指标。 TSPYL5作为新一代抑癌基因参与肿瘤的发生发展,有大量的研究表明启动子甲基化是其表达缺失的重要原因。目前,TSPYL5表达下调与癌症发生之间的深层次的机制还不清楚,但作为TSPYL家族中的成员,其共有的NAP区域在组蛋白和DNA组装成核小体的过程中起重要作用[10]。并且有研究表明,TSPYL家族中的另一重要的抑癌基因TSPYL2可能通过激活p53和MEK/ERK1/2 MAPK通路来上调p21蛋白发挥抑制作用[11-12]。本文推测TAPYL5可能通过一些保守的通路比如p16[13-14]NF-ΚB[15-16]、WNT[17-18]等来发挥抑制作用。同时其为何会出现晚期的再表达的原因也尚未见报道,在今后的研究中我们将深入讨论其作用机制及特点,为寻找新一代肿瘤筛查指标提供分子生物学依据。 参考文献: [1]Necula LG,Mambet C,Albulescu R,et al.Epigenetics in gastric carcinogenesis:tet genes as important players[J].J Immunoassay Immunochem,2015,36(5):445-455. [2]王中秋,许林.DNA甲基化在非小细胞肺癌诊断和治疗中的应用[J].中国肿瘤外科杂志,2010,2(1):42-46. [3]Liu M,Ingle JN,Fridley BL,et al.TSPYL5 SNPs:association with plasma estradiol concentrations and aromatase expression[J].Mol Endocrinol,2013,27(4):657-670. [4]Vogel T,Dittrich O,Mehraein Y,et al.Murine and human TSPYL genes: novel members of the TSPY-SET-NAP1L1 family[J].Cytogenet Cell Genet,1998,81(3-4):265-270. [5]Lyu JH,Park DW,Huang B,et al.RGS2 suppresses breast cancer cell growth via a MCPIP1-dependent pathway[J].J Cell Biochem,2015,116(2):260-267. [6]Epping MT,Meijer LA,Krijgsman O,et al.TSPYL5 suppresses p53 levels and function by physical interaction with USP7[J].Nat Cell Biol,2011,13(1):102-108. [7]Kim TY,Zhong S,Fields CR,et al. Epigenomic profiling reveals novel and frequent targets of aberrant DNA methylation-mediated silencing in malignant glioma[J].Cancer Res,2006,66(15):7490-7501. [8]Vachani A,Nebozhyn M,Singhal S,et al.A 10-gene classifier for distinguishing head and neck squamous cell carcinoma and lung squamous cell carcinoma[J].Clin Cancer Res,2007,13(10):2905-2915. [9]Jung Y,Park J,Bang YJ,et al.Gene silencing of TSPYL5 mediated by aberrant promoter methylation in gastric cancers[J].Lab Invest,2008,88(2):153-160. [10]Fujii-Nakata T,Ishimi Y,Okuda A,et al.Functional analysis of nucleosome assembly protein,NAP-1.The negatively charged COOH-terminal region is not necessary for the intrinsic assembly activity[J].J Biol Chem,1992,267(29):20980-20986. [11]Kandalaft LE,Zudaire E,Portal-Nunez S,et al.Differentially expressed nucleolar transforming growth factor-beta1 target (DENTT) exhibits an inhibitory role on tumorigenesis[J].Carcinogenesis,2008,29(6):1282-1289. [12]Tu Y,Wu W,Wu T,et al.Antiproliferative autoantigen CDA1 transcriptionally up-regulates p21(Waf1/Cip1) by activating p53 and MEK/ERK1/2 MAPK pathways[J].J Biol Chem,2007,282(16):11722-11731. [13]Vallian S,Sedaghat M,Nassiri I,et al.Methylation status of p16 INK4A tumor suppressor gene in Iranian patients with sporadic breast cancer[J].J Cancer Res Clin Oncol,2009,135(8):991-996. [14]DeInnocentes P,Agarwal P,Bird RC.Phenotype-rescue of cyclin-dependent kinase inhibitor p16/INK4A defects in a spontaneous canine cell model of breast cancer[J].J Cell Biochem,2009,106(3):491-505. [15]Fukushige S,Kondo E,Horii A.Methyl-CpG targeted transcriptional activation allows re-expression of tumor suppressor genes in human cancer cells[J].Biochem Biophys Res Commun,2008,377(2):600-605. [16]Lavon I,Fuchs D,Zrihan D,et al. Novel mechanism whereby nuclear factor kappaB mediates DNA damage repair through regulation of O(6)-methylguanine-DNA-methyltransferase[J].Cancer Res,2007,67(18):8952-8959. [17]Prasad CP,Mirza S,Sharma G,et al.Epigenetic alterations of CDH1 and APC genes:relationship with activation of Wnt/beta-catenin pathway in invasive ductal carcinoma of breast[J].Life Sci,2008,83(9-10):318-325. [18]Fukuyama R,Niculaita R,Ng KP,et al. Mutated in colorectal cancer,a putative tumor suppressor for serrated colorectal cancer,selectively represses beta-catenin-dependent transcription[J].Oncogene,2008,27(46):6044-6055. [收稿日期:2015-04-10][本文编辑:戴雅玥]临床与基础研究 文章编号:1674-4136(2015)05-0278-05 doi:10.3969/j.issn.1674-4136.2015.05.002 通讯作者:魏尉,男,硕士研究生,主治医师,研究方向:胃肿瘤的研究,E-mail:weiweiDR@126.com 基金项目:六大人才高峰(2013-WSW-028)