西藏斯布牦牛脏器品质及活性物质分析
2015-02-17张玉卿郭兆斌韩玲参木友余群力
张玉卿,郭兆斌,韩玲,参木友,余群力
(1.甘肃农业大学食品与工程学院,甘肃 兰州 730070;2.西藏自治区农牧科学院,西藏自治区 拉萨 850000)
西藏斯布牦牛脏器品质及活性物质分析
张玉卿1,郭兆斌1,韩玲1,参木友2,余群力1
(1.甘肃农业大学食品与工程学院,甘肃 兰州730070;2.西藏自治区农牧科学院,西藏自治区 拉萨850000)
摘要:研究分别选取西藏斯布牦牛的肝脏、心脏、肺脏和肾脏为试验材料,以青海海北牦牛为对照,研究了西藏斯布牦牛的食用品质、营养特性及生物活性物特征.结果表明:西藏斯布牦牛肝脏和心脏色泽较暗,但属于正常颜色,pH1值分别为5.68、5.14,剪切力分别为1.02 kgf、1.48 kgf,熟肉率分别为77.59%、79.37%,相比青海海北牦牛,西藏斯布牦牛其pH1值在规定的范围值内,剪切力高于对照,熟肉率低于对照;西藏斯布牦牛肝脏和心脏的水分含量分别为69.89%、76.20%,蛋白质含量分别为20.89%、17.31%,脂肪含量分别为3.00%、3.62%,灰分含量分别为1.67%、1.29%,相比对照青海海北牦牛,其水分和脂肪相差不大,蛋白质含量高,矿物质丰富;同时测得西藏斯布牦牛含有较高的生物活性物,其中肝脏和心脏左旋肉碱含量分别为29.28、13.20 mg/kg,牛磺酸含量分别为4.52、1.28 mg/g,肝脏谷胱甘肽含量为0.4 mg/g,肾脏谷胱甘肽含量是0.26 mg/g,肺脏和心脏中肝素钠含量分别为100.54、41.04 mg/kg.相比对照青海海北牦牛,西藏斯布牦牛的左旋肉碱、谷胱甘肽含量较高,而牛磺酸、肝素钠含量低于青海海北牦牛,因此认为,西藏斯布牦牛脏器是可以充分利用的资源,具有很高的食品营养价值.
关键词:西藏斯布牦牛;食用品质;营养特性;生物活性物质
第一作者:张玉卿(1989-),男,硕士研究生,研究方向为食品工程.E-mail:867453409@qq.com
斯布牦牛以品质优良而闻名于西藏,是旧西藏达官贵人享受的贡品.而今斯布牦牛已走出了山沟,成为当地牧民增收致富的法宝.斯布牦牛体格硕大,是西藏4大优良牦牛品种之一,其毛、骨、肉在市场上都格外受青睐.养殖牦牛是农牧民增加收入的一条重要渠道,但牦牛在生产过程中会产生大量的副产品,开发牦牛的副产品已成为动物源产品的主流趋势和新兴产业,也逐渐成为各肉联企业和科研机构的研究热点之一[1-3].因此,研究西藏斯布牦牛脏器的食用品质、营养特性及生物活性物的相应指标,可以提高西藏斯布牦牛的利用率,增加附加值,有利于提高我国牦牛产业副产物总体综合利用水平.
有研究报道称,新鲜牦牛肝脏中富含α-VE、VB12,各种氨基酸,以及Ca、Mg、Fe、Zn、Cu等矿物质元素,是一种高蛋白、低脂肪、富含维生素和各种矿物质的健康食品.谷胱甘肽(GSH)是生物体内一种主要的活性三肽化合物,具有重要的细胞和生理功能,它可与氧自由基进行非酶促反应防止氧化,产生免疫和解毒功能,有效清除自由基,延缓衰老.肝素钠(heparin)是肝素的一种钠盐,是Mclean在1861年研究凝血机制时发现的一种酸性粘多糖,Rabia等[4]在1939年证明其有抗凝血活性而作为天然抗凝血物质,受到众多研究者重视,至今已有大量关于其的临床应用报道.左旋肉碱(L-肉碱)是由两位俄国科学家Gulewitch和Krimbe于1905年发现,是人类及动物必需的营养物质,是一种类维生素营养物质,其主要功能是转运脂肪进入线粒体中,促进脂肪酸燃烧,特别是促进β-氧化,为机体提供能量[5-6],因此,其被认为有较好的减肥功能和抗疲劳作用,已被广泛的用于保健品行业.牛磺酸是一种人体所必需含硫非蛋白氨基酸,可促进大脑发育,调节神经传导,维持正常的心脏、肝脏、内分泌、视网膜系统的功能和很强的生物活性,如解热、镇痛、降血压、抗菌、提高免疫力和抗肿瘤活性等作用,已广泛有效应用在医药和食品行业中[7].
本研究以西藏斯布牦牛和青海海北牦牛脏器(肝脏、心脏、肺脏、肾脏)为实验原料,分析和比较了西藏斯布牦和牛青海海北牦牛脏器的食用品质(色度、pH1值、剪切力和熟肉率)和营养品质(水分、蛋白质、脂肪、灰分)及生物活性物(谷胱甘肽、肝素钠、左旋肉碱、牛磺酸)的差异,采用国内外先进方法分析检测其中谷胱甘肽、肝素钠、左旋肉碱、牛磺酸含量,从食用品质、营养特性、生物活性物方面评价其脏器品质和开发利用价值,为西藏斯布牦牛脏器的综合利用提供科学依据和理论参考,提高我国牦牛副产品的综合利用水平.
1材料与方法
1.1 材料与试剂
于2013年10月22~24日,随机选取发育正常、健康无病,5~6岁西藏拉萨斯布牦牛6头,宰前禁食24 h,停水2 h,运往拉萨进行了屠宰试验,宰杀后45 min内取脏器(肝脏、心脏、肺脏和肾脏)适量,除去表面污物,样品采集后现场测定食用品质各指标,同时每个脏器切取300 g左右(除去结缔组织),装入保鲜袋密封,于-18 ℃冰箱冷冻待测.随机选择自然放牧条件下,发育正常、健康无病、5~6岁青海省海北州成年牦牛6头为对照组.
试验中所使用的高氯酸、肉碱乙酰辅酶A、乙酰丙酮、醋酸钠、甲醛、Tris-HCl、DTNB、硼砂、树脂、磷酸、三氯乙酸、甲醇、乙酸甲酯、丙酮、硅镁吸附剂等试剂均为分析纯.
1.2 仪器设备
CR-10型色差仪,柯尼卡美能达公司;L5000高速台式离心机,长沙湘仪离心机仪器有限公司;C-LM4型数显式肌肉嫩度仪,东北农业大学工程学院;756P紫外可见分光光度计,上海光谱仪器有限公司;LE-52系列旋转蒸发仪,上海亚荣生化仪器厂;XMTD-电热恒温干燥箱,上海一恒科学仪器有限公司;KND-08C消化炉,上海听瑞仪器仪表有限公司;TGL-24MC台式高速冷冻离心机,长沙平凡仪器仪表有限公司;PHS-3C型数字酸度计,仪电科学仪器有限公司.
1.3 试验方法
1.3.1脏器食用品质的测定色度:采用CR-10色差仪,在屠宰后10 min内对脏器的色度分别进行测定,包括亮度(L*)、红色度(a*)、黄色度(b*)3个值[8].
pH1值:在屠宰后1 h内测定的pH值.
剪切力:屠宰后45 min,脏器水浴至中心温度70 ℃,保持30 min取出,冷却至室温,用直径1.27 cm的取样器钻取3个肉柱,然后用嫩度仪测定每个肉柱的剪切力值,求其平均值[9].
熟肉率:对脏器进行称质量(W1),80 ℃的水浴锅水浴加热30 min,取样冷却后称质量(W2).熟肉率按以下公式计算[10]:
熟肉率(%)=W2/W1×100%
1.3.2脏器营养品质的测定蛋白质含量的测定参照GB 50095-2010《食品中蛋白质的测定》方法,水分含量的测定参照GB/T 5009.3-2010《食品中水分的测定》方法,灰分含量的测定参照GB 50094-2010《食品中灰分的测定》方法,脂肪含量的测定参照GB/T 50096-2003《食品中脂肪的测定》方法.
1.3.3脏器活性成分的测定谷胱甘肽含量测定:参照疏基的测定方法[11],将约1 g样品置于研钵中,加入10%三氯乙酸6 mL,充分研磨后于8 000 r/min(4 ℃)离心10 min,将上清液倒入50 mL烧杯中,吸取上清液和蒸馏水各1 mL于10 mL试管中,加入0.25 mol/L的pH8.0的Tris-HCl缓冲液3 mL,充分摇匀后再加入3%甲醛1 mL,摇匀,静置,立即取1 mL上述溶液于试管中,再加入5 mL DTNB分析溶液(预先恒温于25 ℃水浴锅中),摇匀,在412 nm下测定吸光度,每组试验重复3次,取平均值,并计算其含量.
肝素钠含量测定:采用盐解、离子交换与乙醇沉淀相结合的方法提取肝素钠.实验流程为:原料→提取→吸附→洗涤→洗脱→沉淀→脱水干燥→肝素钠粗品→测定.称取样品100 g,加人5倍量蒸馏水,充分破碎至肉糜状,调pH至8.5,过滤,滤液冷却后调pH至8.5,加入树脂,维持温度在50 ℃左右搅拌,连续吸附8 h,过滤收集树脂,将树脂装入填充柱,用NaCl浸泡洗涤30 min.将洗脱液先沉淀酸蛋白后沉淀碱蛋白,滤纸过滤,取滤液用1.5倍体积的95%乙醇加入烧杯中,摇匀静置12 h,真空抽滤,滤渣在60 ℃下真空干燥,得到肝素钠粗品.采用浓硫酸氧化法来检测溶液中肝素的浓度,于298 nm波长测定吸光度,每组试验重复3次,取平均值,并计算其含量[12-13].
L-肉碱的测定:采用超声波辅助酸提法提取西藏斯布牦牛肝脏和心脏中的L-肉碱,提取流程:样品→匀浆→超声→冰浴→离心→调pH→旋转蒸发浓缩→真空抽滤→定容→测定,在100 g物料中加入5倍量3%高氯酸,匀浆5 min,4 500 r/min离心取上清液,沉淀用高氯酸匀浆后超声,再次离心取上清液,合并2次上清液,调pH至7.8,浓缩至45 mL左右,真空抽滤后定容至50 mL,向每个小试管中注入含DTNB、乙酰辅酶A、EDTA二钠和Tris-HCl的混合溶液180 μL,再加入60 μL提取液,混合后在每个小试管中分别加入肉碱乙酰辅酶A溶液5 μL,并与35 ℃保持10 min,吸光度不再变化时在412 nm处测吸光度值,每组试验重复3次,取平均值,并计算其含量[14-15].
牛磺酸的测定:采用水提取法对西藏斯布牦牛肝脏和心脏中的牛磺酸进行提取,提取流程:样品→匀浆→自溶→提取→除蛋白→脱色浓缩→过柱除杂→测定.具体步骤为:原料25 g,按1∶4加入蒸馏水,匀浆至糜状,除去酸性蛋白,再调节pH至8.5,4 500 r/min离心20 min除去碱性蛋白,收集上清液,采用适量活性炭脱色后用布氏漏斗抽滤并收集滤液,旋转蒸发浓缩至50 mL,调pH至4.5,吸取10 mL,浓缩液缓慢置于阳离子树脂交换柱中,用15 mL蒸馏水分3次洗脱,收集此溶液共25 mL待测,吸取1 mL收集的溶液,加入1 mL显色剂,100 ℃下水浴15 min,冷却后在400 nm波长下测定其吸光度值,并计算其含量[16-17].
1.4 数据处理
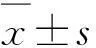
2结果与分析
2.1 脏器食用品质
从表1可看出,西藏斯布牦牛L*为45.73、a*为2.71、b*为8.67,极显著的低于青海海北牦牛(P<0.01).西藏斯布牦牛L*、a*、b*较低,主要由于牦牛生长在高海拔、空气稀薄地区,肝脏中肌红蛋白、血红蛋白含量高,而体内水分含量较低所致.西藏斯布牦牛肝脏pH1为5.68,略低于青海海北牦牛,差异不显著(P>0.05);剪切力为1.02 kgf,极显著高于青海海北牦牛(P<0.01);熟肉率为77.59%显著低于青海海北牦牛(P<0.05).
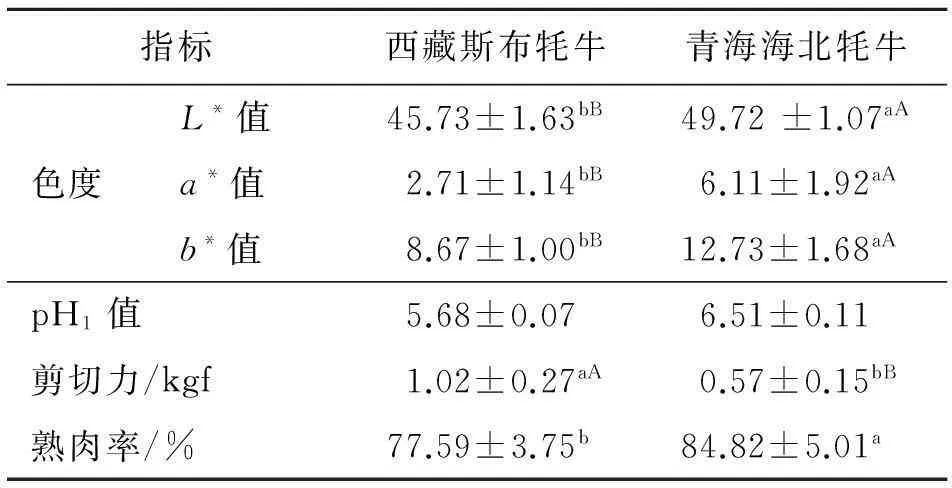
表1 肝脏食用品质测定结果
由表2可看出,西藏斯布牦牛心脏的L*为49.63、b*为9.78极显著高于青海海北牦牛(P<0.01),a*为5.79极显著低于青海海北牦牛(P<0.01);pH1值两者均在正常范围内差异不显著.西藏斯布牦牛心脏剪切力为1.48 kgf,高于青海海北牦牛,说明青海海北牦牛嫩度优于西藏斯布牦牛,但相差不大(P>0.05).西藏斯布牦牛心脏熟肉率为79.37%,而青海海北牦牛为84.78%,两者差异显著(P<0.05).

表2 心脏食用品质测定结果
2.2 脏器常规营养品质
由表3可知,西藏斯布牦牛肝脏的水分含量69.89%,青海海北牦牛肝脏水分含量为69.97%,两者差异不显著(P>0.05).西藏斯布牦牛肝脏中蛋白质的含量为20.89%,高于青海海北牦牛,但差异不显著(P>0.05);西藏斯布牦牛肝脏脂肪含量为3.00%,青海海北牦牛肝脏中含量为2.76%,二者差异不显著(P>0.05);西藏斯布牦牛肝脏中灰分的含量显著高于青海海北牦牛(P<0.05).
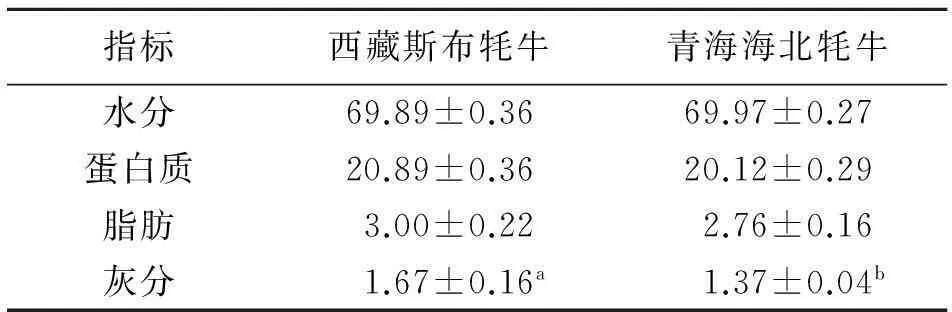
表3 肝脏营养特性测定结果
由表4知,西藏斯布牦牛心脏的水分含量为76.20%,低于青海海北牦牛心脏中水分的含量,差异显著(P<0.05).西藏斯布牦牛心脏中蛋白质含量为17.31%,青海海北牦牛为15.11%,二者差异极显著(P<0.01).西藏斯布牦牛心脏中脂肪含量为3.62%,极显著高于青海海北牦牛(P<0.01);西藏斯布牦牛心脏中灰分的含量为1.29%,青海海北牦牛为1.07%,差异显著(P<0.05).
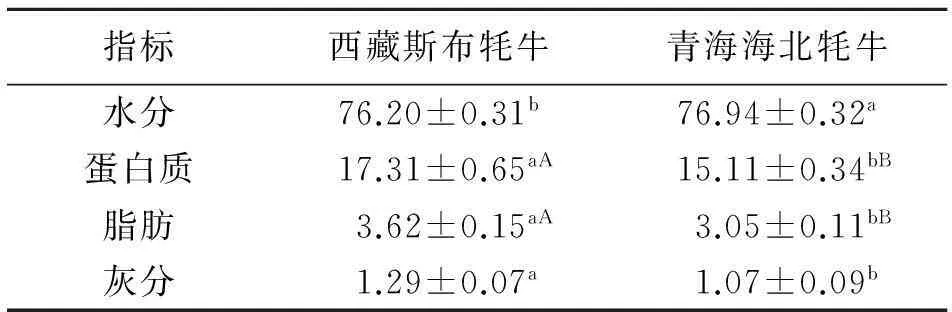
表4 心脏营养特性测定结果
本研究中西藏斯布牦牛肝脏和心脏中的水分含量分别为69.89%和76.20%,比青海海北牦牛肝脏和心脏中水分含量分别低0.11%和0.97%,表明西藏斯布牦牛肝脏和心脏嫩度略低,汁少.蛋白质是组成人体的主要成分之一,具有重要的生理功能,瘦牛肉中蛋白质的平均含量为22.6%,西藏斯布牦牛肝脏和心脏中蛋白质含量分别为20.89%,17.31%,均小于瘦牛肉中蛋白质的含量,而高于青海海北牦牛.脂肪可以改善食物的感官性状,引起食欲,脂肪含量低,则肉品的风味不好,而脂肪含量超过一定水平后,会对人体健康产生不利的影响.一般瘦牛肉脂肪的平均含量为1.1%,而肥牛肉的脂肪含量为20.1%.西藏斯布牦牛肝脏和心脏中脂肪含量分别为3.00%、3.62%,其含量高于瘦牛肉中脂肪含量,而低于肥肉中脂肪含量,整体感官性状良好,营养价值高.本研究中西藏斯布牦牛肝脏和心脏中灰分含量分别为1.67%,1.29%,均显著高于青海海北牦牛含量,说明西藏斯布牦牛肝脏和心脏矿物质丰富,食用价值较高.
2.3 脏器活性物质分析
由图1可知,西藏斯布牦牛肝脏中谷胱甘肽含量为0.4 mg/g,显著高于青海海北牦牛(P<0.05);西藏斯布牦牛肾脏中谷胱甘肽含量为0.26 mg/g,高于青海海北牦牛,但无显著差异(P>0.05).
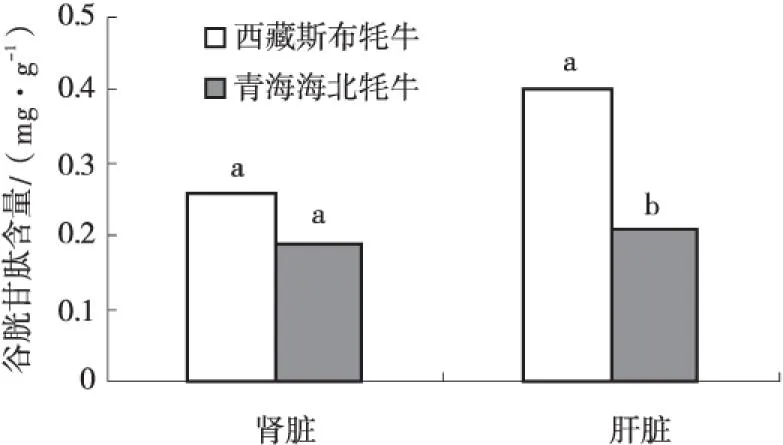
图1 谷胱甘肽含量比较
由图2可知,西藏斯布牦牛肺脏中肝素钠含量分别为100.54 mg/kg,极显著低于青海海北牦牛(P<0.01),心脏中肝素钠含量41.04 mg/kg,与海北牦牛差异不显著(P>0.05).
由图3可以看出,西藏斯布牦牛肝脏中左旋肉碱含量为29.28 mg/g,青海海北牦牛为27.70 mg/g,两者差异不显著(P>0.05);西藏斯布牦牛心脏中左旋肉碱含量为13.2 mg/g,青海海北牦牛为11.45 mg/g,两者差异不显著(P>0.05).
由图4可以看出,西藏斯布牦牛肝脏中牛磺酸含量为4.52 mg/g,显著低于青海海北牦牛肝脏含量(P<0.05),而心脏中牛磺酸含量为1.28 mg/g,极显著低于青海海北牦牛(P<0.01).
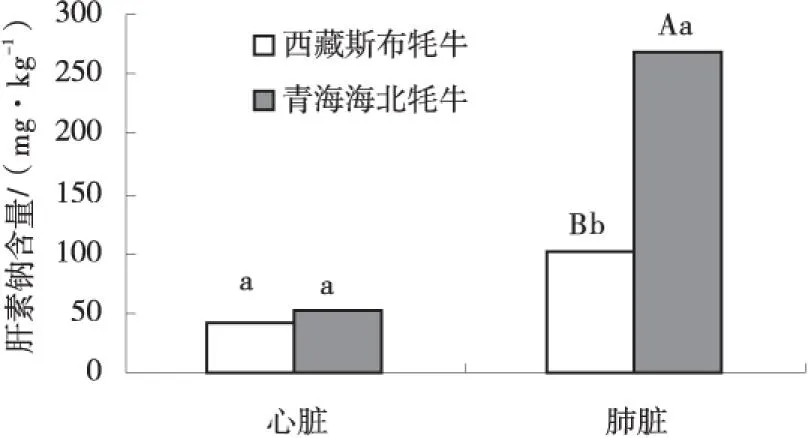
图2 肝素钠含量比较
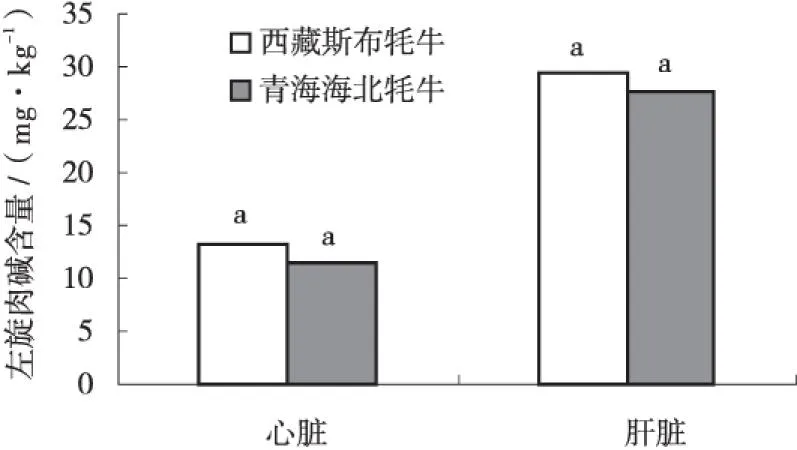
图3 左旋肉碱含量比较
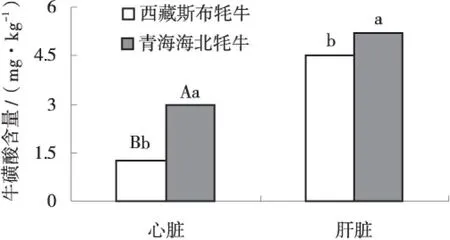
图4 牛磺酸含量比较
3结论
西藏斯布牦牛肝脏和心脏剪切力高于青海海北牦牛,其中肝脏达极显著水平(P<0.05),而肝脏和心脏中熟肉率显著低于青海海北牦牛(P<0.05);水分含量低于青海海北牦牛,但差异不显著;心脏蛋白质含量极显著高于青海海北牦牛(P<0.01),而肝脏蛋白质与海北牦牛差异不显著;西藏斯布牦牛灰分含量显著高于青海海北牦牛(P<0.05);肝脏和心脏中左旋肉碱含量与青海海北牦无显著差别;肝脏中谷胱甘肽含量显著高于青海海北牦牛,心脏中牛磺酸低于青海海北牦牛;心脏和肺脏中含有大量的肝素钠,肾脏含有谷胱甘肽,这些都是可以利用的生物活性物资源.
参考文献
[1]余群力,蒋玉梅,王存堂,等.白牦牛肉成分分析及评价[J].中国食品学报,2005,5(4):124-125
[2]刘佳东,余群力,李永鹏.宰后冷却牦牛肉排酸过程中肉用品质的变化[J].甘肃农业大学学报,2011,46(2):111-114
[3]郭兆斌,余群力.牛副产品:脏器的开发利用现状[J].肉类研究,2011,25(3):35-37
[4]Rabia T.A review of unfractionated heparin and its monitoring[J].US Pharm,2007,32(7):26-36
[5]Peluso G,Petillo O,Barbarisi A,et a1.Carnitine protects the molecular chaperonedactivity of lens alpha-crystallin and decreases the post-translational protein modifications induced by oxidative stress[J].PASED J,2001,15:1604-1606
[6]Brass E P,Adler S,Sietsema K E,et a1.Intravenous L-carnitine increases plasma carnitine,reduces fatigue,and may preserve exercise capacity in hemodialysis[J].Am J Kindey Dis,2001,37:1018-1028
[7]赵鹏,李彬,杨俊峰,等.天然牛磺酸的降血脂作用[J].2005,27(1):70-73
[8]景缘,余群力,韩玲,等.青海海北犊牦牛肉食用品质及血清生化指标的相关性分析[J].食品科学,2013,34(7):38-41
[9]王存堂,杨丽,韩玲,等.甘加藏羊肉营养成分与加工性能的研究[J].食品工业科技,2009(6):313-315
[10]韩玲.白牦牛产肉性能及肉质分析[J].中国食品学报,2002(2):22-26
[11]Owen W G.Determination of glutathione and glutathione disulfide using glutathione reductase and 2-vinylpyridine[J].Analytical Biochemistry,1980,106(1):207-212
[12]Robert J L,Duraikkannu L,Ali A H,et al.Oligosaccharide mapping of low-molecular-weight heparins:structure and activity differences[J].Med Chem,1990,33(6):1639-1645
[13]程林坤,宋焕禄.牦牛肺中肝素钠提取工艺条件优化[J].肉类研究,2010(12):37-40
[14]Knuttel-Gustavsen S.The determination of L-carnitine in several foods samples[J].Food Chemistry,2007,105(30):793-804
[15]甘宾宾,黎少豪.HPLC法测定保健食品中左旋肉碱含量的研究[J].中国卫生检验杂志,2010(7):1688-1689
[16]陈骋,张丽,韩玲,等.牦牛不同脏器中牛磺酸提取工艺优化及含量分析[J].食品工业科技,2013,34(2):83-86
[17]龚丽芬,黄慰生,郑志福,等.牛磺酸的生物活性提取与测定[J].福建化工,2003(1):26-28
(责任编辑胡文忠)
Analysis on organ quality and activity of ibetan Sibu yak
ZHANG Yu-qing1,GUO Zhao-bin1,HAN Ling1,CAN Mu-you2,YU Qun-li1
(1.College of Food Science and Engineering,Gansu Agricultural University,Lanzhou 730070,China;2.Tibet
Autonomous Region Academy of Agriculture and Animal Husbandry,Lasa 850000,China)
Abstract:Tibetan Sibu yak liver,heart,lungs and kidneys were taken as the test materials,and Qinghai yak was taken as the control,the edible quality,nutrient characteristics and biological activity of the yak were studied.The results showed that,the liver and heart color of Tibetan Sibu yak were normal dark,pH1 values of the liver and heart were 5.68 and 5.14,,respectively,which were both within the regulation range.The shear force of the liver and heart were 1.02kgf and 1.48 kgf,respectively,which were both higher than that of control.The cooked rates of the liver and heart were 77.59% and 79.37%,respectively,which were both lower than that of control.The moisture contents,protein contents,fat contents and ash contents of the liver and heart were 69.89 g/100g and 76.20 g/100g,20.89 g/100g and 17.31 g/100g,3.00 g/100g and 3.62 g/100g,1.67 g/100g and 1.29 g/100g,respectively.Compared with control,Tibetan Sibu yak had higher protein content and abundant minerals.The biological active substances of Tibetan Sibu yak were also higher,the carnitine and taurine contents of the liver and heart were 29.28 mg/kg and 13.20 mg/kg,4.52 mg/g and 1.28 mg/g,respectively.Meanwhile,the liver also contained 0.4 mg/g glutathione,the kidneys also contained 0.26 mg/g glutathione,the heparin in lung and heart were 100.54 mg/kg and 41.04 mg/kg,respectively.Compared with control,L-carnitine and glutathione were both higher,taurine and heparin sodium contents were both lower.The results indicated that the organs of Tibetan Sibu yak could be made full use,since they had high value in use.
Key words:Tibetan Sibu yak;edible quality;nutrient characteristics;biological active substance
收稿日期:2014-05-27;修回日期:2014-06-09
基金项目:国家公益性行业(农业)科研专项经费资助项目(201203009);国家现代农业(肉牛牦牛)产业技术体系项目(CARS-38).
通信作者:韩玲,女,教授,博士生导师,研究方向为畜产品贮藏加工.E-mail:hanl@gsau.edu.cn
中图分类号:TS 251.9
文献标志码:A
文章编号:1003-4315(2015)04-0115-06
