霉菌毒素OTA和α-ZOL对Hep G2细胞增殖及氧化损伤的影响
2015-02-17王海微郑楠李松励李发弟王加启
王海微,郑楠,李松励,李发弟,王加启
(1.甘肃农业大学动物科学技术学院,甘肃 兰州 730070;2.中国农业科学院北京
畜牧兽医研究所,北京 100193)
霉菌毒素OTA和α-ZOL对Hep G2细胞增殖及氧化损伤的影响
王海微1,2,郑楠2,李松励2,李发弟1,王加启1,2
(1.甘肃农业大学动物科学技术学院,甘肃 兰州730070;2.中国农业科学院北京
畜牧兽医研究所,北京100193)
摘要:为了研究不同剂量赭曲霉毒素A(OTA)和α-玉米赤霉烯醇(α-ZOL)联合作用对Hep G2细胞毒性的交互作用及其可能机制,试验采用3×3析因试验设计,设OTA浓度和α-ZOL浓度2个因素,OTA浓度水平分别为0、6和12 μmol/L,α-ZOL浓度水平分别为0、15和30 μmol/L,全组合后共组成9个水平组合.毒素作用时间为48 h.用边际均数轮廓图判断细胞毒性和氧化损伤的交互作用,结果发现OTA和α-ZOL联合作用时,细胞毒性、超氧化物歧化酶(SOD)活性、丙二醛(MDA)含量、谷胱甘肽过氧化物酶(GSH-PX)活性和谷胱甘肽(GSH)含量的交互作用一致,均表现为拮抗效应;且细胞活力的变化与SOD活性、MDA含量、GSH-PX活性和GSH含量的变化表现为显著性相关(P<0.05).结果表明细胞毒性的交互作用为拮抗效应,且氧化损伤是毒素诱发细胞毒性的主要途径之一.
关键词:赭曲霉毒素A;α-玉米赤霉烯醇;氧化损伤;析因法;边际均数
第一作者:王海微(1987-),男,硕士研究生,研究方向为生鲜乳质量安全.E-mail:wanghaiweihappy@163.com
李发弟,男,教授,博士生导师,主要从事动物营养与饲料科学研究.E-mail:lifd@gsau.edu.cn
霉菌毒素是霉菌的次级代谢产物,主要存在于被污染的食物和饲料中.在霉菌毒素中,赭曲霉毒素A(OTA)和玉米赤霉烯醇(ZEA)在食品和饲料中的检出率高,对人类健康造成了重大威胁,已引起了社会广泛的关注.OTA被国际癌症研究机构(IARC)列为2B类致癌物[1-2],具有肾毒性、肝毒性和免疫毒性[3].ZEA也被IARC列为3类致癌物[1-2],具有肝毒性和雌激素样毒性[4].ZEA能够通过肝脏代谢为α-ZOL,且α-ZOL的雌激素活性是ZEA的3~4倍[5].
国内外已有许多关于谷物中霉菌毒素共存的报道.如Rodrigues等[6]检测了3 300份玉米、大豆、小麦、大麦和大米样品,结果表明有42%以上的样品检出2种或3种霉菌毒素.陈心仪等[7]检测了中国18个省份的41份玉米样品,结果发现所有样品中都同时存在OTA与ZEA.Huang等[8]检测了50个牛奶样品中的霉菌毒素,结果表明45%的样品中同时检出了OTA、ZEA与α-ZOL.国内外试验结果表明,OTA和α-ZOL分别作用于细胞时,可以诱发细胞毒性,且细胞毒性呈现出剂量依赖[9-10],但有关OTA和α-ZOL间交互效应及其作用机制的研究报道较少.本试验旨在通过研究OTA和α-ZOL单一作用及其联合作用对Hep G2的细胞毒性和氧化损伤,判断OTA与α-ZOL的细胞毒性交互作用及其机制,为食品的质量安全风险评估提供参考.
1材料与方法
1.1 材料与试剂
Hep G2细胞株:美国ATCC公司;DMEM培养基、胎牛血清(Fetalbovine serum,FBS):美国Gibco公司;四甲基偶氮唑蓝[3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide,MTT],二甲基亚砜(DMSO):美国Sigma公司;BCA蛋白浓度、SOD、MDA、GSH-PX和GSH测定试剂盒:南京建成生物工程研究所;PBS磷酸盐缓冲溶液,胰蛋白酶液、青霉素链霉素混合液、IP细胞裂解液:碧云天生物技术研究所;OTA标准品:美国Fermentek公司;α-ZOL标准品:美国Sigma公司;其余试剂:国产分析纯.毒素母液配制:分别将5 mg OTA和α-ZOL,溶解于1 mL甲醇中,配成浓度为5 000 μg/mL的母液,-20 ℃冷冻储存.
1.2 试验方法
1.2.1细胞培养将Hep G2细胞置于含10%胎牛血清、100 U/L青霉素、100 μg/mL链霉素的DMEM培养液中,于37 ℃、5% CO2、饱和湿度环境下常规培养.当细胞生长至80%~90%融合时,用胰蛋白酶溶液消化细胞.
1.2.2细胞活力的测定取96孔培养板,每孔加入100 μL细胞悬液,Hep G2细胞浓度为5×104个/mL,37 ℃培养24 h后弃去培养液,处理组加入含有不同浓度毒素的处理液,对照组加入100 μL不含毒素但含有相应甲醇浓度的DMEM培养基,培养48 h后除去培养液,加入0.5 mg/mL MTT-DMEM孵育4 h,吸除培养基后,加入100 μL DMSO摇晃5 min,以完全溶解出MTT紫色结晶产物.用酶标仪在570 nm处(以630 nm为参考波长)测定吸光度值.试验重复3次.计算公式如下[11-12].

1.2.3细胞内SOD、GSH-PX、MDA及SOD含量的测定染毒培养48 h,收集细胞,1 500 r/min离心3 min后用PBS洗涤细胞3次.每个样品中加入150 μL含1% Triton X-100,20 mmol/L Tris(pH 7.5)的裂解液,进行裂解.取裂解液分别测定超氧化物歧化酶(SOD)活性和谷胱甘肽过氧化物酶(GSH-PX)活性,丙二醛(MDA)及谷胱甘肽(GSH)含量,按照试剂盒说明书中详细操作步骤进行测定.
1.3 试验设计
本试验采用3×3析因试验设计,设A和B 2个因素.A为OTA浓度水平,A1、A2和A3分别为0,6、12 μmol/L;B为α-ZOL浓度水平,B1、B2和B3分别为0、15、30 μmol/L;A因素的3个浓度水平与B因子的3个浓度水平进行全组合,共组成9个水平组合,具体组合方式见表1.毒素作用时间为48 h.
参照顾兵等[13]和张蕾等[14]的方法,根据边际均数轮廓图判断毒素交互作用类型:如果2条量效曲线互相平行(斜率差异不显著),则说明二因素之间具有加和作用;如果2条量效曲线不平行(斜率差异显著),随剂量增大,量效曲线下降(或上升)的趋势显著加强,二因素之间具有协同作用.反之随剂量增大,量效曲线下降(或上升)的趋势显著减缓,二因素之间具有拮抗作用.
1.4 数据处理
采用SAS 9.2统计软件对数据进行单因素方差分析,用Duncan’s法进行多重比较,显著水平α=0.05.用Excel做边际均数轮廓图,并比较量效曲
线的斜率.
2结果与分析
2.1 OTA和α-ZOL单一及联合作用对Hep G2细胞增殖及氧化损伤的影响
OTA单一作用时(试验组1、4和7:OTA的浓度分别为0、6、12 μmol/L),随着作用浓度的升高,细胞活力逐渐降低,MDA含量逐渐升高,GSH-PX活性逐渐降低,GSH含量逐渐降低,且试验组1、4和7的细胞活力,MDA含量,GSH-PX活性和GSH含量,组间差异均显著(P<0.05).说明OTA的细胞毒性呈剂量依赖,MDA含量,GSH-PX活性和GSH含量的变化呈剂量依赖(表1).
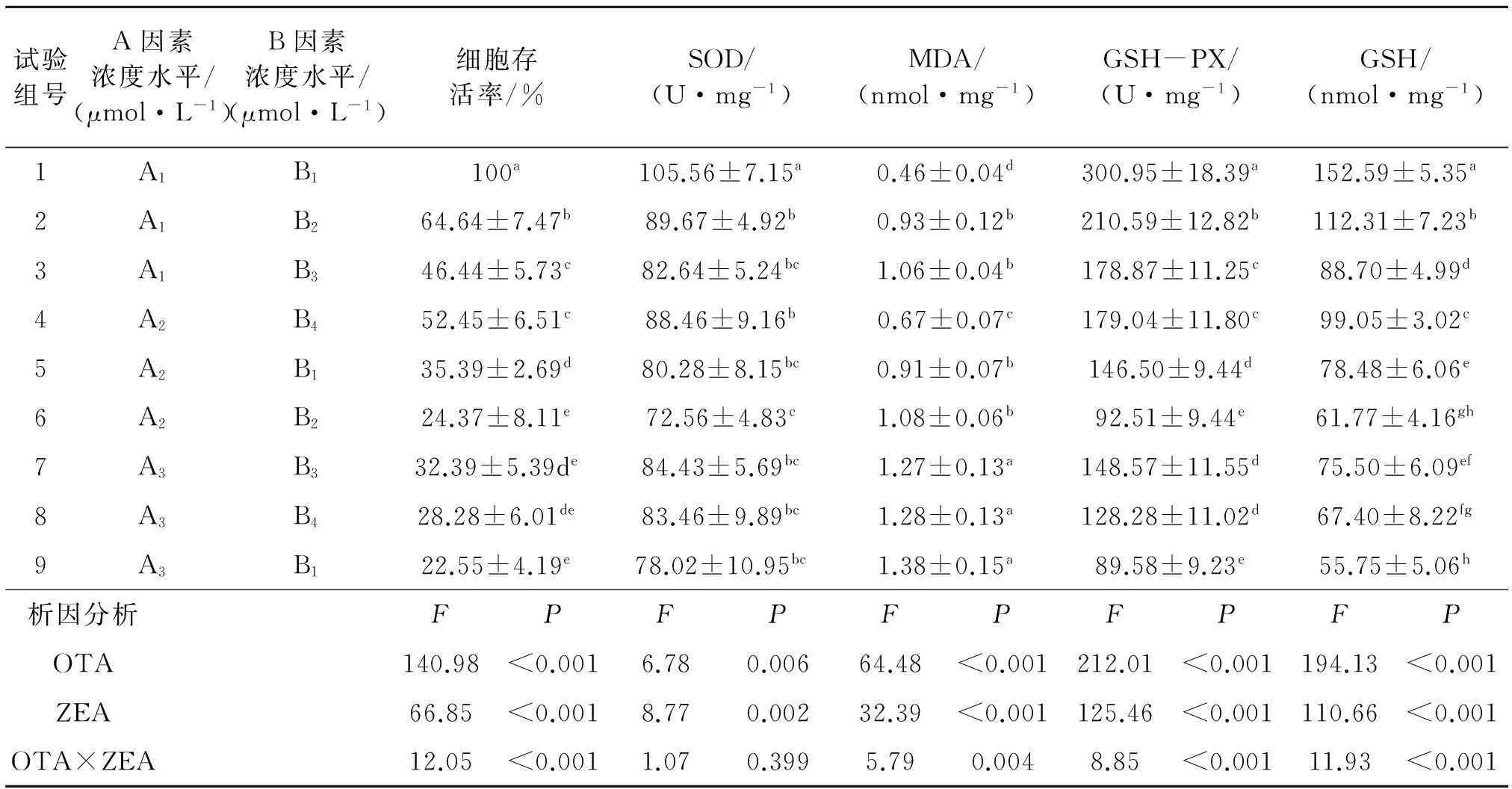
表1 OTA和ZEA对Hep G2细胞活力和氧化损伤的联合作用
a,b,c同列具有不同字母肩注者差异显著(P<0.05)。
α-ZOL单一作用时(试验组1、2和3:α-ZOL的浓度分别为0、15、30 μmol/L),随着作用浓度的升高,细胞活力逐渐降低,MDA含量逐渐升高,GSH-PX活性逐渐降低,GSH含量逐渐降低,且试验组1、2和3的细胞活力,MDA含量,GSH-PX活性和GSH含量,组间差异均显著(P<0.05).说明α-ZOL的细胞毒性呈剂量依赖,MDA含量,GSH-PX活性和GSH含量的变化也呈剂量依赖(表1).
从表1析因结果可见,两种毒素联合作用时,细胞毒性和氧化损伤(SOD,MDA,GSH-PX和GSH)表现出明显的交互作用.
从表1可见,与OTA单一作用(试验组4:OTA为6 μmol/L)相比,OTA和α-ZOL共同作用时(试验组5:OTA为12 μmol/L,α-ZOL为15 μmol/L和试验组6:OTA为12 μmol/L,α-ZOL为30 μmol/L),随着毒素浓度升高,SOD活力(试验组5)没有显著性降低.与OTA单一作用(试验组7:OTA为12 μmol/L)相比,OTA和α-ZOL共同作用时(试验组8:OTA为12 μmol/L,α-ZOL为15 μmol/L和试验组9:OTA为12 μmol/L,α-ZOL为30 μmol/L),细胞活力(试验组8和试验组9)没有显著性降低,SOD活力(试验组8和9)没有显著性降低,MDA含量(试验组8)没有显著性升高,GSH-PX活力和GSH含量(试验组8)没有显著性降低.与α-ZOL单一作用(试验组2:α-ZOL为15 μmol/L)相比,OTA和α-ZOL共同作用时(试验组5:OTA为6 μmol/L,α-ZOL为15 μmol/L和试验组8:OTA为12 μmol/L,α-ZOL为15 μmol/L),SOD活力(试验组5和试验组8)没有显著性降低,MDA含量(试验组5)没有显著性升高.与α-ZOL单一作用(试验组3:α-ZOL为30 μmol/L)相比,OTA和α-ZOL共同作用时(试验组6:OTA为6 μmol/L,α-ZOL为30 μmol/L和试验组9:OTA为12 μmol/L,α-ZOL为30 μmol/L),SOD活力(试验组6和试验组9)没有显著性降低,MDA含量(试验组6)没有显著性升高.
上述结果说明,两种毒素联合作用时,细胞毒性和氧化损伤(SOD,MDA,GSH-PX和GSH)可能表现为拮抗效应.
2.2 OTA和α-ZOL联合作用的交互效应
从图1可见,OTA和α-ZOL联合作用时,在OTA的浓度在6 μmol/L时,随着α-ZOL浓度的升高(点B,E和H),与对照组(曲线AB)相比,细胞活力(曲线DE和GH)下降的趋势变慢.在OTA的浓度固定在12 μmol/L时,随着α-ZOL浓度的升高(点C,F和I),与对照组(曲线BC)相比,细胞活力(曲线EF和HI)下降的趋势变慢.由表2可见,与对照组(曲线AB的斜率)相比,曲线DE和GH的斜率显著性升高(曲线下降的趋势显著减缓)(P<0.05),从而说明在OTA的浓度为6 μmol/L时,随着α-ZOL浓度的升高,细胞毒性交互作用为拮抗效应;与对照组(曲线BC的斜率)相比,曲线EF和HI的斜率显著性升高(曲线下降的趋势显著减缓)(P<0.05),从而说明在OTA的浓度为12 μmol/L时,随着α-ZOL浓度的升高,细胞毒性交互作用为拮抗效应。
同理,在OTA的浓度为6 μmol/L和12 μmol/L时,随着α-ZOL浓度的升高,毒素对SOD活性影响的交互作用为拮抗效应(图2和表2);在OTA的浓度为6 μmol/L和12 μmol/L时,随着α-ZOL浓度的升高,毒素对GSH-PX活性影响的交互作用为拮抗效应(图4和表2);在OTA的浓度为6 μmol/L 和12 μmol/L时,随着α-ZOL浓度的升高,毒素对GHS含量影响的交互作用为拮抗效应(图5和表2).
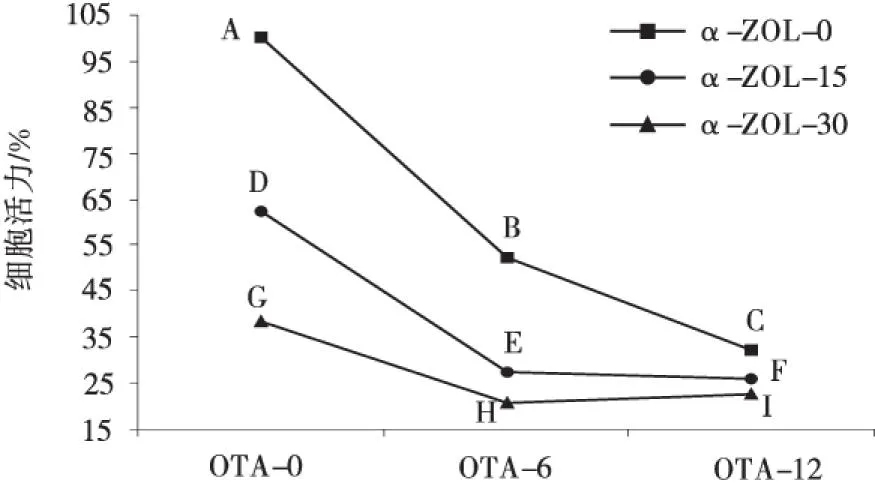
图1 OTA和ZEA联合作用时细胞毒性的边际均数轮廓Fig.1 The estimated marginal means of the combined cytotoxicity
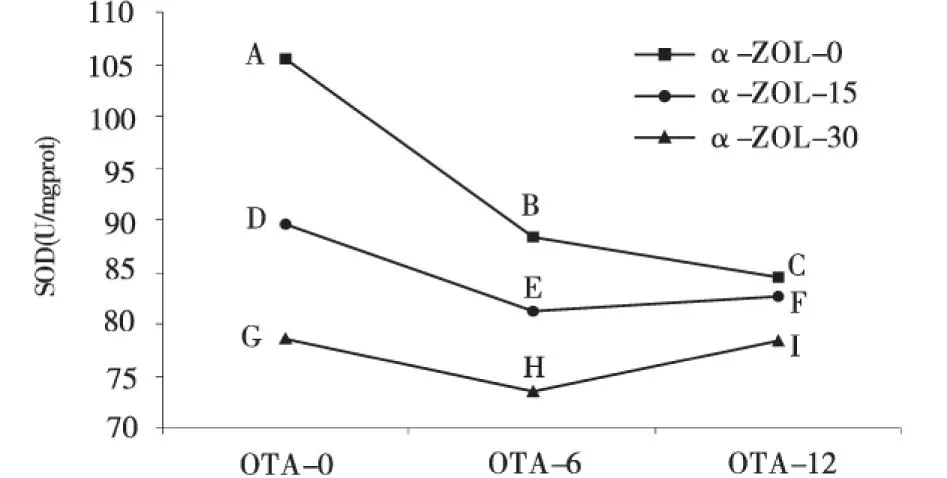
图2 OTA和ZEA联合作用时SOD活性的边际均数轮廓Fig.2 The estimated marginal means of the activities of intracellular SOD
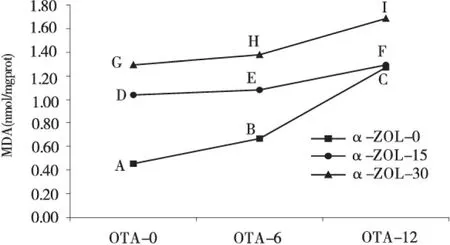
图3 OTA和ZEA联合作用时MDA含量的边际均数轮廓Fig.3 The estimated marginal means of the content of intracellular MDA
由图3和表2可见,与对照组(曲线AB的斜率)相比,曲线DE和GH的斜率显著性降低(曲线上升的趋势显著减缓)(P<0.05),从而说明在OTA的浓度为6 μmol/L时,随着α-ZOL浓度的升高,毒素对MDA含量影响的交互作用为拮抗效应;与对照组(曲线BC的斜率)相比,曲线EF和HI的斜率显著性降低(曲线上升的趋势显著减缓)(P<0.05),从而说明在OTA的浓度为12 μmol/L时,随着α-ZOL浓度的升高,毒素对MDA含量影响的交互作用为拮抗效应.
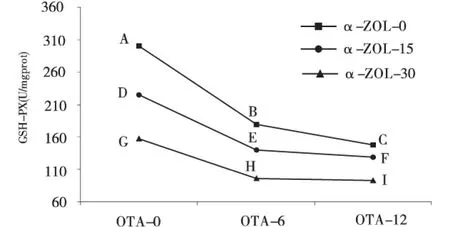
图4 OTA和ZEA联合作用时GSH-PX活性的边际均数轮廓Fig.4 The estimated marginal means of the activities of intracellular GSH-PX
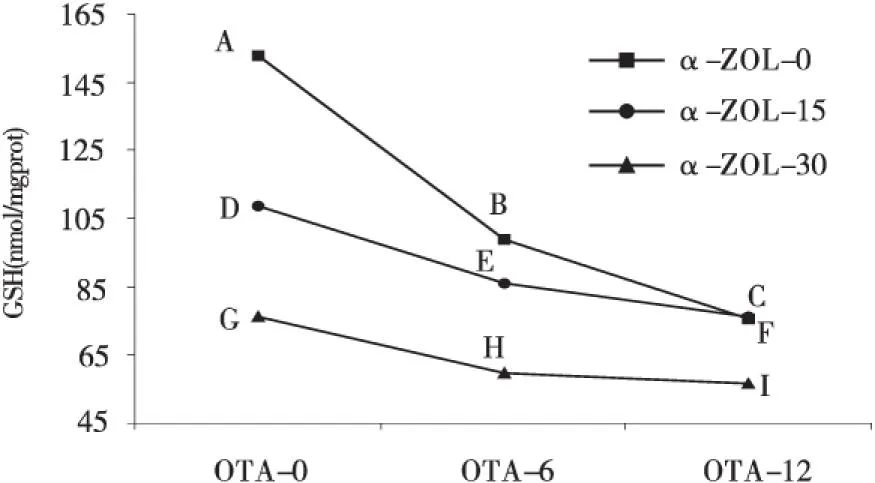
图5 OTA和ZEA联合作用时GSH含量的边际均数轮廓Fig.5 The estimated marginal means of the content of intracellular GSH

a,b,c同列具有不同字母肩注者差异显著(P<0.05).
2.3 细胞毒性和氧化损伤的相关性分析
由表3可见,细胞毒性与细胞内SOD活性成显著性正相关,与细胞内MDA含量呈显著性负相关,与细胞内GSH-PX活力呈显著性正相关,与细胞内GSH含量呈显著性正相关.
3讨论
3.1 OTA和α-ZOL单一及联合作用对Hep G2细胞增殖及氧化损伤的影响
动物机体受到外源毒素的攻击时,体内的自由基增多,致使细胞受损或死亡.本试验中OTA和α-ZOL单一作用及联合作用都显著降低了Hep G2细胞活力,且呈剂量依赖.本文的研究结果与Fusi等[15]和Tatay等[10]对OTA和α-ZOL的研究结果一致.
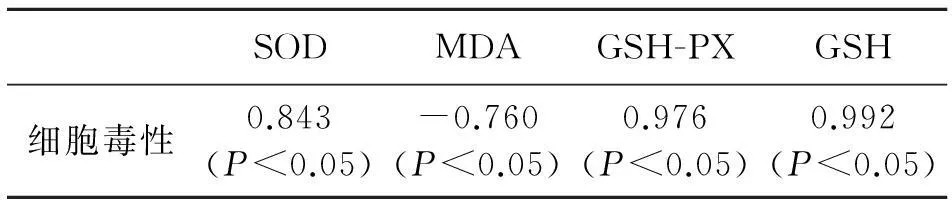
表3 细胞毒性与SOD活性,MDA含量,GSH-PX活性和
细胞内有一套完整的抗氧化系统,使得机体内自由基的产生和消除保持着一种动态平衡,其中SOD和GSH-Px是细胞内的主要抗氧化酶,其活力高低反映了机体清除自由基的能力.而MDA是自由基对不饱和脂肪酸引发脂质过氧化作用后的终产物.GSH是巯基酶的底物,是巯基化合物中最重要的非酶性抗氧化物.GSH和MDA含量可以反映机体脂质过氧化的程度,间接反映细胞的受损程度[16].本试验OTA和α-ZOL单一作用及联合作用都显著降低了细胞内SOD和GSH-Px活性以及GSH含量,且升高了细胞内中MDA含量.从而说明单一毒素及毒素组合都能促进细胞内脂质过氧化且能降低细胞清除自由基的能力.王亚超等[17]和朱丽等[18]对脱氧雪腐镰刀菌烯醇(DON)和玉米赤霉烯酮(ZEA)的研究结果表明,DON与ZEA单一作用及共同作用,均能显著降低细胞内GSH-Px活性和GSH含量.韩巍等[8]和Abid-Essefi等[19]对OTA与ZEA的研究结果表明,单一毒素及毒素组合,均能显著降低细胞内SOD活性和提高MDA含量.
3.2 OTA和α-ZOL联合作用的交互效应
大量研究结果表明,如果2种化合物具有相似的结构,那么它们竞争细胞膜上同一靶位点,从而导致细胞毒性的交互作用表现为拮抗效应.Kouadio等[20]研究结果表明镰刀菌属霉菌毒素ZEA(玉米赤霉烯酮)和FB1(伏马菌素)联合作用时细胞毒性表现为拮抗效应.Ruiz等[21]的研究表明镰刀菌属霉菌毒素BEA(白僵菌素),DON(脱氧雪腐镰刀菌烯醇)和T-2毒素间细胞毒性也表现为拮抗效应.OTA和α-ZOL也属于镰刀菌属霉菌毒素,本试验中OTA和α-ZOL联合作用对细胞毒性的交互作用为拮抗效应,对SOD和GSH-PX活性,MDA和GSH含量的交互作用也表现为拮抗效应,与Kouadio等[20]和Ruiz等[21]的研究结果保持一致,共同证明了毒素结构可以影响毒素间细胞毒性的交互作用.
3.3 细胞毒性和氧化损伤的相关性分析
当细胞受到毒素刺激时,生物膜上的不饱和脂肪酸极易受到攻击而引起生物膜的脂质过氧化损伤.从而引起细胞膜结构破坏和细胞内容物外溢,并最终导致细胞死亡[20].大量研究结果表明,氧化损伤是毒素诱发细胞损伤或死亡的主要途径之一.本试验中细胞毒性与细胞内SOD和GSH-PX活性,以及GSH含量呈显著性正相关,与细胞内MDA含量呈显著负相关.这说明了细胞毒性与氧化损伤间存在着显著性相关.Behm等[22]和Abid-Essefi等[19]的研究表明,OTA和α-ZOL能够引起脂质过氧化从而改变细胞膜的形状,进而引起细胞死亡.本试验的结果和他们的结果共同验证了氧化损伤与细胞毒性存在显著性相关,证明了氧化损伤是毒素诱发细胞毒性的主要途径之一.
4结论
本试验结果说明OTA和α-ZOL联合作用时,细胞毒性、SOD活性、MDA含量、GSH-PX活性和GSH含量的交互作用一致,均表现为拮抗效应;且细胞毒性的变化与SOD活性、MDA含量、GSH-PX活性和GSH含量的变化表现为显著性相关,说明氧化损伤是毒素诱发细胞毒性的主要途径之一.
参考文献
[1]IARC.Some naturally occurring substances:Food items and constituents,heterocyclic aromatic amines and mycotoxins Aflatoxins[J].WHO IARC Monographs on the Evaluation of Carcinogenic Risks to Humans,1993,56:245 395
[2]IARC.Some naturally occurring substances:Food items and constituents,heterocyclic aromatic amines and mycotoxins Ochratoxin A[C].WHO IARC Monographs on the Evaluation of Carcinogenic Risks to Humans,1993,56:489-521
[3]EFSA.Opinion of the scientific panel on contaminants in the Food Chain on a request from the commission related to Ochratoxin A in food[J].EFSA J,2006,365:1-56
[4]Hassen W,Ayed-Boussema I,Oscoz A A,et al.The role of oxidative stress in zearalenone-mediated toxicity in Hep G2 cells:Oxidative DNA damage,gluthatione depletion and stress proteins induction[J].Toxicology,2007,232:294-302
[5]Minervini F,Fornelli F,Lucivero G,et al.T-2 toxin immunotoxicity on human B and T lymphoid cell lines[J].Toxicology 2005,210:81-91
[6]Rodrigues I,Naehrer K.Biomin Survey 2010:Mycotoxins inseparable fromanimal commodities and feed[J].Raw Materials,2011,2:17-20
[7]陈心仪.2009-2010年中国部分省市饲料原料及配合饲料的霉菌毒索污染概况[J].浙江畜牧兽医,2011(2):7-9
[8]Huang L C,Zheng N,Zheng B Q,et al.Simultaneous determination of aflatoxin M1,ochratoxin A,zearalenone and α-zearalenol in milk by UHPLC-MS/MS[J].Food Chemistry,2014,146:242-249
[9]韩巍.几种霉菌毒素对BHK细胞毒害影响及作用机理的研究[D].合肥:安徽大学,2010
[10]Tatay E,Meca G,Font G,et al.Interactive effects of zearalenone and its metabolites on cytotoxicity and metabolization in ovarian CHO-K1 cells[J].Toxicology in Vitro,2013,28:95-103
[11]朱银荣,张继,王军龙,等.沙蒿多糖及其衍生物的体外降血糖作用[J].甘肃农业大学学报,2011,46(1):140-143
[12]Liu J,Zhang W,Jing H,et al.Bog bilberry(Vacciniumuliginosum) extract reduces cultured Hep-G2,Caco-2,and 3T3-L1 cell viability,affects cell cycle progression,and has variable effects on membrane Permeability[J].Journal of Food Science,2010,75:103-107
[13]顾兵,王心如.联合作用特征的评价[J].中国工业医学杂志,2000,13(1):55-58
[14]张蕾,徐镜波,杨丽,等.析因试验设计在环境污染物联合毒性研究中的应用[J].干旱环境监测,2004,18(1):20-22
[15]Fusi E,Rebucci R,Pecorini C,et al.Alpha-tocopherol counteracts the cytotoxicity induced by ochratoxin a in primary porcine fibroblasts[J].Toxins,2010,2:1265-1278
[16]Sies H,Akerboom T P.Glutathione disulfide(GSSG)efflux from cells and tissues[J].Method Enzymol,1984,105:445 -451
[17]王亚超.霉菌毒素DON、ZEA及其联合染毒对体外培养鸡脾脏淋巴细胞凋亡的分子机制研究[D].雅安:四川农业大学,2012
[18]朱丽.玉米赤霉烯酮对体外培养猪卵巢颗粒细胞的毒性作用及凋亡机理研究[D].长沙:湖南农业大学,2011
[19]Abid-Essefi S,Bouaziz,E E,Ouanes Z,et al.Comparative study of toxic effects of zearalenone and its two major metabolites α-zearalenol and β-zearalenol on cultured human Caco-2 cells,Journal of biochem molecular Toxicology[J].2009,23:233-243
[20]Kouadio J H,Dano S D,Moukha S,et al.Effects of combinations of Fusarium mycotoxins on the inhibition of macromolecular synthesis,malondialdehyde levels,DNA methylation and fragmentation,and viability in Caco-2 cells[J].Toxicon,2007,49:306-317
[21]Ruiz M J,Mac kov P,Juan-Garca A,et al.Cytotoxic effects of mycotoxin combinations in mammalian kidney cells[J].Food and Chemical Toxicology,2011,49:2718-2724
[22]Behm C,F llmann W,Degen G H,et al.Cytotoxic potency of mycotoxins in cultures of V79 lung fibroblast cells[J].Journal of Toxicology and Environmental Health,2012,75:1226-1231
(责任编辑胡文忠)
Effects of ochratoxin A and α-zearalenol on proliferation and oxidative damage of Hep G2
WANG Hai-wei1,2,ZHENG Nan2,LI Song-li2,LI Fa-di1,WANG Jia-qi1,2
(1.College of Animal Science and Technology,Gansu Agricultural University,Lanzhou 730070,China;
2.Institute of Animal Science,Chinese Academy of Agricultural Sciences,Beijing 100193,China)
Abstract:The objectives of this study were to investigate the combined effects of ochratoxin A (OTA) and α-zearalenol (α-ZOL) on Hep G2 cells,and to explore the cytotoxicity mechanism.3×3 factorial analysis design was applied in this trial.Nine groups were adopted to investigate the combined cytotoxicity of three levels of OTA (0μmol/L,6μmol/L and 12μmol/L) and three levels of α-ZOL (0μmol/L,15μmol/L and 30μmol/L) after 48 h of exposure.The cytotoxicity of two combined mycotoxins was evaluated by using the estimated marginal means.The results demonstrated the cytotoxicity of two combined mycotoxins indicated an antagonism.And the activities of intracellular SOD and GSH-PX,the content of intracellular MDA and GSH indicated an antagonism.There was a significant correlation between the cytotoxicity and the activities of intracellular SOD and GSH-PX (P<0.05),and there was a significant correlation between the cytotoxicity and the content of intracellular MDA and GSH (P<0.05).The results suggest that the combined cytotoxicity show an antagonism,and oxidative damage is one of the pathway of the cytotoxicity.
Key words:ochratoxin A;α-zearalenol;oxidative damage;factorial analysis;marginal means
收稿日期:2014-04-27;修回日期:2014-05-27
基金项目:公益性行业(农业)科研专项项目“生鲜乳质量安全评价技术与生产规程”(201403071),现代农业产业技术体系专项资金(nycytx-04-01),中国农业科学院科技创新工程(ASTIP-IAS12).
通信作者:王加启,男,研究员,博士生导师,主要从事乳品质量安全风险评估.E-mail:wang-jia-qi@263.net
中图分类号:TS 207
文献标志码:A
文章编号:1003-4315(2015)04-0005-07
