姜黄素下调结直肠癌细胞Notch1信号通路研究
2015-02-16刘少琼李春花谢婉莹
杨 芳,刘少琼*,李春花,尹 玲,刘 娅,谢婉莹
(南华大学附属第一医院,湖南 衡阳 421001)
姜黄素下调结直肠癌细胞Notch1信号通路研究
杨 芳,刘少琼*,李春花,尹 玲,刘 娅,谢婉莹
(南华大学附属第一医院,湖南 衡阳 421001)
目的检测Notch1信号通路中Notch intracellular domain蛋白(NICD1蛋白)在大肠腺癌组织中表达的情况;探讨姜黄素对人结肠癌细胞SW480及HT29细胞中Notch1信号通路的影响。方法二步法免疫组化检测40例结直肠癌、31例癌旁肠组织石蜡切片中Notch1 intracellular domain蛋白(NICD1)的表达情况,通过对比人结肠直肠癌与癌旁正常肠黏膜细胞中蛋白阳性表达率判断NICD1蛋白与人结直肠癌的关系;不同浓度姜黄素(0、7.5、15、30、60μmol/L)分别处理结肠腺癌细胞SW480和HT29细胞24 h和48 h后,Western blot法检测细胞内NICD1、Notch1及HES-1蛋白的表达情况。结果NICD1在人结直肠癌组织中均表达,阳性率100%,癌旁肠组织中部分表达,阳性率为90.3%,但癌组织表达强度明显高于癌旁组织,差异有统计学意义 (P<0.05);Western blot结果示姜黄素能下调人结肠腺癌细胞SW480及HT29细胞中NICD1、Notch1及HES-1蛋白的表达,有时间和剂量依赖。结论Notch1信号通路中NICD1蛋白在结直肠癌组织中的过度表达可能与肿瘤的发生发展相关,其阳性表达的部位可能与癌组织的病理分期有关;姜黄素可能通过调控Notch1信号通路抑制结直肠癌细胞增殖。
姜黄素;Notch1通路;NICD;结直肠癌;结肠癌细胞SW480;结肠癌细胞HT29
结直肠癌是常见恶性肿瘤之一,男性和女性患者发病率分别位居第三位和第二位[1],亚洲地区结直肠癌发生率和死亡率近几十年快速增长,亚洲东部国家如中国、日本、韩国和新加坡,发生率以2倍到4倍速度增长,死亡率增长了35%[2]。结直肠癌传统治疗方法有外科手术、放化疗等[3]。经规范联合化疗,可使结直肠癌病人5年生存率达42.7%[4],但放化疗给结直肠癌患者带来明显的毒副作用严重影响患者的生活质量,因此寻找高效、低毒抗肿瘤药物任重道远。
姜黄素是从中药姜黄根茎中提取的活性成分,相对分子量为368.4,近几年的研究显示姜黄素对多种肿瘤有抑制作用,包括乳腺癌、肺癌、前列腺癌、结直肠癌等[5],还具备抗炎、抗氧化、防衰老等作用,除了功效多外,其毒副作用小、耐受性好,是极具潜力的抗癌药物;此外,它还可以提高直肠癌患者对放疗的敏感性,增加放射疗法的治疗效果,而且还可减轻化疗药物带来的毒副作用,如皮肤损伤、肠道反应等[6]。
在哺乳动物中,Notch信号主要由配体(Dll1、Dll3、Dll4、Jagged1、Jagged2),受体(Notch 1-4)和相关靶基因:HES和HERP等构成。Notch信号激活由临近细胞配-受体结合后,受体蛋白水解,释放胞浆内活性结构域 (Notch intracellular domain,NICD),NICD易位至细胞核,与核内转录因子CSL(人类CBF1/RBPjk、果蝇SU(H)、线虫Lag-1)结合,替换出转录抑制因子,募集转录激活因子,诱导Notch信号靶基因表达和转录[7]。Notch1信号通路在多种肿瘤组织中检测出表达,包括乳腺癌、肾癌、食管癌、前列腺癌及结直肠癌等,并且Notch1信号与这些肿瘤对化疗药物耐药及肿瘤向周围侵袭转移相关[8]。本研究通过免疫组化等方法检测人结直肠癌组织中NICD1蛋白的表达及结肠腺癌细胞中 NICD1、Notch1及HES-1蛋白表达,探讨姜黄素抑制结肠癌细胞增殖的分子机制。
1 材料与方法
1.1 材料和试剂
1.1.1 病理切片 切片组织筛选来自源于南华大学附属第一医院病理科2010年至2012年所有大肠癌根治术患者,标本选取肿瘤组织蜡块及癌旁组织蜡块,对照组、正常组来源于癌组织切缘,距肿瘤组织>5 cm的切缘组织。其中直肠癌19例,结肠癌21例,肿瘤组织中高分化11例,中分化25例,低分化4例,男性患者29名,女性患者11名,平均年龄60岁,所有患者均无术前放化疗及其他治疗史,所有病例均经术后病理诊断明确。
1.1.2 细胞系、试剂及仪器 结肠腺癌细胞SW480购于湘雅细胞管理中心,结肠腺癌细胞HT29细胞购于中科院上海细胞库。无噬菌体胎牛血清购自杭州四季青生物工程材料有限公司,RPMI1640培养基购自美国Hyclone公司,MCCOY'S 5A培养基购自sigma公司。姜黄素粉末(HPLC≥98.5%)购于成都瑞芬思生物科技有限公司。兔/鼠DAB辣根过氧化物酶显色试剂盒购于上海诺伦生物公司。兔抗人(Anti-NICD1 antibody,ab83232)购于英国Abcam公司,鼠抗人Anti-human Notch1 Purified(货号:14-5785)购于affymetrix公司,Anti-HES-1抗体购于GeneTex公司。二抗山羊抗兔购于武汉博士德生物工程有限公司,兔抗鼠购于美国CST公司。蛋白裂解液、蛋白定量液、上样缓冲液、SDS制胶试剂盒、蛋白Marker、显影液均购于上海碧云天技术有限公司,SDS制胶电泳仪及转膜槽产于北京六一公司,PVDF膜购自millipore公司。
1.2 方法
1.2.1 二步法免疫组化检测人结直肠癌组织及癌旁组织蜡块NICD1蛋白表达情况 标本处理:病理切片常规脱蜡、水化,蒸馏水洗5 min,PBS漂洗3次,高压抗原修复2 min后自然冷却至37℃以下,PBS漂洗3次,3%H2O2封闭10 min,PBS漂洗 3次,除去PBS液,滴加1滴兔抗人NICD1单克隆抗体(稀释浓度1∶1200),4℃孵育过夜;次日PBS漂洗3次,滴加聚合物增强剂 (试剂A),37℃孵育20 min,PBS漂洗3次;滴加酶标抗鼠/兔聚合物(试剂B),室温下孵育30 min,PBS漂洗3次;滴加即用型Maxvision TM试剂,室温下孵育10 min,PBS漂洗3次。滴加现配DAB显色剂溶液,显微镜下观察5 min;冲洗后苏木精复染、中性树胶封片。每次PBS漂洗4 min。
1.2.2 组织切片HE染色法 免疫组化相同石蜡标本切片,常规苏木精-伊红染色作组织学诊断。病理切片,常规脱蜡、水化,蒸馏水洗5 min,苏木精染色液染色10 min;漂洗后1%盐酸乙醇3 s;漂洗后0.5%伊红液染色;梯度酒精漂洗后中性树胶封固。
由2位有经验的病理科医师读片,结果判定标准:NICD1蛋白主要表达在细胞质与细胞核。用阳性细胞数量和着色程度两项加权法,阳性细胞数<5%为0分,5%~25%为1分,25%~50%为2分,50% ~75%为3分,>75%为4分;着色程度淡黄色为1分,棕黄色为2分,棕褐色为3分;两者相加,总分1~2分计为“-”,3分计为“+”,4分计为“++”,≥5分为“+++”。
1.2.3 细胞培养及蛋白免疫印迹 (1)细胞培养及药物配制 含10%胎牛血清的RPMI1640培养基培养,加1%青-链霉素双抗,于5%CO2,37℃孵育箱中常规培养结肠腺癌细胞SW 480,同样条件,用含10%胎牛血清的MCCOY’S 5A培养基培养常规培养结肠腺癌HT29细胞,1~2 d换液1次;待其贴壁生长融合至80%左右时,使用0.25%胰酶消化传代。姜黄素粉末溶于二甲基亚砜(DMSO),母液浓度为1 mol/mL,经0.22μm无菌过滤器过滤后4℃冰箱避光保存,使用时用培养基稀释成工作液,并使工作液中DMSO最终浓度<0.01%。(2)蛋白免疫印迹取对数生长期细胞,消化后用含10%胎牛血清的培养基配成单个细胞悬液,均匀接种到6孔板,待其贴壁后加入含姜黄素培养基,浓度分别为0、7.5、15、30、60μmol/L继续培养24 h和48 h,经消化、离心、洗涤收集细胞后加入含PMSF裂解液冰上裂解30 min;裂解后12 000 r/min离心10 min收集上清液,蛋白定量后加蒸馏水稀释配平,使每组总蛋白量均等。加入SDS上样缓冲液混匀后99℃煮沸5 min变性。
按照制胶试剂盒说明步骤配制分离胶和浓缩胶,根据蛋白分子量选择10%分离胶,取25μL蛋白上样,恒压电泳,浓缩胶电泳80 v,30 min;分离胶电泳120 v,90 min,电泳后转膜,大分子使用0.45μm PVDF膜、小分子使用0.22μm PVDF膜进行湿转,转膜条件:4℃冰浴中恒流200 mA,90 min。转膜完成后5%脱脂牛奶封闭2 h后37℃一抗孵育1 h、4℃过夜。次日TBST漂洗滤膜3次,每次10 min,加入二抗37℃摇床孵育1 h,TBST漂洗滤膜3次,每次10 min,采用化学免疫发光法对膜进行显影,一抗稀释比例:NICD1(1∶1000),内参(1∶500),Notch1(1∶500),HES-1(1∶800);二抗山羊抗兔:1∶3000,兔抗鼠:1∶2000。内参β-actin、NICD1、Notch1、HES-1蛋白分子量分别为 43、88、110、30 kDa。
1.3 统计学分析
采用SPSS 18.0软件进行分析,免疫组化采用Wilcoxon符号秩和检验进行统计分析,蛋白免疫印迹图片使用Image J软件扫描,所得目的蛋白灰度比值=目的条带灰度值/内参灰度值,采用ONEANOVA双因素检验;P<0.05表示有统计学意义。
2 结果
2.1 Notch1信号通路中NICD1蛋白在人结直肠腺癌及癌旁肠组织中的表达
免疫组化结果显示,NICD1的阳性颗粒主要分布于细胞质与细胞核,表达情况见表1、封三彩图图1,P=0.000<0.05,可认为癌组织中NICD1表达强于癌旁组织,相同组织HE染色见封三彩图图2。
2.2 蛋白免疫印迹法检测蛋白
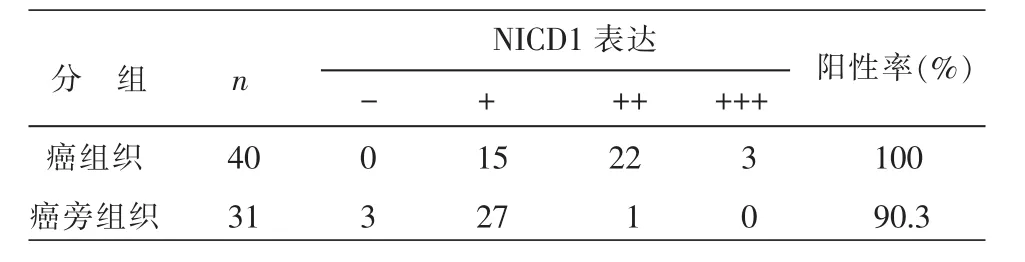
表1结直肠腺癌与癌旁组织中NICD1的蛋白表达
结肠腺癌细胞HT29和结肠癌SW480细胞分别用不同浓度姜黄素 (0、7.5、15、30、60μmol/L)处理24 h和48 h后,Notch1通路中受体蛋白Notch1,通路中活性蛋白NICD1,下游靶蛋白HES-1的表达情况:Notch1、NICD1、HES-1、β-actin蛋白免疫印迹结果见图3、图4,姜黄素降低了结肠腺癌细胞HT29和SW480细胞中Notch1、NICD1、HES-1蛋白的表达,有浓度和时间依赖;姜黄素处理组(60μmol/L)与对照组 (0μmol/L)相比,Notch1、NICD1、HES-1蛋白表达差异有统计学意义 (P<0.0001<0.01);姜黄素处理HT29细胞24 h和48 h,相同浓度处理不同时间,Notch1蛋白表达差异无统计学意义(P=0.296 0>0.01),而NICD1和HES-1蛋白表达有差异(P<0.000 1<0.01),见图5;姜黄素处理SW480细胞HT29细胞24 h和48 h,相同浓度处理不同时间,Notch1、NICD1、HES-1 3种蛋白表达均有意义(P<0.000 1<0.01),见图6;相同浓度姜黄素处理结肠腺癌HT29与SW480相同时间,蛋白表达差异有统计学意义(P<0.01)。

图3 结肠腺癌HT29细胞经姜黄素处理24 h(A)和48 h(B)蛋白表达
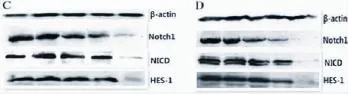
图4 结肠腺癌SW480细胞经姜黄素处理24 h(C)和48 h(D)蛋白表达
3 讨论
结直肠癌是常见恶性肿瘤之一,其发生发展是由遗传和生理改变多种因素作用共同而成,其主要分子机制尚未明确。Notch信号通路与肿瘤的相关性最先在1991年T细胞型急性淋巴细胞白血病中确定,认为Notch信号通路失调控诱发肿瘤,属于致癌信号通路[9]。然而,随着研究的深入,人们对Notch信号的认识逐渐加深,Notch信号通路在肿瘤组织中异常活性具有两面性,致癌作用或抑癌作用,这主要取决于组织或细胞类别的不同[10],包括曾经认为Notch信号通路是致癌作用的T细胞型急性淋巴细胞白血病、慢性B淋巴细胞性白血病等,被证实其起抑癌作用[11]。Notch信号通路激活由临近细胞配-受体结合后,Notch受体蛋白裂解,释放胞内活性结构域 (Notch-ICD,NICD),NICD由胞浆转移至细胞核,与核内DNA结合转录因子RBP-J、MAML结合成RBP-J/NICD/MAML激活复合体,作为启动子诱导靶基因转录,当NICD在核内大量磷酸化和泛素化后,其转录激活的功能停止,这意味着Notch信号终止[12]。Notch1信号通路是Notch信号通路之一,它能在结直肠肿瘤组织中高表达并在结直肠癌发展过程中起致癌作用,不仅如此,Notch1在组织中高表达与病人总生存期短以及病人预后差有关,因此Notch1基因表达可作为判断预后和治疗结直肠癌的潜力生物标记[13]。Hristova NR等[14]认为p27及skp2在Notch1信号通路中起重要作用,并且Notch1是结直肠腺癌治疗靶点。
姜黄素是中药姜黄中提取的活性成分,已有研究者对姜黄素进行了Ⅰ/Ⅱ期临床研究,结果示姜黄素结合其他化疗药物使用,能减轻化疗药物的毒副作用,减少化疗药物的使用剂量,提高患者的生存质量、延长生存时间;且姜黄素无明显副作用,患者耐受性好,可作为结直肠癌长期预防治疗方案[15]。
以往的研究表明Notch1蛋白能在结直肠癌组织中过度表达[16],而NICD1的表达尚未报道,本实验免疫组化结果示NICD1能在结直肠腺癌组织中表达,并且表达强度显著高于癌旁组织,进一步证实了Notch1信号通路在结直肠腺癌中起致癌效应。
已有研究表明姜黄素能抑制结肠腺癌细胞HT29和SW480细胞大的增殖并促进其凋亡[17-18],本实验中应用不同浓度姜黄素处理以上2种细胞,使用免疫蛋白印迹方法检测 Notch1信号通路中NICD1、Notch1及下游靶基因HES-1蛋白表达情况,结果示三种蛋白表达均降低,有时间和剂量依赖,同样本研究前期工作检测到姜黄素能降低与Notch1信号相关的skp2蛋白表达,增加p27蛋白表达[19],因此,姜黄素通过下调Notch1信号通路相关蛋白表达可能是其抑制结直肠癌细胞增殖并促进凋亡的分子机制;从数据来看,姜黄素对结肠腺癌细胞SW 480细胞和HT29细胞中各蛋白的抑制程度有差异,考虑与细胞表达的Notch1信号强弱不等以及细胞对姜黄素的敏感性差异相关,这也是本课题进一步研究的方向。

图5 结肠癌细胞HT29经姜黄素处理后HES1、NICD1、HES1蛋白表达相对值比较
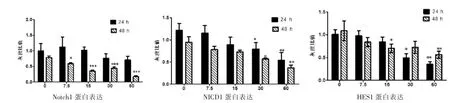
图6 结肠癌细胞SW480细胞经姜黄素处理后Notch1、NICD1、HES1蛋白表达相对值比较
[1]Magaji BA,Moy FM,Roslani AC,et al.Descriptive epidemiology of colorectal cancer in university malaya medical centre,2001 to 2010[J].Asian Pac J Cancer Prev,2014,15(15):6 059-6 064.
[2]Pourhoseingholi MA.Increased burden of colorectal cancer in Asia [J].World JGastrointest Oncol,2012,4(4):68-70.
[3]万 平.结直肠癌中TP酶活性与XELOX新辅助化疗疗效的关系[D].南昌大学医学院,2013.
[4]张 锌,孙步彤,卢振霞.二氢嘧啶脱氢酶基因单核苷酸多态性与结直肠癌患者5-FU化疗毒副作用的关系[J].吉林大学学报(医学版),2011(4):707-711.
[5]Li Y,Zhang S,Geng JX,et al.Curcumin inhibits human nonsmall cell lung cancer A549 cell proliferation through regulation of Bcl-2/Bax and cytochrome C[J].Asian Pac J Cancer Prev,2013,14(8):4 599-4 602.
[6]Ryan JL,Heckler CE,Ling M, et al.Curcumin for radiation dermatitis:a randomized,double-blind,placebo-controlled clinical trial of thirty breast cancer patients[J].Radiat Res,2013,180(1):34-43.
[7]Grego-Bessa J,Díez J,Timmerman L,et al.Notch and epitheli -mesenchyme transition in development and tumor progression:another turn of the screw[J].Cell Cycle,2004,3(6):718-721.
[8]Ai Q,Ma X,Huang Q,et al.High-level expression of Notch1 increased the risk of metastasis in T1 stage clear cell renal cell carcinoma[J].PLoS One,2012,7(4):e35022.
[9]Ellisen LW,Bird J,West DC,et al.TAN-1,the human homolog of the Drosophila notch gene,is broken by chromosomal translocations in T lymphoblastic neoplasms[J].Cell,1991,66(4):649-661.
[10]Lobry C,Oh P,Aifantis I.Oncogenic and tumor suppressor functions of Notch in cancer:it's NOTCH what you think[J].J Exp Med,2011,208(10):1 931-1 935.
[11]Lobry C,Oh P,Mansour MR,et al.Notch signaling:switching an oncogene to a tumor suppressor [J].Blood,2014,123 (16):2 451-2 459.
[12]Borggrefe T,Liefke R.Fine-tuning of the intracellular canonical Notch signaling pathway[J].Cell Cycle,2012,11(2):264-276.
[13]Huang R,Tang Q,You Q, et al.Disparity expression of Notch1 in benign and malignant colorectal diseases[J].PLoS One,2013,8(12):e81005.
[14]Hristova NR,Tagscherer KE,Fassl A,et al.Notch1-dependent regulation of p27 determines cell fate in colorectal cancer[J]. Int J Oncol,2013,43(6):1 967-1 975.
[15]Irving GR,Howells LM,Sale S,et al.Prolonged biologically active colonic tissue levels of curcumin achieved after oral administration—a clinical pilot study including assessment of patient acceptability[J].Cancer Prev Res(Phila),2013,6(2):119-128.
[16]Jin HY,Zhang HY,Wang X,et al.Expression and clinical significance of Notch signaling genes in colorectal cancer[J]. Tumour Biol,2012,33(3):817-824.
[17]Link A,Balaguer F,Shen Y, et al.Curcumin modulates DNA methylation in colorectal cancer cells[J].PLoS One,2013,8(2):e57709.
[18]Lev-Ari S,Maimon Y,Strier L,et al.Down-regulation of prostaglandin E2 by curcumin is correlated with inhibition of cell growth and induction of apoptosis in human colon carcinoma cell lines[J].J Soc Integr Oncol,2006,4(1):21-26.
[19]杨 芳,刘少琼,禹正杨,等.姜黄素调控结肠癌SW480细胞skp2-p27kip通路的研究[J].中医药导报,2014,20(16):35-38.
(本文编辑 杨 瑛)
Study of Curcum in on Down-regulating Notch1 Pathway in Colorectal Cancer Cells
YANG Fang,LIU Shaoqiong*,LI Chunhua,YIN Ling,LIU Ya,XIE Wanying
(The First Affiliated Hospital of University of South China,Hengyang,Hunan 421001,China)
ObjectiveTo test the expression of Notch1 intracellular domain(NICD1)in human colorectal cancer tissue and to investigate the mechanism of curcumin on the effect of the Notch1 pathway in the human colon cancer cells SW480 and HT29.MethodsThe expression of NICD1 in paraffin section from 40 cases of human colorectal cancer and 31 cases of adjacent tissues were detected by the immunohistochemical method.The relation of NICD1 with human colorectal cancer was determined by comparing the protein expression rate in intestinal mucosal cells of human colorectal cancer and tissues.The protein expressions of NICD,Notch1 and HES-1 in the colon cancer cells SW480 and HT29 which were treated by different concentrations of curcumin(0,7.5,15,30,60μmol/L)at 24 h and 48 h,were tested by western blot assay.ResultsThe expression rate of NICD1 in human colorectal cancer tissues was 100%,and the rate in adjacent tissues was 90.3%,the expression rate in colorectal cancer tissues was more significant than that in the adjacent tissues (P<0.05).The Weston blot result showed that curcumin could down-regulate the expressions of NICD1,Notch1 and HES-1 in SW480及HT29 cells with a time-dose independence.ConclusionOver-expression of NICD1 protein in colorectal tissues may be related with the development and progression of cancer.The position of positive expression could be associated with pathological stage of cancer tissues.Curcumin inhibiting proliferation of the colorectal cancer cells may relied on down-regulating Notch1 pathway.
curcumin;Notch1 pathway;NICD;colorectal cancer;SW480;HT29
R285.6;R735.3+7
A
10.3969/j.issn.1674-070X.2015.04.003
2014-10-12
湖南省自然科学基金项目(11JJ6083)。
杨 芳,女,在读硕士研究生。
*刘少琼,女,副教授,硕士研究生导师,E-mail:liushaoqiong861224@163.com。
