肽类生物表面活性剂中消泡剂的分离研究
2015-02-15张生生闫静芳陆兆新王昱沣
张生生,闫静芳,陆兆新,王昱沣
(南京农业大学食品科技学院,江苏南京 210095)
肽类生物表面活性剂中消泡剂的分离研究
张生生,闫静芳,陆兆新,王昱沣*
(南京农业大学食品科技学院,江苏南京 210095)
本研究首次建立硅胶柱层析两步法以去除抗菌脂肽粗品中所含有的大豆油消泡剂成分,实验中采用高效液相色谱(HPLC)检测抗菌脂肽的含量,薄层色谱-可见光分光光度法定量分析消泡剂中甘油三酯含量,TLC法筛选大豆油的洗脱流动相。研究结果表明:使用200~300目的硅胶作为层析材料,硅胶的总负载量为12.5mg/g时,采取混合液(石油醚∶乙酸乙酯∶乙酸=20∶2∶1,体积比)为流动相,以1mL/min流速进行洗脱,可将97.97%的大豆油成分去除;第二阶段采用流动相为100% 的乙醇以1mL/min流速进行洗脱可将抗菌脂肽解吸,抗菌脂肽的总回收率达到91.52%,纯度从34.07%提高到93.12%。本研究为肽类生物表面活性剂工业化生产和应用提供实验依据。
硅胶,柱层析,生物表面活性素,消泡剂,分离
抗菌脂肽是一类由β-胺基脂肪酸和肽以酰胺键结合小分子物质[1],同时具有亲水和亲油的分子基团,是一种两亲型的物质[2]。抗菌脂肽的主要种类有Surfactin、Iturin、Fengycin等[3],生产菌为革兰氏芽孢杆菌,合成则是以非核糖体的方式进行[4-7]。surfactin的分子由一个C(13~15)的脂肪酸链与一个由七个氨基酸构成的多肽环以酰胺键的形式结合而成,脂肪酸链的极性较弱易于与一些非极性强的物质结合,而由氨基酸构成的多肽环则易于与一些极性强的物质结合,分子量约为1000。surfactin具有比一般的生物活性物质更加特别的生物活性,利用其特别的分子结构也能够实现与非双亲分子的分离。
抗菌脂肽surfactin作为生物表面活性剂,在目前所有的生物表面活剂中活性是最强的,而且相较于化学合成的表面活性剂,具有易降解、环保的优点,是表面活性剂未来的发展趋势[8]。它能在很高水平上促进原油的分解,对原油污染地区的土壤生态恢复过程起到非常明显的作用[9-10]。研究还发现,surfactin能够有效地抑制真菌和细菌、病毒等的生长[11],具有高效、不易产生抗药性的优点,可以用作代替传统抗生素的新型抗生素在医药行业中广泛使用。
Surfactin能够在20μmol/L的浓度下将其水溶液的表面张力降到最低,因此当有空气存在的情况下极易产生大量的泡沫[12-13]。现阶段surfactin的生产过程由于培养基营养物质丰富,并在发酵过程中大量通气,导致在生产过程中产生丰富的泡沫。这样不仅造成营养物质的流失,还会增加生产成本[14-16],不利于surfactin的广泛应用。在surfactin发酵中加入大豆油作为消泡剂,能够有效地抑制发酵过程中泡沫的产生,并极大地提高了抗菌脂肽产量[17]。但经过预处理的抗菌脂肽样品中仍残留着难以分离的大豆油成分,surfactin是两亲性分子,疏水基会与大豆油中的甘油三酯大量结合,造成两者分离困难、surfactin进一步丧失抗菌和表面活性,其纯化和应用受到影响。为了人们的身体健康和食品医药的安全性,现代医药和食品产业对物质纯度的要求很高,因此为了扩大surfactin的应用范围,有必要对抗菌脂肽粗品进行进一步的纯化,去除其中残留的消泡剂成分,使其达到医药和食品行业的要求。关于抗菌脂肽发酵液中消泡剂成分的分离脱除研究至今未见相关研究报道。
硅胶柱层析是一种常见的分离方法,操作简单、成本低廉,在工业化生产中已经应用成熟。本实验以硅胶柱层析作为主要手段,首次采取两步法对发酵样品中的消泡剂(大豆油)进行分离。经过对硅胶柱层析条件优化的过程,确定了硅胶柱层析二步法分离去除抗菌脂肽发酵液中消泡剂的最佳条件,为肽类生物表面活性剂的工业化生产提供实验依据。
1 材料与方法
1.1 材料与仪器
淀粉液化芽孢杆菌fmb50 南京农业大学酶工程实验室构建与保藏。
消泡剂 金龙鱼精炼一级大豆油;柱层析硅胶(200~300目,工业级) 青岛海洋化工厂;G型薄层层析硅胶板(10cm×20cm) 青岛海洋化工厂;石油醚,乙酸乙酯、氯仿、乙醇、浓氨水(分析纯) 南京试剂厂;乙腈、三氟乙酸(色谱纯) 德国Merck公司。
玻璃层析柱1.1cm×30cm 上海煊盛生化科技有限公司;双槽展开缸20cm×10cm 上海信谊仪器厂;恒流泵 上海沪西分析仪器厂有限公司;DBS-100电脑全自动部分收集器 上海沪西仪器设备厂;CP-114先行者精密电子天平 美国OHAUS公司;SB5200DT超声波清洗器 宁波新芝生物科技股份有限公司;V-5000分光光度计 上海元析仪器有限公司;Agilent 1100高效液相色谱仪 美国Aglient公司。
1.2 实验方法
1.2.1 抗菌脂肽的制备 抗菌脂肽的粗品制备过程通过发酵的方式进行,如图1所示主要有保藏菌种斜面的活化及种子液的培养、发酵培养基的接种、产生surfactin的发酵过程等步骤。
图1 抗菌脂肽的发酵过程Fig.1 The fermentation progress of antimicrobial lipopeptides
每1L的发酵液中残留0.15mL的大豆油,发酵液经过预处理后得到抗菌脂肽粗品,然后溶于1mL氯仿中,经检测此时样品纯度为34.07%,混匀即可进样。
1.2.2 薄层色谱法确定柱层析大豆油洗脱的流动相 薄层色谱法的展开剂可以直接应用于硅胶柱层析。硅胶G板首先在110℃的烘箱中活化30min,设置一系列的石油醚与乙酸乙酯的比例(设置见表1),使用微量进样针吸取5μL的大豆油石油醚稀释溶液点于硅胶板上,每个板点九个平行样。使用不同展开剂展开后,将硅胶板置于碘缸中蒸5min,观察显色情况。计算比迁移率Rf值,取每组的平均值。然后以确定的展开剂对经过预处理后的surfactin样品进行展开,将展开后的硅胶板置于一个大烧杯中,再放入一个装有2mL浓盐酸的小烧杯,以保鲜膜对大烧杯进行密封后(应保证在酸解过程中保鲜膜不会因浓盐酸的挥发而破裂),置于110℃烘箱中,进行原位酸解[18]。酸解后的板以茚三酮溶液染色,与以相同方式展开,与未酸解的硅胶板进行对照,以确定在该流动相下,surfactin是否会被提前洗脱下来。
1.2.3 大豆油甘油三酯定量分析方法的建立 大豆油中的主要成分是甘油三酯,其含量达97%,本实验中以甘油三酯作为大豆油定量分析的指标,来确定大豆油的洗脱效果,因而需要对洗脱液中的甘油三酯含量进行测定。薄层色谱-分光光度法[19]因其操作简单、结果可靠,在本实验中被采用。称取40g 200~300目的硅胶,进样1mL大豆油,使用上面方法确定的流动相进行洗脱,薄层色谱确定洗脱液中是否只含有甘油三酯。然后将只含有甘油三酯的洗脱液合并,浓缩得到高纯度的甘油三酯样品,经过薄层色谱检测后,可作为甘油三酯标准品使用。配制5、10、15、20mg/mL等一系列质量浓度的甘油三酯石油醚溶液,使用微量进样针取5μL样品点在硅胶板上,展开后,待展开剂挥发,以10%的磷钼酸乙醇溶液沾板方式染色,吹干溶剂,再置于105℃烘箱中显色10min。将显色后的硅胶板置于浓氨水上方去除背景色,然后扣取显色的斑点,以2mL的纯净水浸泡,并超声沉淀30min,待扣取的硅胶板固体成分沉淀后,取上清定容到5mL。在700nm处测定稀释液的吸光值,吸光值与甘油三酯的含量成正比关系,可以得到甘油三酯质量浓度与其吸光值之间的标准曲线。
1.2.4 硅胶柱层析 首先称取8g 200~300目的硅胶,置于110℃的烘箱中活化3h后,以石油醚浸泡过夜。装柱前,层析柱中先加入0.1BV的石油醚,然后倒入浸泡过的硅胶,待自然沉降过程完成,以石油醚淋洗硅胶柱,压实柱体,并洗脱出硅胶柱中的杂质。进样前以洗脱大豆油的流动相替换出柱体中的石油醚。加入配制好的样品后,泵入初始流动相,通过薄层色谱法跟踪大豆油的洗脱分布,然后将含有大豆油的洗脱液收集起来,浓缩后按照上面的方法进行定量分析,计算大豆油的洗脱率。第二阶段的洗脱以纯乙醇作为流动相,HPLC跟踪检测[20]确定含有surfactin的乙醇溶液并收集。
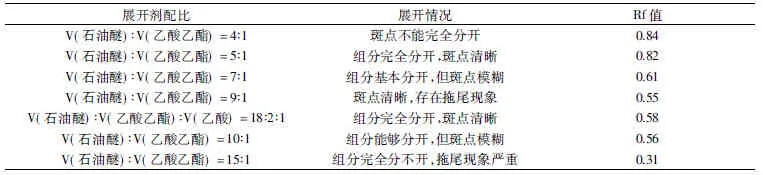
表1 不同展开剂的薄层层析结果Table1 Results of TLC with different developing solvents
1.2.5 回收率及纯度的测定
Surfactin回收率(%)=c1×v/(p×m1)×100
其中:c1为检测的收集浓缩液的浓度,v为收集液浓缩后的体积,p为预处理后干物质的纯度,m1为配制样品时称取的干物质的质量。
Surfactin的纯度(%)=c1×v/(m3-m2)×100
Surfactin纯度测定:蒸馏水润洗150mL烧杯后在55℃烘箱中烘至恒重,称重m2。加入浓缩后的收集液,将溶剂吹干,在45℃烘箱中烘至恒重,称重为m3。
1.2.6 数据统计方法 所得实验均重复三次,数据取三次实验结果的平均值,采用orgin8.0作图。
2 结果与讨论
2.1 大豆油甘油三酯薄层色谱法展开剂的选择
设置一系列展开体系,展开的结果如表1所示。由表1可知,当流动相为V(石油醚)∶V(乙酸乙酯)=5∶1时,大豆油中各个组分能够完全分开,但是Rf值为0.82,应用于硅胶柱层析的展开剂的Rf值范围一般在0.5左右,Rf值太大会导致组分在层析柱无法得到有效分离。以V(石油醚)∶V(乙酸乙酯)=9∶1作为流动相时,虽然各个组分能够分开,但是拖尾现象严重,这样会导致在硅胶柱层析中同样会导致拖尾现象。因而向展开体系中加入乙酸,使展开剂的最终组成为V(石油醚)∶V(乙酸乙酯)∶V(乙酸)=18∶2∶1,由表1可知,该展开体系可以有效地防止拖尾,Rf值也在0.5左右,能够直接应用于硅胶柱层析。以此展开剂对经过HPLC检测的纯度达到80% surfactin样品进行展开,经过原位酸解的实验组与未经原位酸解的对照组以10%茚三酮乙醇染色后进行比较后发现,surfactin样品在该展开剂下的比迁移值几乎为零,这样应用于硅胶柱后,surfactin会被层析柱吸附,而甘油三酯会被淋洗下来,达到分离的目的。
2.2 大豆油甘油三酯标准曲线的建立
以溶液中甘油三酯质量浓度为纵坐标,吸光值为横坐标,绘制两者之间的关系曲线,如图2。由图可知,甘油三酯浓度与吸光值之间的线性关系良好,回归方程为y=236.5010x-18.8778,相关系数R2=0.9931。为后续实验中简单、快速的测定溶液中甘油三酯含量提供了有效的手段。
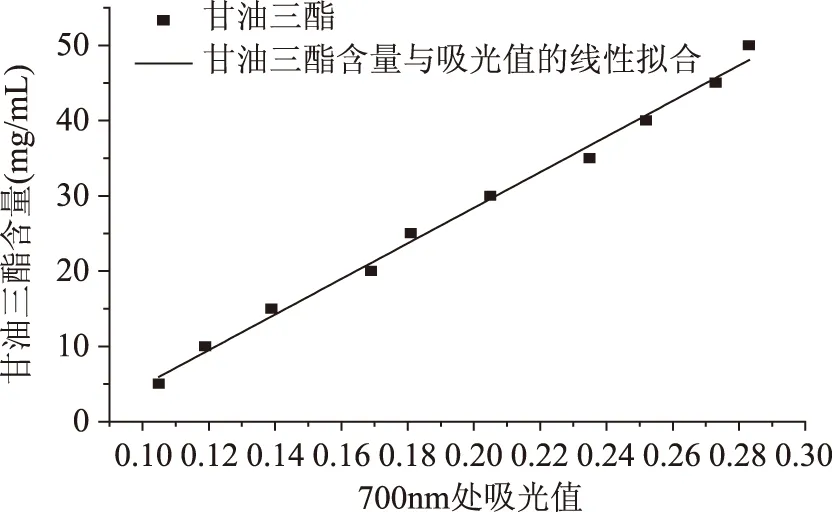
图2 甘油三酯浓度与吸光值之间的关系曲线Fig.2 Triglyceride and the light absorbance value curve
2.3 洗脱大豆油甘油三酯流动相的选择与验证
硅胶层析柱洗脱时使用的流动相要比以TLC方法确定的展开剂极性稍小,所以甘油三酯洗脱时增加洗脱剂中石油醚的含量,以V(石油醚)∶V(乙酸乙酯)∶V(乙酸)=20∶2∶1为流动相。按照上述方法配制好样品后,在1mL/min条件下层析,收集甘油三酯洗脱液,浓缩后,根据上面的定量方法进行定量分析,经过三次重复验证实验结果如表2。由表可知:三次重复实验中甘油三酯的回收率平均值为97.97%,标准差仅为0.75%,实验结果稳定,重复性良好。这说明V(石油醚)∶V(乙酸乙酯)∶V(乙酸)=20∶2∶1作为淋洗剂,能够有效地将过柱样品中的大豆油成分洗脱下来。

表2 甘油三酯洗脱实验Table2 The elutation of triglyceride
2.4 柱层析优化
上面的验证实验可知:在所确定的大豆油洗脱条件下,样品中的大豆油成分能够有效地被洗脱和去除。因此在后续实验中不再测定洗脱液中的甘油三酯含量。以surfactin的回收率和纯度作为层析效果的评价指标。
2.4.1 洗脱surfactin流动相的筛选 surfactin因为含有一个亲水基团,具有较强的极性,为了能够将surfactin从层析柱上面洗脱下来,初步选用分子极性强的纯醇做为流动相。为了更好的将surfantin从层析柱上洗脱下来,并降低成本,可以向纯乙醇中加入一定比例的超纯水。水的极性比乙醇更强,水分子与surfactin争夺硅胶的极性中心,理论上能更有效地将surfactin洗脱下来,硅胶柱实验结果如图3。由图3可知乙醇中加入一定量的水在一定范围内能够提高surfactin的回收率,但是流动相极性太强的条件下,很多强极性的杂质也会随着surfactin被洗脱下来,导致层析后样品的纯度降低。因此综合考虑,单一的乙醇作为流动相操作简单,成本也相对低廉,易于工业化的放大生产。使用乙醇作为流动相时,回收率与纯度均处在一个较高的水平,具备易进行工业化的潜能。
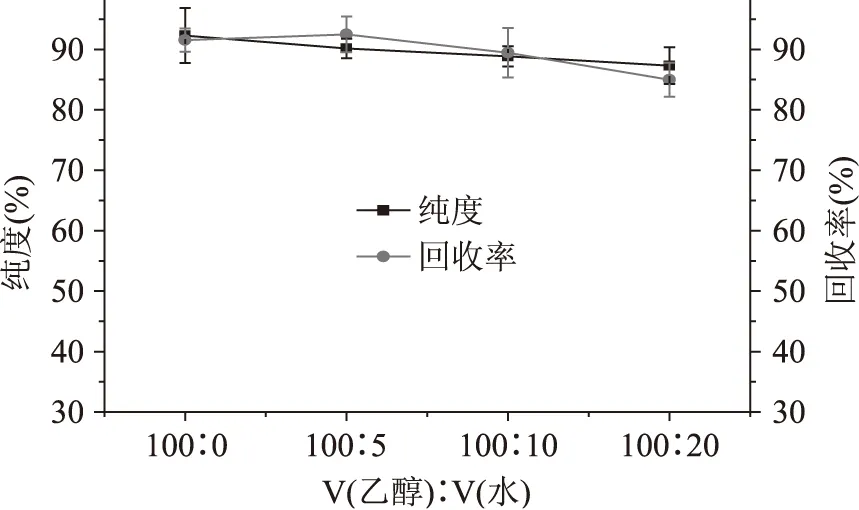
图3 流动相对纯度和回收率的影响Fig.3 Effect of fluid phase on the recovery and purity
2.4.2 最佳流速的优化 物质在硅胶柱层析的过程是一个吸附和解吸不断进行的过程,当流动相确定后,层析时流速能够决定层析进行的质量高低和整个过程的时间长短。Surfactin是一种极性较强的物质,硅胶柱对其吸附力较强,因此有必要在保证样品纯度的条件下,提高流速节省时间以及回收率。经过系列优化实验,结果如图4如示。由图可知,当流速为0.5mL/min时,回收率处在一个较低的水平,这样会增加surfactin的生产成本。流速为1.0mL/min时,surfactin的纯度和回收率均较高,故选用1.0mL/min做为层析时的流速。
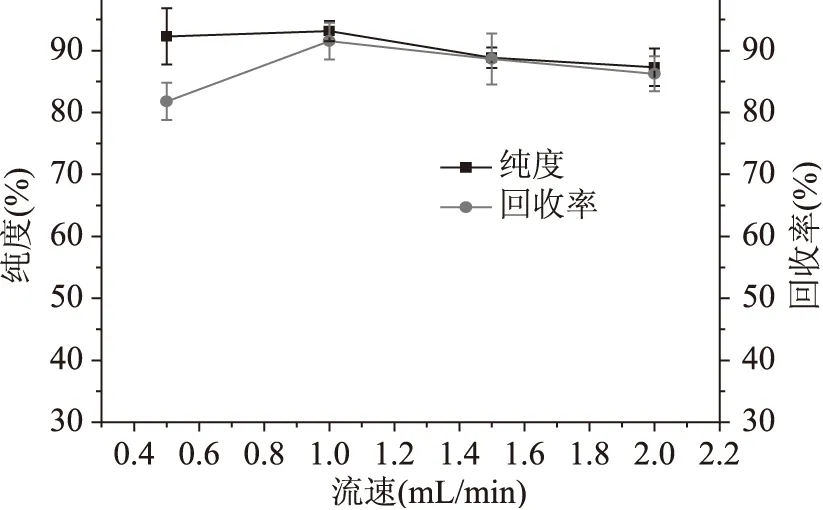
图4 流速对回收率和纯度的影响Fig.4 Effect of flow rate on the recovery and purity
2.4.3 上样量的优化 硅胶对不同物质的吸附能力不同,在未达到饱和吸附量时,随着进样量的增加,纯度和回收率不会明显降低。工业化中为了一次处理更多的样品,节省时间和成本,上样浓度一般会达到层析硅胶的饱和吸附量。本实验设置四个上样量梯度,经过三次重复实验结果如图5。由图5可知,当硅胶层析材料为8g,干物质的添加质量为50mg时,实验中损失所占比例会较大,导致回收率降低,增加生产成本,影响生产的效率。添加干物质的质量为150mg及200mg时,纯度和回收率相较于添加100mg有明显的下降。从节约生产成本的角度考虑,选用添加干物质100mg(即12.5mg抗菌脂肽/g硅胶)作为最佳添加量。
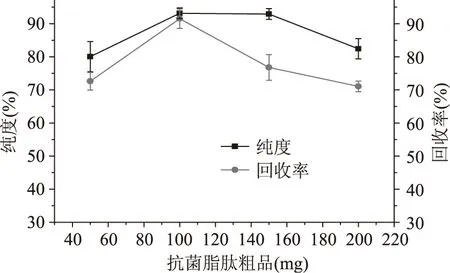
图5 上样量对回收率和纯度的影响Fig.5 Effect of quantity of dry substance of surfactin on recovery and purity
经过对surfactin两步层析过程流动相、流速、上样量的优化,层析的效率有了很大提升,surfactin样品的回收率达到了91.52%,而纯度可达到93.12%。
3 结论
本文首次以硅胶柱层析为主要手段对抗菌脂肽样品中残留的消泡剂大豆油成分进行了分离脱除,并对该两步层析法操作工艺进行了优化。以12.5mg抗菌脂肽/g硅胶的比例对预处理后的抗菌脂肽配制样品,以V(石油醚)∶V(乙酸乙酯)∶V(乙酸)=20∶2∶1的混合液为流动相,流速为1mL/min时,能够将发酵中所加入的97.97%消泡剂洗脱下来;再以无水乙醇为流动相,速度为1mL/min进行第二阶段层析时,surfactin样品的回收率达到了91.52%,而纯度可达到93.12%。由此可以得出结论,所建立的硅胶柱两步层析法可有效去除surfactin中大豆油,操作工艺易实现工业化,为surfactin作为新型表面活性剂的生产和使用提供了基础。
[1]Ahimoua F,Jac quesb P,Deleua M. Surfactin and iturin A effects on Bacillus subtilis surface hydrophobicity[J]. Enzyme and Microbial Technology,2000,27(10):749-754.
[2]Kosaric N,Cairns WL. Biosurfactants and Biotechnology[M]. NY:Marcel Dekker Inc,1987.
[3]唐群勇,周小虹,陆兆新,等. Bacillus subtilis fmbJ产Fengycin对Rhizopus stolonifer呼吸链及营养物质利用的影响[J]. 食品科学,2011,32(11):248-254.
[4]刘向阳,杨世忠,牟伯中. 微生物脂肽的结构[J]. 生物技术通报,2005,(4):18-26.
[5]吕应年,杨世忠,牟伯中. 脂肽的分离纯化与结构研究[J].微生物学通报,2005,32(1):67-73.
[6]Leenders F,Stein T H,Kablitz B,et al. Rapid typing of Bacillus subtilis strains by their secondary metaboolites using matrix-assisted laser desorption/ionization mass spectrometry of intact cells[J]. Rapid Communication of Mass Spectrometry,1999 13(10):943-949.
[7]Wang J,Liu J,Wang X,et al. Application of electrospray ionization mass spectrometry in rapid typing of fengycin homologues produced by Bacillus subtilis[J]. Letters in Applied Microbiology,2004,39(1):98-102.
[8]Peypoux F,Bonmatin J M,Wallach J. Recent trends in the biochemistry of surfactin[J]. Applied Microbiology and Biotechnology,1999,51(5):553-563.
[9]Ivshina I B,Kuyukina M S,Philp J C,et al. Oil desorption from mineral and organic materials using biosurfactant complexes produced by Rhodococcus species[J]. World Journal of Microbiology and Biotechnology,1998,14(5):711-717
[10]Moran A C,O livera N,Commendator M,et al. Enhancement of hydrocarbon waste biodegradation by addition of a biosurfactant from Bacillus subtilis O9[J]. Biodegradation,2000,11(1):65-71.
[11]Razafindralambo H,Paquot M,Baniel A,et al. Foaming properties of a natural cyclic lipoheptapeptide belonging to a special class of amphiphilic molecules[J]. Food Hydrocolloids,1997,11(1):59-62.
[12]Razafindralambo H,Popineau Y,Deleu M,et al. Foaming Properties of Lipopeptides Produced by Bacillus subtilis:Effect of Lipid and Peptide Structural Attributes[J]. Journal of agricultural and food chemistry,1998,46(3):911-916.
[13]Henry G,Deleu M,Jouedan E,et al. The bacterial lipopeptide surfactin targets the lipid fraction of the plant plasma membrane to trigger immune-related defence responses[J]. Cellular Microbiology,2011,13(11):1824-1837.
[14]Davis D A,lyncha H C,Varley J. The application of foaming for the recovery of Surfactin from B.subtilis ATCC 21332 cultures[J]. Enzyme and Microbial Technology,2001,28(4-5):346-354.
[15]Lee B S,Kim E K. Lipopeptide production from Bacillus sp. GB 16 using a novel oxygenation method[J]. Enzyme and Microbial Technology 2004,35(6-7):639-647.
[16]Kim H S,Yoon B D,Lee C H,et al. Production and properties of a lipopeptide biosurfactant from Bacillus subtilis C9[J]. Journal of Fermentation and Bioengineering,1997,84(1):41-46.
[17]魏浩,陆兆新,吕凤霞,等. Bacillus amyloliquefaciens ES-2发酵产抗菌脂肽消泡剂的筛选及脂肽的提取和纯化[J]. 中国生物工程杂志,2011,31(2):85-90.
[18]别小妹,陆兆新,吕凤霞,等. Bacillus subtilis fmbR抗菌物质的分离和鉴定[J]. 中国农业科学,2006,39(11):2327-2334.
[19]鲍方宇,张敏. 薄层色谱法测定油脂中甘油三酯含量[J].食品科学,2013,34(4):125-128.
[20]艾嘉,陆兆新,别小妹,等. 高效液相色谱法测定发酵液中表面活性素的含量[J]. 食品科学,2009,30(6):188-190.
Research of the separation of defoamer in antimicrobial lipopeptides
ZHANG Sheng-sheng,YAN Jing-fang,LU Zhao-xin,WANG Yu-feng*
(College of Food Science and Technology,Nanjing Agriculture University,Nanjing 210095,China)
In this study,two-step method of silica gel chromatography was established to remove the defoamer in broth of antimicrobial lipopeptides for the first time. High-performance liquid chromatography(HPLC)was applied to detect the concentration of surfactin. Thin layer chromatography(TLC)-visible spectrophotometry was used to conduct quantitative analysis of triglyceride in eluent. Also,thin layer chromatography(TLC)was taken as the way to select the developing agent for triglyceride. The result showed,when 200~300 mesh silica gel was used as the chromatography support beads,the total loading amount of silica gel was 12.5mg/g. Under the condition of the mixture(petroleum ether∶ethyl acetate∶ethyl acid=20∶2∶1,proportation of volume)as the fluid phase,flow rate of 1mL/min,97.97% of all the defoamer was obtained in the eluent. Secondly,when absolute ethyl alcohol was used as the fluid phase with a flow rate of 1mL/min,surfactin could be desorpted from the silica gel column,and its recovery reached 91.52%. The purification was greatly improved from 34.07% to 93.12%. This research provided experimental basement for the industrial production and application of antimicrobial lipopeptides.
silica gel;column chromatography;surfactin;defoamer;separation
2014-06-27
张生生(1989-),男,在读硕士研究生,主要从事食品科学和生物发酵的研究。
*通讯作者:王昱沣(1976-),男,博士,副教授,主要从事生物分离的研究。
中央高校基本业务专项基金(KYZ201154),江苏高校优势学科建设工程资助项目和江苏省优势学科人才引进项目(80900210521)。
TS201.1
A
:1002-0306(2015)09-0091-05
10.13386/j.issn1002-0306.2015.09.011
