中等强度运动对大鼠DDT累积代谢、肝脏应激及结构影响
2015-02-14李可峰董贵俊朱晓华周兴忠王玉站郑淑倩葛新发胡一平
李可峰,董贵俊,朱晓华,李 丽,周兴忠,3,王玉站,郑淑倩,4,葛新发,韩 勇,胡一平
中等强度运动对大鼠DDT累积代谢、肝脏应激及结构影响
李可峰1,董贵俊1,朱晓华2,李 丽1,周兴忠1,3,王玉站1,郑淑倩1,4,葛新发1,韩 勇1,胡一平1
目的:研究全民健身背景下有氧运动对持续性有机污染物代谢的影响,揭示有氧运动对DDT在体内累积代谢、对肝脏应激及结构的影响。方法:90只雄性Wistar大鼠随机分为对照组(CON)、安慰剂组(PG)、有氧运动组(AG)、正常饲养DDT组(CDG)、有氧运动DDT组(ADG)。其中,CDG和ADG以40 mg/kg(体重)的比例喂食DDT溶液2周,ADG和AG每天以18 m/min运动30 min。在运动第15天、30天、45天后取材,经研磨和冷冻干燥后采用气相色谱法测定不同组织中DDT的浓度分布;采用黄嘌呤氧化酶法测定肝脏SOD活性、硫代巴比妥酸比色法测定肝脏MDA含量、酶速率法测试肝脏GSH-Px活性、可见光法测定肝脏CAT活性;HE染色肝脏组织切片、醋酸铀和柠檬酸铅对超微结构染色,分别采用DP70数码显微镜成像系统及Tecnai Spirit 120KV透射电子显微镜及成像系统观察、拍照。结果:CDG肝脏中DDT浓度在停止喂食DDT后呈逐渐下降趋势,而ADG中则出现浓度先上升后下降的趋势。在15~30天中,ADG肝脏中DDT浓度显著高于CDG(P<0.01),而45天则显著低于CDG(P<0.05);与CDG比较,ADG心脏中DDT浓度在15天和45天时显著升高,而30天时DDT浓度低于CDG组;CDG骨骼肌DDT浓度呈递减趋势,ADG中呈逐渐上升趋势;在15~30天,ADG血液DDT浓度显著低于CDG(P<0.01);CDG中粪便DDT浓度呈逐渐下降趋势,ADG中浓度呈现较为稳定的趋势。氧化应激研究发现,有氧运动促进ADG中SOD活性在15~45天持续升高,且显著性高于CDG(P<0.05);MDA含量在15~30天内显著性升高(P<0.05),但在45天时呈现显著性下降(P<0.01);GSH-Px及CAT活性15天和30天时均显著升高(P<0.05),在45天时则受到显著抑制(P<0.05)。DDT摄入影响肝脏超微结构,并随着DDT在肝脏中积累而加重,施加有氧运动干预后期能明显改善DDT摄入引起的超微结构的变化。结论:中等强度运动通过改变DDT在体内分布,减少了DDT在肝脏中的富集,但增加了运动初期心脏和骨骼肌中DDT分布及DDT排出体外的速度;改善肝脏的氧化应激状态,特别有利于运动初期肝脏中氧化应激状态的改善;有利于DDT富集引起的肝组织结构变化恢复。
有氧运动;大鼠;DDT代谢;肝脏;氧化应激
1 前言
持续性有机污染物(Persistent Organic Pollutants,POPs)是一类对人类健康和环境具有严重危害的天然或人工合成的有机污染物质,具有残留长、易蓄积、半挥发及毒性高等特点,其代表之一为双对氯苯基三氯乙烷(Dichlorodiphenyltrichloroethane,DDT),其主要用于农业的害虫防治及减轻疟疾伤寒等蚊蝇传播的疾病危害,通过食物链最终进入人体[31]。DDT为脂溶性物质,降解周期长,可影响内分泌系统,诱导肝细胞微粒体氧化酶类,可引起高血压、肝脏肿大、癌变等危害[8,15,17,32,33]。目前,对DDT的研究主要集中在其对水域、海洋生物、微生物富集趋势、致病特征、致死剂量、降解速度等,其代谢主要受过氧化物酶、趋磁细菌等影响[23,25]。虽然DDT的大范围使用已得到有效控制,但由于其或其代谢产物在环境中残存的持久性、毒性及在生物链中的累积效应导致DDT长时间、大范围的传播,因此,其对人类健康及环境的影响依然不容忽视。2014年,Hu等发现,长江三角洲土壤中的DDT残留依然主要来源于过去施用的DDT[12]。Wang等(2013)调查了海河流域及其沉积物中DDT的含量,发现河北省东部水域的DDT污染最为严重,污染源中发现新近使用的DDT[34]。实际上DDT在世界范围内并未完全被杜绝使用。由于DDT控制疟疾的廉价及有效性,有些国家依然将DDT等POPs用于疟疾的防治,由此更为加剧了DDT对环境及人类健康的危害[4]。据调查,北京地区300多位孕妇乳汁中有90%检出多氯联苯或DDT等POPs,另有10%人群体内残留POPs处在危险水平[35]。因此,预防及干预DDT在体内的积累已成为全民健康计划的重要研究课题。
长时间有氧运动能够加速脂类代谢,提高过氧化物酶等活性,但有氧运动对体内DDT降解的研究尚处于探索阶段[2]。Berdanier等发现,有氧运动对DDT诱导的大鼠肝脏胆固醇及血清胰岛素下降具有抵制作用,增加有氧运动可以显著增强喂养DDT大鼠的葡萄糖耐受力,提高免疫血清及血清胰岛素的含量,从而有利于大鼠肝脏功能的恢复,但文中未涉及DDT在大鼠体内其余脏器的分布及代谢动力学情况[3]。本研究通过灌胃饲养将DDT植入大鼠体内,研究DDT摄入后在体内累积代谢特征,同时进行有氧运动干预,探讨有氧运动对DDT累积代谢特征,有氧运动干预DDT诱发的大鼠肝脏应激状态及结构改变。
2 研究对象与方法
2.1 研究对象

2.2 研究方法
2.2.1 给药方式
DDTs(p,p′-DDT,p,p′-DDE,p,p′-DDD和o,p′-DDT)标样购于国家标准物质研究中心,溶于橄榄油中待用。给药量以40 mg/kg体重(半致死量)为标准,配制浓度为6.256 mg/mL的DDTs溶液,连续给药2周[5,10]。
2.2.2 样品采集
首次运动后15天、30天、45天采用脊柱脱臼法处死实验大鼠,解剖取肝脏、心脏、股四头肌及粪便。断头法取血液,室温放置30 min后4℃/4 000 rpm离心10 min,取血清,液氮速冻用于酶学指标。心脏、股四头肌、粪便及部分肝脏样品于液氮冻存。部分肝脏样品冰上低温环境下修材,切成0.5 cm×0.5 cm×0.8 cm长方体置于4%多聚甲醛固定用于组织结构分析,部分切成1 mm×1 mm×2 mm长方体置于2.5%戊二醛溶液固定用于超微结构分析。
2.2.3 样品DDTs浓度测定
测试方法参照Emmanuel等进行[33]。将样品冷冻干燥,研磨后用正己烷和丙酮混合液(体积比1∶1)于ASE300加速溶剂萃取仪(戴安科技有限公司,美国)进行萃取。萃取液浓缩后经Florisil柱(干法装柱,依次为2 cm的无水硫酸钠、5 g弗罗里土及2 cm的无水硫酸钠)净化,第一步,10 mL正己烷洗脱,第二步,30 mL正己烷/二氯甲烷 (4∶1) 洗脱。洗脱液旋转蒸发浓缩,氮吹定容至1 mL,待上机分析。气相色谱仪Agilent 6890 GC-ECD(安捷伦公司,美国)在样品测试前,进行必要的校准、核对和条件化,重复进同一浓度标样5~7次,直到测定结果的RSD<5%,开始进行样品测试,以确保色谱仪的准确性。用保留时间和标准样品进行定性,用外标法和五点校正曲线进行定量。升温程序:HPDB-5弹性石英毛细管柱(30 m×0.25 mm×0.25 m),初始柱温100℃保持2 min,再以15℃/min的速度升温至180℃,然后以5℃/min的速度升温至300℃,保持4 min。进样口温度260℃。检测器温度320℃。以高纯氮气作为载气,进样量1 μL。每批分析样带1个空白样,以确认试剂和容器的清洁程度。加标样:每批分析样(约10个)带1个待测样添加标样。回收率指示物PCB209的回收率为75%~109%。p,p′-DDE、p,p′-DDD、o,p′-DDT和p,p′-DDT的仪器定量限分别为0.6 pg、0.7 pg、0.5 pg和0.5 pg。
2.2.4 氧化应激状态相关酶指标测定
SOD活性的测定采用黄嘌呤氧化酶法,MDA含量的测定采用硫代巴比妥酸比色法,GSH-Px活性测试采用酶速率法,CAT活性的测定采用可见光法。试剂盒由南京建成生物有限公司提供,具体测试方法参照试剂盒标注。
2.2.5 组织石蜡切片标本及电子显微镜标本制作
固定样品放入苏木精染液中染色5 min,用水冲洗3 min;1%盐酸酒精溶液分化3 s,流水冲洗3 min;伊红染液复染2 min;按顺序依次放入85%、95%、95%、100%、100%酒精中脱水、分化伊红颜色各1 min;切片经二甲苯透明各3 min,将载玻片取出,滴加一滴中性树胶,加盖玻片封片。将封好的切片置于37℃恒温箱内烘烤。日本OLYMPUS公司生产的DP70数码显微镜成像系统观察并拍照。
透射电子显微镜标本制作组织取材,放入2.5%戊二醛溶液中(磷酸缓冲液配置),固定2 h,0.1 mol/L磷酸缓冲液漂洗15 min,共3次;用1%锇酸固定液室温下固定2 h;0.1 mol/L磷酸缓冲液漂洗15 min,漂洗3次;后经乙醇脱水、包埋、聚合、切片后,用3%醋酸铀、柠檬酸铅染色,分别染色15 min及5 min。Tecnai Spirit 120KV透射电子显微镜及成像系统观察并拍照。
2.3 数理统计

3 结果
3.1 有氧运动对DDTs在大鼠体内分布的影响
3.1.1 有氧运动对肝脏DDTs浓度的影响
与CON比较,PG和AG肝脏内DDTs浓度没有显著性变化(P>0.05)。喂养DDTs两组在15~30天内肝脏内DDTs浓度显著高于CON(P<0.01)。45天时,CDG组显著高于CON(P<0.01) 。CDG肝脏中DDTs浓度在停止喂食DDTs后逐渐下降,而ADG中浓度先上升后下降。在15~30天中ADG肝脏中DDTs浓度显著高于CDG(P<0.01),而45天时则显著低于CDG(P<0.05),说明在喂食DDTs后,有氧运动早期促进了DDTs在肝脏中的储存,而有氧运动后期(45天)加速了DDTs在肝脏中的排出。因此,长时间的有氧运动可以加速DDTs从大鼠肝脏中排出(表1)。
表1 本研究各组大鼠不同时间肝脏中DDTs浓度一览表
Table 1 Liver DDTS Concentration in Different Groups(ng/g)

注:#为与CON比较 P<0.01,&为ADG和CDG比较P<0.05,@为ADG和CDG比较P<0.01,下同。
3.1.2 有氧运动对心脏中DDT浓度的影响
表2显示,CDG、ADG中DDTs浓度先上升后下降,各时期DDTs浓度均显著性高于CON。不同时间点ADG DD区浓度变化幅度小于CDG。与CDG组比较,ADG组DDTs浓度在15天和45天时显著升高(P<0.01),而30天时略低于CDG组。说明,有氧运动能够持续促进DDTs在体内的分布,特别是通过血液循环进行DDTs的再分配。
表2 本研究各组大鼠不同时间心脏中DDTs浓度一览表
Table 2 Heart DDTS Concentration in Different Groups(ng/g)

注:*为与CON比较P<0.05,下同。
3.1.3 有氧运动对骨骼肌中DDTs浓度的影响
骨骼肌中,CDG中DDTs浓度呈递减趋势,15天时显著高于CON(P<0.01)。至30天时,CDG基本恢复到正常水平,和CON比较不具有显著性差异(P>0.05)。ADG中DDTs浓度呈逐渐上升趋势,15~45天中DDTs浓度逐渐升高,和CON比较具有显著性差异。与CDG浓度比较研究发现,15天时ADG中DDTs浓度显著下降(P<0.01),而在30~45天时ADG中DDTs浓度显著上升(P<0.01),说明有氧运动使体内DDTs向骨骼肌转移(表3)。
表3 本研究各组骨骼肌中DDTs浓度一览表
Table 3 Skeletal Muscle DDTS Concentration in Different Groups (ng/g)

15天30天45天CON658.4±234.2679.5±229.4667.3±228.3PG671.4±227.3655.2±235.2683.2±231.1AG650.1±223.9666.3±233.8662.7±226.3CDG3088.1±389.3#651.3±237.3388.8±226.3ADG1162.6±272.3*@1285.2±129.2#@1970.4±332.5#@
3.1.4 有氧运动对血液中DDTs浓度的影响
表4所示,CDG和ADG 15~45天期间,DDTs浓度均显著高于CON,表明DDTs大量进入血液。对比CDG和ADG中DDT浓度发现,在15~30天期间,ADG组DDT浓度显著低于CDG(P<0.01),且ADG中DDTs浓度变化幅度明显小于CDG,表明有氧运动有利于抑制血液中DDTs浓度快速上升。
表4 本研究各组大鼠不同时间血液中DDTs浓度一览表
Table 4 Blood DDTS Concentration in Different Groups(ng/g)

15天30天45天CON4.2±1.24.7±0.94.5±1.1PG4.4±1.04.1±1.34.6±1.5AG4.9±1.44.3±0.94.8±1.2CDG69.2±9.3#449.8±54.1#26.7±7.8#ADG21.4±7.3#@27.4±8.1#@22.3±6.2#
3.1.5 有氧运动对粪便中DDTs浓度的影响
表5显示,CDG和ADG粪便中DDTs浓度变化未表现出一致规律。CDG中粪便DDTs浓度呈逐渐下降趋势,表明随着DDTs对大鼠机体的毒性发作,其机体排出DDTs的能力逐渐下降。ADG粪便中DDTs浓度呈现较为稳定的趋势,特别是45天时DDTs浓度显著高于CDG(P<0.01),表明有氧运动能够使大鼠体内DDTs均匀排出,减少DDTs浓度急性变化对机体应激代谢能力的影响。
表5 本研究各组大鼠不同时间粪便中DDTs浓度一览表
Table 5 Excrement DDTS Concentration in Different Groups(ng/g)

15天30天45天CON567.2±123.1583.7±145.2554.4±141.3PG563.2±132.6579.8±126.9543.6±119.4AG596.1±121.3552.4±152.3563.2±128.8CDG7217.4±4131.1#4444.8±2705.6#1921.2±787.5#ADG4827.6±3930.7#&2389.4±541.3#&4388.4±5041.5#@
3.2 有氧运动对喂养DDTs大鼠肝脏氧化应激状态的影响
3.2.1 有氧运动对喂养DDTs大鼠肝脏内SOD活性的影响
有氧运动能使SOD活性升高,在15天时CON和AG相比,AG中SOD活性显著升高(P<0.05),至30~45天时SOD活性持续升高。喂养DDTs后,CDG中SOD活性下降,在30天时与CON中SOD活性相比显著性下降(P<0.05),随后45天时SOD活性出现上升,但均低于同时间CON中SOD活性。与CDG中SOD活性比较,ADG在此期间持续升高,且在30天和45天时显著性高于CDG(P<0.05),表明有氧运动对喂养DDTs大鼠肝脏中SOD活性表现出显著激活作用(表6)。
表6 本研究各组大鼠不同时间肝脏内SOD活性变化一览表
Table 6 Rat Liver SOD Activities in Different Groups at Different Time(U/mg prot)

注:§为与AG比较P<0.05,※为与AG比较P<0.01,下同。
3.2.2 有氧运动对喂养DDTs大鼠肝脏内MDA含量的影响
与CON比较,AG 15天时MDA含量显著性升高(P<0.05),30天时继续升高(P<0.01),至45天时逐渐下降至CON水平(P>0.05),表明正常大鼠肝脏在45天内逐渐适应有氧运动刺激。在喂养DDTs大鼠中,CDG中MDA含量在15天时与CON比较显著性升高(P<0.01),此后持续上升,至45天时表现为最大值。与CDG比较,ADG中MDA含量在15~30天内显著性升高,45天时呈现显著性下降,但仍显著性高于CON中MDA含量(P<0.01),表明有氧运动对于喂养DDTs大鼠肝脏中MDA的产生在早期具有一定的刺激作用,在30天后表现为一定的抑制作用。因此,长时间有氧运动有效降低DDTs在肝脏内积累引起的氧化损伤(表7)。
表7 本研究各组大鼠不同时间肝脏内MDA含量变化一览表
Table 7 Rat Liver MDA Contents in Different Groups at Different Time(mmol/mg prot)

15天30天45天CON0.92±0.070.91±0.080.92±0.10PG0.91±0.050.92±0.100.91±0.08AG1.15±0.19*1.57±0.09#0.93±0.09CDG1.95±0.12#§2.67±0.11#※2.92±0.09#※ADG2.23±0.12#※&3.21±0.09#§@2.58±0.08#※@
3.2.3 有氧运动对喂养DDTs大鼠肝脏内GSH-Px活性的影响
有氧运动可以诱导AG中GSH-Px活性逐渐增高,但在15天时与CON比较并未发现显著性差异,至30~45天时显著高于CON(P<0.05)。CDG中,喂养DDTs在15天时诱导GSH-Px活性增高,至30天时显著性高于CON(P<0.05),此后酶活性下降至正常水平。喂养DDTs后施加有氧运动干预在运动早期(15天、30天)能显著性提高GSH-Px活性,其中,15天时显著性高于CON(P<0.05),30天时活性继续提高(P<0.01),至45天时活性下降至正常水平,显著性低于AG(P<0.05,表8)。
表8 本研究各组大鼠不同时间肝脏内GSH-Px活性变化一览表
Table 8 Rat Liver GSH-Px Activities in Different Groups at Different Time(U/mg prot)

15天30天45天CON151.58±14.27149.43±16.65152.73±13.87PG149.63±15.39150.59±24.99148.28±16.81AG173.66±27.37196.36±23.89*194.92±17.42*CDG185.33±18.47194.39±19.12*169.27±24.17ADG199.32±17.72*227.55±24.94#157.64±25.92§
3.2.4 有氧运动对喂养DDTs大鼠肝脏内CAT活性的影响
与CON相比,喂食DDTs后,ADG在15天和30天时CAT活性存在显著性差异,但至45天时未表现出显著性差异(P>0.05),说明在15~30天期间,有氧运动能有效提高CAT活性,即有氧运动对喂养DDTs大鼠肝脏的过氧化氢酶活性在喂养结束前期具有一定的刺激作用(表9)。
表9 本研究各组大鼠肝脏内不同时间CAT活性变化一览表
Table 9 Rat Liver CAT Activities in Different Groups at Different Time(U/mg prot)
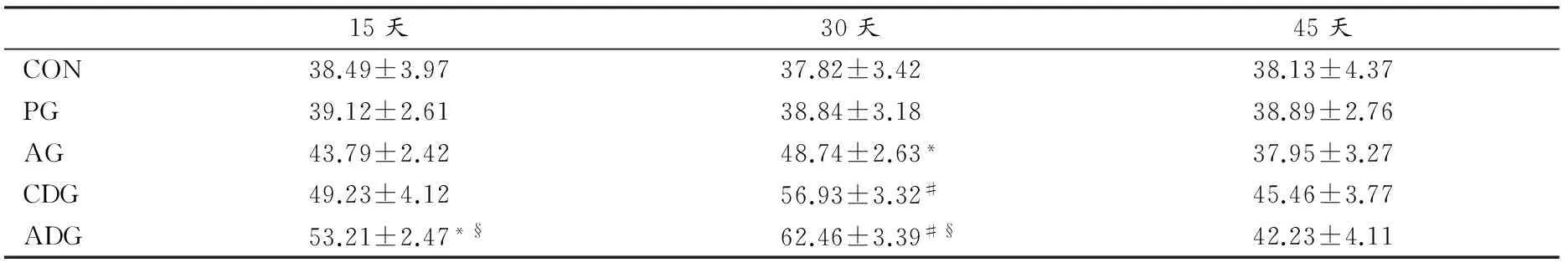
15天30天45天CON38.49±3.9737.82±3.4238.13±4.37PG39.12±2.6138.84±3.1838.89±2.76AG43.79±2.4248.74±2.63*37.95±3.27CDG49.23±4.1256.93±3.32#45.46±3.77ADG53.21±2.47*§62.46±3.39#§42.23±4.11
3.3 有氧运动对喂养DDTs大鼠肝脏的影响
3.3.1 有氧运动对喂养DDTs大鼠肝脏重量的影响
与CON比较,ADG和CDG肝脏重量在15天时并未出现显著性变化(P>0.05)。随着喂养DDTs时间的延长,至30天时CDG肝脏重量达到14.98 g,显著性高于CON及ADG(P<0.05)。45天时,CDG肝脏重量显著高于CON和ADG(P<0.01),而ADG与CON之间未表现出显著差异性(表10)。
表10 本研究大鼠肝脏重量的变化一览表
Table 10 Changes of Rat Liver Weight(g)

CONCDGADG15天Body280.00±1.41282.50±0.71281.50±1.32Liver14.13±0.2514.17±0.1914.16±0.1630天Body335.00±1.46339.50±2.12*336.00±2.58Liver14.24±0.1314.98±0.17&*14.21±0.1845天Body373.00±3.56&389.50±2.09#384.00±2.14Liver14.23±1.0619.67±0.68@#14.22±0.22
3.3.2 有氧运动对喂养DDTs大鼠肝脏组织结构影响
CON:15天、30天、45天中HE组织切片未发现异常,肝组织结构正常,细胞结构清晰,肝细胞无脂肪变性、细胞质丰富、细胞核位于细胞中央(图1C)。
CDG:喂食DDTs后,肝细胞胞质内充满大小不等的脂肪油滴颗粒,肝细胞内大脂滴将细胞核挤向一侧,少数肝细胞出现水样变性。肝脏细胞出现纤维化的趋势(图1B)。
ADG:大鼠喂食DDTs经有氧运动后,脂肪颗粒逐渐减少,至45天时大部分细胞接近正常细胞结构,受DDTs毒害作用引起的局部细胞纤维化现象也逐渐的消失(图1A)。
3.3.3 有氧运动对喂养DDTs大鼠肝脏超微结构影响
CON(图2):大鼠肝脏细胞线粒体结构完整,并呈椭圆形或圆形;粗面内质网聚集,平行排列,线粒体内基质较多、峭呈管状,清晰可见(图2:C1、C2);细胞核完整呈椭圆形,含有弥散的染色质、细胞内细胞器较丰富、细胞膜未见破损、线粒体分布较密集且完好无损、数个内质网聚集在一起镶嵌在线粒体周围、细胞质间有少量脂滴分布(图2:C3、C4、C5、C6);表面微绒毛分布密集,内质网上核糖体分布较多,细胞质间有较多糖原分布(图2:C7、C8)。

图1 本研究大鼠肝脏HE染色后组织结构图

图2 本研究CON大鼠肝脏超微结构图
CDG(图3):喂食DDTs至15天后大鼠肝脏超微结构与正常大鼠肝脏相比,细胞核完整、呈长椭圆形,含有弥散的染色质、细胞内细胞器排列更整齐紧密(B1-1、B1-2、B1-4,×6 000);出现数量不多的凋亡小体(黑色箭头所示B1-3,×6 000);细胞间有大量胶原出现(白色箭头所示B1-5、B1-6,×12 000)。30天时,细胞损伤严重,出现大量的凋亡小体(B2-1、B2-2、B2-3,×15 000),肝脏细胞变形,细胞界限不清,线粒体出现肿胀、模糊不清,细胞内出现较多的脂滴(B2-4、B2-5,×15 000)。45天时,肝脏细胞损伤比较严重,细胞体积缩小,线粒体肿胀、嵴消失,并且分布不均匀,出现空泡(B3-1、B3-3、B3-4、B3-5、B3-7,×12 000);出现髓样小体(红色箭头所示,B3-2、B3-6,×25 000)。

图3 本研究CDG不同时间大鼠肝脏超微结构图
ADG(图4):喂食DDTs后进行有氧运动15天时大鼠肝脏超微结构中,凋亡小体出现(黑色箭头所示),但数量较少(A1-1,×15 000),存在少量脂滴,线粒体和内质网等细胞器的肿胀较轻,细胞基质稀薄,细胞质膜破损,肝窦紊乱(A1-2、A1-3、A1-4、A1-5,×6 000)。30天时,线粒体及内质网等损伤明显减轻,同时部分线粒体、内质网等细胞器的质膜有融合的现象,染色质凝集情况已有明显好转的迹象(A2-1、A2-2、A2-3、A2-4、A2-5,×12 000);45天时,细胞结构基本清晰,线粒体微度肿胀,粗面内质网脱颗粒较轻,脂滴和胆管微绒毛脱失减少,核皱缩和染色质凝集均较DDT实验组有明显改善,大部分细胞基本恢复正常,少数仍出现脂滴现象(A3-1、A3-3、A3-4、A3-5,×15 000)与此同时,出现明显的糖原颗粒,可能是在运动代谢时分解产生(A3-2,×12 000)。
4 讨论
4.1 有氧运动对大鼠DDTs在体内分布及排泄的影响
DDT作为脂溶性物质,其在体内储存与运输主要随脂肪的代谢及转运进行。通常在机体内器官中,肝脏是主要的DDTs储存器官,其次,皮下脂肪、大脑、心脏、血液、皮肤等也有检出[23]。本研究中,在大鼠肝脏、心脏、骨骼肌、血液、粪便等均检出不同浓度的DDTs,表明实验过程中DDT摄入后被分配到大鼠不同器官。生物体在常态下DDTs的积累趋于动态平衡,即在同一生活环境下各个脏器中分布相对固定[24]。本研究CON中DDTs浓度在实验过程中基本稳定,说明实验过程中大鼠基本未受到外界影响,DDTs测试方法稳定。实验中,2周内灌胃DDTs后,大鼠体内DDTs浓度出现较大幅度波动,从而CDG中肝脏、心脏、血液、骨骼肌及粪便中DDTs浓度均出现显著性升高。进行有氧运动干预后,不同组织DDTs浓度变化的规律不尽相同。CDG肝脏中DDTs浓度在停止喂食DDTs后呈逐渐下降趋势,而ADG中则出现浓度先上升后下降的趋势,至运动后期出现DDTs显著下降,说明有氧运动初期促进了DDTs在肝脏中的储存,而运动后期则促肝脏中DDTs的转运,这可能是长期有氧运动促进肝脏增加肝糖原储备、分解肝脏中脂肪储备,从而加速了DDTs的降解[9,26]。心脏中DDTs浓度变化趋势表现为先上升再下降,但是施加有氧运动干预后DDTs浓度变化幅度小于直接喂食DDTs组,表明有氧运动可以降低心脏中DDTs浓度的剧烈波动,促进血液循环进行DDTs的再分配。随着有氧运动的进行,骨骼肌中DDTs浓度呈现逐渐升高的趋势,特别是运动后期显著高于CDG组,表明有氧运动促进提高骨骼肌中氧饱和度,从而利于DDT在有氧环境下转化为DDE[6,21,28]。DDT在环境中的主要降解产物为DDE,少量为DDD。通常认为,在需氧条件下DDT可被脱氯化氢转化为DDE,而在厌氧条件一则可以脱氯降解为DDD。DDE基本没有活性,因此被认为是DDT降解的最终产物。血液中DDTs浓度变化显示,有氧运动对于抑制血液中DDTs浓度的快速上升具有一定的作用,说明有氧运动加速血液中DDTs的转移及降解。CDG中粪便DDTs浓度呈逐渐下降趋势,表明随着DDTs对大鼠机体的毒性发作,其机体排出DDTs的能力逐渐下降;而ADG粪便中DDTs浓度呈现较为稳定的趋势,特别是有氧运动后期DDTs排出量逐渐升高,表明有氧运动能够使大鼠体内DDT均匀排出,减少DDT浓度急性变化对机体的危害。

图4 本研究ADG不同时间大鼠肝脏超微结构图
有氧运动在运动初期能够加速DDTs在肝脏中的富集,减少体内DDTs浓度升高过快造成的影响,而在运动后期能够加速DDTs从肝脏转移至其他器官,从而使DDTs在骨骼肌等器官中被降解、排出。因此,有氧运动通过改变DDTs在体内富集、转移等过程,改变了体内各器官中DDTs的分布,减少DDTs在肝脏内的富集,增加DDTs降解和排出的速度。
4.2 有氧运动对喂养DDT大鼠肝脏氧化应激状态的影响
有研究发现,环境污染物可以影响诸多环境标记物的浓度。DDTs污染后通常可以消耗SOD、CAT等环境中的过氧化物相关酶类从而生成最终代谢产物MDA,因此,MDA常作为环境污染中重要的生物标记物进行检测[7,16]。SOD、CAT及GSH-Px等活性的变化具有组织特异性[19,20]。
本研究中,对喂养DDTs大鼠肝脏的氧化应激状态进行分析,并通过施加有氧运动干预,分析有氧运动对于DDTs引起的大鼠肝脏氧化应激状态的影响。结果发现,DDTs能迅速持续性增加大鼠肝脏中MDA的积累,表明DDTs的摄入导致大鼠肝脏中脂质过氧化反应加剧[18,22]。有氧运动对于MDA的产生在运动早期(15~30天)具有一定的刺激作用,在30天后表现为抑制作用,表明长时间有氧运动有效降低DDT在肝脏内积累引起的氧化损伤。有氧运动干预后,引起大鼠肝脏SOD、CAT、GSH-Px活性不同程度的上升,但是规律不尽相同。SOD活性变化主要表现为运动后期30~45天,而CAT、GSH-Px活性升高主要出现在运动前期15~30天,表明有氧运动对氧化应激相关酶活性提高表现出一定的时序性。
4.3 有氧运动对喂养DDT大鼠肝脏组织结构和超微结构影响

DDT摄入影响肝脏超微结构,这种影响随着DDTs在肝脏中积累的数量而加重,施加有氧运动干预后,在初期对超微结构改变情况不明显,但是后期(45天)能明显改善DDTs摄入引起的超微结构的变化,说明有氧运动对DDTs摄入引起的超微结构的变化具有改善作用。
5 结论
1.中等强度有氧运动通过改变DDT在体内分布,减少了DDT在肝脏中的富集,但增加了运动初期心脏和骨骼肌中DDT分布,促进运动后期DDT排出体外的速度。
2.中等强度有氧运动可改善肝脏的氧化应激状态,有利于提高运动过程中SOD活性,提高运动初期肝脏中GSH-Px、CAT活性,在运动晚期有利于降低MDA的含量。
3.中等强度有氧运动能有效降低由于DDT摄入导致的肝组织肿大,有利于恢复DDT富集引起的肝组织结构变化。
[1]上官若男,苏全生,尚画雨,等.运动负荷强度与运动疲劳程度量化分级研究进展[J].中国康复医学杂志,2013,28(2):188-192.
[2]王巍,牛燕媚,袁海瑞,等.有氧运动对胰岛素抵抗小鼠骨骼肌脂代谢相关基因表达的影响[J].中国运动医学杂志,2013,32(5):414-419.
[3]BERDANIER C D,DENNIS S K.Effect of exercise on the responses of rats to DDT[J].J Toxicol Environ Health,1977,2(3):651-656.
[4]BOUWMAN H,KYLIN H,SEREDA B,etal.High levels of DDT in breast milk:Intake,risk,lactation duration,and involvement of gender[J].Environ Pollut,2012,170(6):63-70.
[5]CHUGH Y,AGARWAL A K,SANKARANARAYANAN A,etal.Effect of subacute DDT on pharmacokinetics of isoniazid and liver function in rabbits[J].Indian J Exp Biol,1990,28(9):842-844.
[6]GAO B,LIU W B,JIA L Y,etal.Isolation and characterization of an Alcaligenes sp.strain DG-5 capable of degrading DDTs under aerobic conditions[J].J Environ Sci Health B,2011,46 (3):257-263.
[7]GÉRARD-MONNIER D,ERDELMEIER I,RÉGNARD K,etal.Reactions of 1-methyl-2-phenylindole with malondialdehyde and 4-hydroxyalkenals.Analytical applications to a colorimetric assay of lipid peroxidation[J].Chem Res Toxicol,1998,11(10):1176-1183.
[8]GREGORASZCZUK E L,PTAK A,KARNIEWSKA M,etal.Action of defined mixtures of PCBs,p,p'-DDT and its metabolite p,p'-DDE,on co-culture of porcine theca and granulosa cells:Steroid secretion,cell proliferation and apoptosis[J].Reprod Toxicol,2008,26(2):170-174.
[9]GUO R,LIONG E C,SO K F,etal.Beneficial mechanisms of aerobic exercise on hepatic lipid metabolism in non-alcoholic fatty liver disease[J].Hepatobiliary Pancreat Dis Int,2015,14(2):139-144.
[10]HARADA T,YAMAGUCHI,OHTSUKA R,etal.Mechanisms of promotion and progression of preneoplastic lesions in hepatocarcinogenesis by DDT in F344 rats[J].Toxicol Pathol,2003,31(1):87-98.
[11]HOKARI F,KAWASAKI E,SAKAI A,etal.Muscle contractile activity regulates Sirt3 protein expression in rat skeletal muscles[J].J Appl Physiol,2010,109(2):332-340.
[12]HU W,HUANG B,ZHAO Y,etal.Distribution,sources and potential risk of HCH and DDT in soils from a typical alluvial plain of the Yangtze River Delta region,China[J].Environ Geochem Health,2014,36(3):345-358.
[13]JIN X,CHEN M,SONG L,etal.The evaluation of p,p'-DDT exposure on cell adhesion of hepatocellular carcinoma[J].Toxicol,2014,322(1):99-108.
[14]KAZANTSEVA Y A,YARUSHKIN A A,PUSTYLNYAK V O.Dichlorodiphenyltrichloroethane technical mixture regulates cell cycle and apoptosis genes through the activation of CAR and ERα in mouse livers[J].Toxicol Appl Pharmacol,2013,271(2):137-143.
[15]LA M M,KAREY E,MOSHIER,etal.Perinatal exposure of mice to the pesticide DDT impairs energy expenditure and metabolism in adult female offspring[J].PLoS One,2014,9(7):1-11.
[16]LACOSTE A,JALABERT F,MALHAM S K,etal.Stress and stress-induced neuroendocrine changes increase the susceptibility of juvenile oysters (Crassostrea gigas) to Vibrio splendidus[J].Appl Environ Microbiol,2001,67(5):2304-2309.
[17]LIND P M,PENELL J,SALIHOVIC S,etal.Circulating levels of p,p'-DDE are related to prevalent hypertension in the elderly[J].Environ Res,2014,129(2):27-31.
[18]LUNA-ACOSTA A,BUSTAMANTE P,BUDZINSKI H,etal.Persistent organic pollutants in a marine bivalve on the Marennes-Oléron Bay and the Gironde Estuary (French Atlantic Coast)-Part 2:Potential biological effects[J].Sci Total Environ,2015,514:511-522.
[19]LUNA-ACOSTA A,RENAULT T,THOMAS-GUYON H,etal.Detection of early effects of a single herbicide (diuron) and a mix of herbicides and pharmaceuticals (diuron,isoproturon,iburpofen) on immunological parameters of Pacific oyster (Crassostrea gigas) spat[J].Chemosphere,2012,87(11):1335-1340.
[20]LUNA-ACOSTA A,THOMAS-GUYON H,AMARI M,etal.Differential tissue distribution and specificity of phenoloxidases from the Pacificoyster Crassostrea gigas[J].Comp Biochem Physiol B Biochem Mol Biol,2011;159(4):220-226.
[21]PETERS B,BALLMANN C,MCGINNIS G,etal.Graded hypoxia and blood oxidative stress during exercise recovery[J].J Sports Sci,2015,14(3):1-11.
[22]RICHARDSON B J,MAK E,DE L S B,etal.Antioxidant responses to polycyclic aromatic hydrocarbons and organochlorine pesticides in green-lipped mussels (Perna viridis):Do mussels “integrate” biomarker responses[J].Mar Pollut Bull,2008,57 (6-12):503-514.
[23]ROBINSON O,WANT E,COEN M,etal.Hirmi Valley liver disease:A disease associated with exposure to pyrrolizidine alkaloids and DDT[J].J Hepatol,2014,60(1):96-102.
[24]ROMANI.Organochlorine contaminants in tissues ofcommon bottlenose dolphins Tursiops truncatusfrom the northeastern part of the Adriatic Sea[J].Environ Toxicol Pharmacol,2014,38 (2):469-479.
[25]SARI A A,TACHIBANA S,LIMIN S G.Enhancement of ligninolytic activity of trametes versicolor U97 pre-grown in agricultural residues to degrade DDT in soil[J].Water Air Soil Pollut,2013,224(7):1616-1624.
[26]SHEPHARD R J,JOHNSON N.Effects of physical activity upon the liver[J].Eur J Appl Physiol,2015,115(1):1-46.
[27]SHIMADA Y,TOMITA M,YOSHIDA T,etal.Inhibition of lipopolysaccharide-induced liver injury in rats treated with a hepatic drug-metabolizing enzyme inducer p,p'-DDT[J].Exp Toxicol Pathol,2015,67(3):245-251.
[28]SUDHARSHAN S,NAIDU R,MALLAVARAPU M,etal.DDT remediation in contaminated soils:A review of recent studies[J].Biodegradation,2012,23 (6):851-863.
[29]TO.Distribution of dermally absorbed 14C-DDT in the organs of Wistar rats[J].Ann Agric Environ Med,2002,9(2):215-223.
[30]TREVASKIS N L,TSO P,RIDER T,etal.Tissue uptake of DDT is independent of chylomicron metabolism[J].Arch Toxicol,2006,80 (4):196-200.
[31]TSANG H L,WU S,LEUNG C K,etal.Body burden of POPs of Hong Kong residents,based on human milk,maternal and cord serum[J].Environ Int,2011,37(1):142-151.
[32]TURUSOV V,RAKITSKY V,TOMATIS L.Dichloro-diphenyl-trichloroethane(DDT):Ubiquity,persistence,and risks[J].Environ Health Perspect,2002,110(2):125-128.
[33]WAFO E,SARRAZIN L,DIANA C,etal.Accumulation and distribution of organochlorines (PCBs and DDTs) in various organs of Stenella coeruleoalba and a Tursiops truncatus from Mediterranean littoral environment (France)[J].Sci Total Environ,2005,348(1-3):115-127.
[34]WANG Y,HE W,QIN N,etal.Distributions,sources,and ecological risks of DDT-related contaminants in water,suspended particulate matter,and sediments from Haihe Plain,Northern China[J].Environ Monit Assess,2013,185(2):1777-1790.
[35]WONG M H,LEUNG A O,CHAN J K,etal.A review on the usage of POP pesticides in China,with emphasis on DDT loadings in human milk[J].Chemosphere,2005,60(6):740-752.
The Changes of DDT Accumulation Metabolism,Liver Oxidative Stress and Structure Intervened by Moderate Intensity Exercise
LI Ke-feng1,DONG Gui-jun1,ZHU Xiao-hua2,LI Li1,ZHOU Xing-zhong1,3,WANG Yu-zhan1,ZHENG Shu-qian1,4,GE Xin-fa1,HAN Yong1,HU Yi-ping1
Objective:To reveal the influence of aerobic exercise on DDT accumulation metabolic rules,changes of oxidative stress and structure in liver induced by DDT under the background of national fitness.Methods:90 male Wistar rats were randomly assigned into control group (CON),placebo group (PG),aerobic exercise group (AG),CON with DDT group (CDG) and aerobic exercise with DDT group (ADG).CDG and ADG were fed with DDT solution according to 40 mg/kg body weight for 2 weeks;ADG and AG were exercised with 18 m/min speed movement for 30 min every day.During 15d,30d and 45d after exercise,DDT concentration was investigated by gas chromatography after grinding and freeze-drying and the distribution of DDT in different organizations were studied;the activities of SOD,GSH-Px and CAT were evaluated by xanthine oxidase method,enzyme kinetic method and visible light method respectively,the MDA content was determined with glucosinolates barbituric acid colorimetric method.The live samples were stained with HE for liver biopsy,and uranium acetate,citrate for liver ultrastructure,then observed and took photos with DP70 digital microscope imaging system and Tecnai Spirit transmission electron microscope and imaging system (120 kv).Results:DDT concentrations decreased gradually in CDG liver,whereas it rose first and then fell in ADG liver.DDT concentrations in ADG liver were significantly higher than that in CDG from 15d to 30d (P<0.01),and lower than the CDG at 45d (P<0.05).Compared with the CDG,DDT concentrations in ADG heart showed a significant rise at 15d and 45d,and a significant decline at 30d.DDT concentrations in CDG skeletal muscle decreased gradually but rose in ADG.From 15d to 30d,DDT concentrations in ADG blood was significantly lower than that in CDG(P<0.01).DDT concentrations in CDG feces declined gradually but were relatively stable in ADG feces.Aerobic exercise can promote SOD activity in ADG from 15d to 45d which was significantly higher than that of the CDG (P<0.05),increase MDA content within 15-30d significantly (P<0.05) and decline it significantly after 30d (P<0.05),activate GSH-Px and CAT activity within 15d and 30d after feeding DDT(P<0.05) and inhibit it significantly at 45d (P<0.05).DDT intake affected liver ultrastructure,and the damage was aggravating with the accumulation of DDT.The changes of ultrastructure induced by DDT accumulation could be improved with aerobic exercise intervention (45d).Conclusion:Aerobic exercise can change the distribution of DDT in rats,reduce the concentration of DDT in liver,but increase the DDT distribution in heart and skeletal muscle during the early exercise period and increase the speed of DDT discharge for a long time exercise;Aerobic exercise can improve liver oxidative stress,particularly benefit the changes of oxidative stress at the early movement.Aerobic exercise is conducive to tissue recovery induced by the DDT enrichment.
aerobicexercise;rat;DDTmetabolism;liver;oxidativestress
2015-05-11;
2015-10-26
山东省高等学校科技计划项目(J12LE04)。
李可峰(1978-),女,山东即墨人,副教授,博士,硕士研究生导师,主要研究方向为运动训练适应的分子机制,Tel:(0531)89655085,E-mail:jmlikefeng@163.com;董贵俊(1978-),男,山东莒县人,教授,博士,博士研究生导师,主要研究方向为运动与慢性病的分子机制,Tel:(0531)89655058,E-mail:donggj@163.com。
1.山东体育学院,山东 济南 250102;2.国家地质实验测试中心,北京 100037;3.山东华宇工学院,山东 德州 253034;4.潍坊护理职业学院,山东 潍坊 262500 1.Shandong Sport University,Jinan 250102,China;2.National Research Center for Geoanalysis,Beijing 100037,China;3.Shandong Huayu University of Technology,Dezhou 253034,China;4.Weifang Nursing Vocational College,Weifang 262500,China.
1000-677X(2015)12-0041-11
10.16469/j.css.201512006
G804.7
A
