荧光染料中间体3,6-二氯-苯三甲酸酐的合成方法改进*
2015-02-13武祥龙牛小玲
田 敏,武祥龙,张 改,牛小玲
(1.西安工业大学 材料与化工学院,西安710021;2.西北工业大学 生命学院,西安710072)
荧光素及罗丹明染料因其具有生物活性的共轭氧杂蒽环基团而越来越受到人们的广泛关注[1],已被广泛应用于分子生物、微生物、生物化学及分析化学中,主要用于传感器[2],光敏剂[3]和毒性蛋白酶的标记[4-5]等.随着应用的广泛性发展,对荧光探针染料的性能要求也越来越高,针对现有荧光素类探针均有较小的斯托克斯位移,样品背景对荧光干扰相对较大的问题,在氧杂蒽环基团上取代氯原子,可以进一步增强其荧光特性,另外还可以使吸收波波长和发射波波长相比一般的荧光类化合物变得更窄,Stokes位移增大,减少了样品背景对荧光干扰,更有利于分析,这个特性在分析具有荧光的标记分子的混合物有很重要的作用[6-7].
苯三酸酐是合成氧杂蒽环的重要中间体,本文在苯三酸酐上引入两个氯原子合成3,6-二氯-苯三甲酸酐.关于3,6-二氯-苯三甲酸的合成文献报道较少,目前报道的主要有两种合成方法:① 经过六步反应得到的2,5-二氯-1,3,4-苯三甲酸[8].步骤太多,产率很低;② 由三步合成[9],重现性差,副产物多,分离提纯不容易,产率较低.本文对第二种方法进行改进,简化了反应,并直接脱水成酸酐得到染料中间体3,6-二氯-苯三甲酸酐,使总产率比原来的文献报道的总产率提高了15%.
1 实验材料及方法
1.1 实验仪器
所有固体试剂熔点采用北京泰克仪器有限公司生产的X-4型数字显微熔点仪(温度计未校正)测定;元素分析由德国艾乐曼元素分析公司生产的Vario ELШCHNOS元素分析仪测定;分子量测定由岛津集团英国克雷斯托分析仪器公司AXIMA-CFR型MALDI-TOF MS质谱仪完成;核磁由美国Varian公司Inova-400型核磁共振仪(TMS作内标)测试 ;高效液相色谱的测定由美国惠普公司生产的HP1100高效液相色谱仪完成;红外数据由美国Nicolet公司生产IS10型红外光谱仪完成.2,5-二氯-对二甲苯,乙酰氯,三氯化铝等其余试剂均为化学纯.
1.2 合成方法
3,6-二氯-苯三甲酸酐合成路线如图1所示.
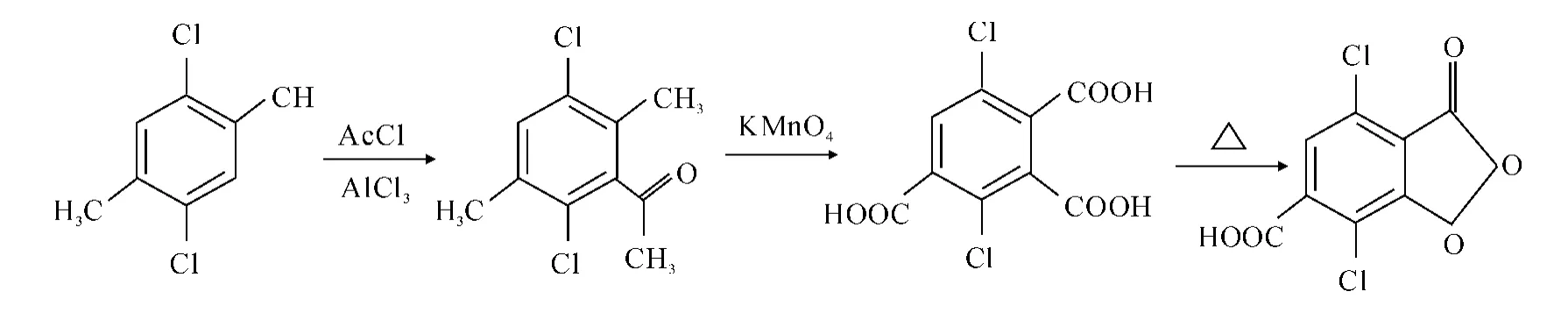
图1 目标产物合成路线Fig.1 Synthetic route for target compound
1.2.1 1-(2,5-二氯-3,6-二甲基苯基)乙酮的合成
在500mL三颈瓶中,加入20g(0.114mol)2,5-二氯-对二甲苯,溶解在350mL无水乙醚的溶液.加入25mL(0.344mol)乙酰氯,加热回流,36.5g(0.343mol)三氯化铝每隔15min分批加入,反应用TLC监测,反应完趁热倒入50mL纯浓盐酸及100g碎冰的混合液中,碎冰溶解完后,溶液分层,取下层,上层再用3×50mL二氯甲烷萃取,合并所有有机相,用无水MgSO4干燥,蒸除溶剂,得黄色液体,用二氯甲烷∶甲醇=50∶1(V/V)过色谱硅胶柱(Rf=0.8),得无色透明液体21.8g.
1.2.2 2,5-二氯-1,3,4-苯三甲酸的合成
将上步所得纯品21.8g(0.100mol)倒入1 000mL的圆底烧瓶中加入500mL水,再加入50g碳酸钾、90g(0.570mol)高锰酸钾.回流4h,冷却,放置过夜.将溶液用6N硫酸调至pH=1,加入草酸直至无色,过滤,滤液用约1 000mL的乙醚萃取,无水硫酸镁干燥,蒸除溶剂得12.3g白色固体.
1.2.3 2,5-二氯-1,3,4-苯三甲酸酐的合成
将上步氧化后的2,5-二氯-1,3,4-苯三甲酸放在500mL三口瓶中,通机械搅拌,温度升至160℃,TLC监测,反应约2h,得淡黄色固体10.6g.
2 结果与分析
2.1 化合物的表征结果
1-(2,5-二氯-3,6-二甲基苯基)乙酮为无色透明液体,产率为88%.产物1HNMR以CDCl3为溶剂,测定出化学位移δ7.26单峰表示苯环上未被取代的氢,δ2.526单峰表示乙酰基上的甲基氢,δ 2.328单峰表示和乙酰基相邻的苯环上甲基氢,δ2.225单峰表示苯环另一个甲基氢.MS显示分子离子峰m/z为216[M-1],与计算值相符.IR以KBr压片:1 661cm-1处出现的峰位C=O伸缩振动,1 277cm-1处出现的峰为C=C双键的伸缩震动,910cm-1所出现的峰位C-H面的外弯曲振动,709cm-1处出现的峰为C-Cl键的伸缩振动.元素分析 (C10H10Cl2O)显 示 实 测 值 为C(55.33%)、H(4.64%),与计算值为C(55.36%)、H(4.67%)基本相符.
2,5-二氯-1,3,4-苯三甲酸为白色固体,产率为45%.熔点228~230 ℃(文献值[7]为232~233℃).1HNMR以d6-DMSO为溶剂,化学位移δ13-15宽峰表示三个羧基氢,δ8.001单峰表示苯环未被取代的氢.HPLC图谱显示2,5-二氯-1,3,4-苯三甲酸含量为99.6%.IR 以 KBr压片:3 384 cm-1的谱带为羟基(-OH)的伸缩振动,在1 735 cm-1的谱带为羰基(C=O)的伸缩振动,在1 672 cm-1的谱带为苯环的振动,在763cm-1、703cm-1的谱带分别为C-H面外弯曲振动和C-Cl的伸缩振动.元素分析(C9H4Cl2O6)显示实测值为C(38.74%)、H(1.45%),与计算值为C(38.76%)、H(1.47%)基本相符.
2,5-二氯-1,3,4-苯三甲酸酐为淡黄色固体,熔点231~232℃,产率为98%,1HNMR以d6-DMSO为溶剂,化学位移δ13单峰为羧基氢,δ8.12单峰为苯环氢.HPLC图谱显示2,5-二氯-1,3,4-苯三甲酸酐含量为99.8%.IR以KBr压片:3 217 cm-1的谱带为羟基(-OH)的伸缩振动,1 841 cm-1的谱带为羰基(C=O)的伸缩振动,1 153 cm-1的谱带为C-O键的伸缩振动,943cm-1的谱带为C-Cl的伸缩振动.元素分析(C9H2Cl2O5)显示实测值为C(41.41%)、H(0.77% ),与计算值C(41.43%)、H(0.80%)基本相符.
2.2 2,5-二氯-3-乙酰基对二甲苯合成的影响
2.2.1 时间对反应的影响
在合成过程中,时间对产物产率的影响非常明显,时间过长会导致二取代产物(Rf=0.6)点明显增加,时间过短,原料点反应不完全,导致2,5-二氯-3-乙酰基对二甲苯的产率过低.由图2可知,加热回流26h时的产率最高,即为2,5-二氯-3-乙酰基对二甲苯合成的最佳反应时间.
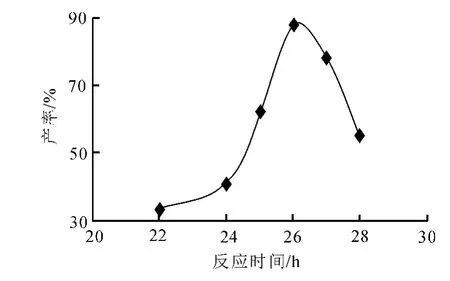
图2 反应时间对产率的影响曲线Fig.2 Effect curve of reaction time on yield
2.2.2 反应物配比对反应的影响
本文考察了反应物2,5-二氯-对二甲苯和乙酰氯不同配比对产物产率的影响,由图2可以看出,开始1-(2,5-二氯-3,6-二甲基苯基)乙酮的产率会随着乙酰氯用量增大而不断增大,但当乙酰氯的摩尔百分比超过75%,即2,5-二氯-对二甲苯:乙酰氯为1∶3时产率开始逐渐下降.薄层色谱监测当配比超过1∶3之后二取代产物点明显增加,而低于1∶3时,因原料浓度过低,反应缓慢,则导致2,5-二氯-3-乙酰基对二甲苯的产率低.由图3可知,乙酰氯的最佳摩尔百分比为75%,即2,5-二氯-对二甲苯∶乙酰氯为1∶3,配比最佳.
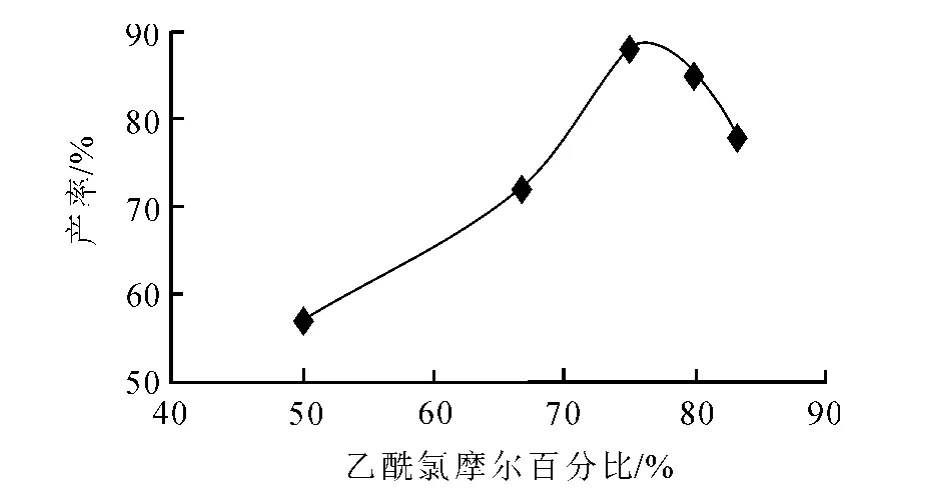
图3 反应配比对产率的影响曲线Fig.3 Effect curve of reaction ratio on yield
2.2.3 溶剂对反应的影响
在第一步合成中,依照文献[9],采用1,2-二氯乙烷作溶剂,发现产率并不高,而且重现性差,因此在本实验中,选取了不同的反应体系,考察不同溶剂对产物产率的影响,见表1.
文献[9]第一步采用1,2-二氯乙烷作溶剂,本文重复此实验得到粘稠液体,很难分离,且产物很少.本文更换了溶剂,采用四氯化碳作溶剂,发现产率更低,因此可以判别含氯溶剂会参与反应,使副产物增多,难于提纯.针对这个问题,更换两种不含氯的介质(甲苯和无水乙醚),发现产率提高了,且无水乙醚提高得更明显.
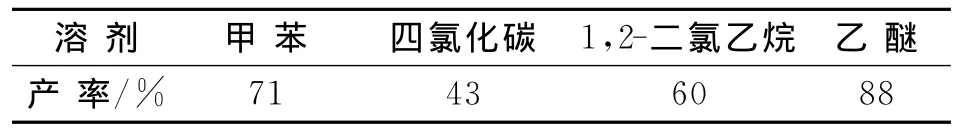
表1 不同介质对产率的影响Tab.1 Effects of different media on the yield
2.3 脱水方式对2,5-二氯-1,3,4-苯三甲酸酐合成的影响
文献报道酸转化为酸酐的方法是采用乙酰氯或乙酸酐做吸水剂脱水,本文以乙酰氯为脱水剂,参照文献合成,得到产率为90%[10],文献方法存在反应操作繁琐,后处理麻烦,产物损失较大,而本文用直接干法加热,避免了这一问题,原料几乎全部转化为酸酐,且不用洗涤,从而避免产品损失.
3 结 论
本文对荧光染料中间体3,6-二氯-苯三甲酸酐的合成方法进行了改进.经过改进条件使反应三步总产率比相关文献报道值高出15%.结论为
1)考察了2,5-二氯-3-乙酰基对二甲苯合成时间对产率的影响,得到最佳反应时间26h.
2)考察了2,5-二氯-3-乙酰基对二甲苯合成中2,5-二氯-对二甲苯和乙酰氯不同配比对产率的影响,得到最佳配比为2,5-二氯-对二甲苯:乙酰氯等于1∶3.
3)采用不含氯的无水乙醚作为溶剂,产率由原来的60%提升到88%.
4)针对普通的成酐法是用乙酰氯或乙酸酐做吸水剂,有副产物影响产率且后处理麻烦,本文采用而直接干法加热脱水成酐,操作简单,产率可由原来的90%提升到98%.
[1] SUN W C,GEE K R,KLAUBERT D H,et al.Synthesis of Fluorinated Fluoresceins[J].Journal of Organic Chemistry ,1997,62(19):6469.
[2] ZHANG J F,ZHOU Y,YOON J,et a1.Naphthalimide Modified Rhodamine Derivative:Ratiometric and Selective Fluorescent Sensor for Cu2+Based on Two Different Approaches[J].Organic Letters,2010,12(17):3852.
[3] SUN L P,LI Y D,QI J W,et al.Changes of Optical Properties of Rhodamine 6GInduced by Illumination Time in Anodized Aluminum Oxide Films[J].Journal of Optoelectronics Laser,2011,22(6):864.
[4] URANO Y,KAMIYA M,KANDA K,et al.Evolution of Fluorescein as a Platform for Finely Tunable Fluorescence Probes [J].Journal of the American Chemical Society,2005,127(13):4888.
[5] JIAO G S,THORESEN L H,BURGESS K.Fluorescent,Through-bond Energy Transfer Cassettes for Labeling Multiple Biological Molecules in One Experiment[J].Journal of the American Chemical Society,2003,125(48):14668.
[6] TIAN M,WU X L,ZHANG B,et al.Synthesis of Chlorinated Fluoresceins for Labeling Protein[J].Bioorganic& Medicinal Chemistry Letters,2008,18(6):1977.
[7] WU X L,JIN X L,WANG Y X,et al.Synthesis and Spectral Properties of Novel Chlorinated PH Fluorescent Probes[J],Journal of Luminescence,2011,131(4):776.
[8] KHANNA P L,ULLMAN,E F.Novel Ether Substituted Fluorescein Polyamino Acid Compounds as Fluorescers and Quenchers:United States,US4318846A[P].(1982-03-09)[2015-02-05].https://static.glgoo.com/patents/US4318846.
[9] MATTHEWH L,TIM G C;RONALM C.Improved Synthetic Procedures for 4,7,2’,7’–TetraChloroand4’,5’-Dichloro-2’,7’-Dimethoxy-5(and 6)-Carboxyfluoresceins[J].Organic Process Research & Development,2001(5):45.
[10] 赵继芳,孔庆江.偏三甲苯气相空气氧化法制备偏苯三甲酸酐[J]化学与粘合,2004(3):148.ZHAO Ji-fang,KONG Qing-jiang.Preparation of Trimellitic Anhydride by Gas Air-oxidation[J].Chemistry and Adhesion,2004(3):148.(in Chinese)
