生态因子对红螯相手蟹捕食毛蚶苗种的影响
2015-02-07高霄龙邱兆星郑永允
高霄龙, 李 莉, 邱兆星, 郑永允, 李 琪,*
1 中国海洋大学水产学院, 青岛 266003 2 山东省海洋生物研究院, 青岛 266104
生态因子对红螯相手蟹捕食毛蚶苗种的影响
高霄龙1, 李 莉2, 邱兆星2, 郑永允2, 李 琪1,*
1 中国海洋大学水产学院, 青岛 266003 2 山东省海洋生物研究院, 青岛 266104
敌害生物的捕食在控制海洋底栖生物群落的丰度和组成中起着关键性的作用。以红螯相手蟹(Sesarmahaematocheir)和毛蚶(Scapharcasubcrenata)为试验对象,研究了红螯相手蟹的密度、规格、性别,以及毛蚶的密度、规格、海水温度和底质条件对毛蚶苗种存活的影响。结果表明,蟹表现出了第二种类型的功能反应,高密度底播毛蚶苗种可以显著提高成活率;当毛蚶苗种壳长达到20mm以上时,蟹的摄食速率显著下降;随着蟹个体的增大,其摄食速率显著增加,毛蚶的存活率下降;当蟹的密度逐渐增加的时候,同种个体之间的干扰竞争显著提高了毛蚶存活率;雄蟹凭借强有力的螯导致了更多毛蚶苗种的死亡;海水温度较低的春季和秋季底播毛蚶苗种可以显著提高成活率;底质条件的复杂性和异质性为毛蚶的存活提供了“庇护空间”,从而减少了敌害生物捕食所带来的损失。
红螯相手蟹(Sesarmahaematocheir); 毛蚶(Scapharcasubcrenata); 密度; 规格; 性别; 温度; 底质
毛蚶(Scapharcasubcrenata)是我国重要的海水经济贝类,隶属于瓣鳃纲、翼形亚纲、蚶目、蚶科。近年来随着人们生活水平的不断提高,对海产品的需求量也不断增大。毛蚶因其肉味鲜美、营养价值丰富、产量高,因而广受消费者和养殖户的青睐。2010年,我国蚶类产量达到310380t,比2009年增加33638t,养殖面积超过75714hm2,比前一年增长6915 hm2[1],其养殖产业得到了迅猛发展。但是由于过度捕捞以及栖息地环境的破坏,毛蚶野生资源严重衰退。为了满足市场和资源保护的需要,国内已经开展了大规模的苗种繁育和底播增殖放流工作。
增殖放流是养护渔业资源和改善水域生态环境的一项重要手段,放流的苗种可以利用天然饵料,即节省养殖成本,又可在较短时间内达到可捕规格。然而,许多研究都已经证明浅海底栖敌害生物的捕食会对双壳贝类的底播增殖产生不利影响[2- 3]。红螯相手蟹(Sesarmahaematocheir)是一种小型的浅海底栖甲壳动物,广泛分布于中国、日本、韩国温带海区的潮间带[4]。正如其它贪食性蟹类一样,红螯相手蟹捕食各种底栖生物,包括腹足类、双壳类、藤壶、多毛类等[5]。被捕食者的存活取决于许多因素,例如被食者的密度、大小[6- 7],捕食者的密度、规格、性别[8- 9],以及底质条件的复杂性[10]和水体温度。因此,理解捕食者和被食者之间的相互作用关系对成功进行底播增殖和资源保护有重要的意义。在本实验中,分别选取了泥质底和砂砾质底两个不同的试验地点,研究了毛蚶的密度、规格,以及红螯相手蟹的密度、规格、性别和水体温度等因素对毛蚶存活的影响,以期查清捕食者和被食者之间的行为机制和相互作用关系,确定底播毛蚶苗种较适宜的规格、密度、区域、季节,从而尽可能减少敌害生物捕食所带来的损失。
1 材料与方法
1.1 实验材料
红螯相手蟹采捕于青岛市城阳区沿岸滩涂,毛蚶苗种来自日照市福源育苗场。选择潮间带和池塘两个不同底质的实验地点研究敌害生物捕食对毛蚶存活的影响,实验池塘水深0.5m,水温16.5℃,溶解氧6.10mg/L,pH值8.42,盐度30.56。该池塘通过闸门与邻近海区连通,依靠潮水的涨落换排水,每日换水两次,底质以砂、砾、贝壳碎片为主;而潮间带区域底质以泥质底为主,有多种小型沿岸蟹类栖息,每日有两次涨潮与落潮,满潮时滩涂水深0.62m,水温14.8℃,溶解氧6.25mg/L,pH值8.2,盐度30.89。
实验用毛蚶苗种和红螯相手蟹分别暂养于池塘中的圆形网箱中(直径1.2m,高0.3m)。由于蟹在蜕皮过程中不摄食,因此计数过程中蜕皮蟹的数据被剔除,同时对蟹的性别进行区分。为了标准化饥饿水平,实验开始前将红螯相手蟹饥饿48h。实验开始后将圆柱形地笼(半径0.4m,高0.3m,底面积0.5m2,网目2mm)放置于池塘和滩涂上,使地笼底部埋于砂砾或泥中大约50mm,而后分别把砂砾和软泥装入地笼底部,使其厚度也达到50mm。毛蚶苗种放入地笼后12h,将红螯相手蟹放入地笼中,并使用沉子将地笼固定。
1.2 不同毛蚶放养密度和规格对其存活率的影响
为研究不同放养密度毛蚶(壳长(12.60±0.85)mm)存活率的影响,将毛蚶分为5个不同的密度组,即5、10、20、30、40个/0.5m2,每0.5m2内均放置1只红螯相手蟹(甲壳宽(25.20±0.60)mm;体重(8.48±0.63)g),每一密度组设有4个平行和1个对照组。
为研究毛蚶不同规格对其存活率的影响,将毛蚶分为3个不同的规格组,即壳长(6.36±0.80)mm、(12.60±0.85)mm和(29.30±1.60)mm,每0.5m2内放置1只红螯相手蟹和20个同一规格的毛蚶,每一规格组设有4个平行和一个对照组(笼内不放置红螯相手蟹)。以上实验持续24 h,而后将地笼取出,计数被蟹摄食的毛蚶数量,以便计算存活率。
1.3 红螯相手蟹的个体规格、密度和性别对毛蚶存活率的影响
为研究红螯相手蟹的个体规格对毛蚶存活率的影响,将蟹分为3个不同的规格:甲壳宽分别为(21.50±1.21)mm,(25.20±0.60)mm和(31.00±1.16)mm,毛蚶壳长为(12.60±0.85)mm(在该海区进行的野外滩涂放流预试验证明此规格毛蚶下潜能力较强,自然死亡率低),每0.5m2内放置20个毛蚶和1只某一规格的蟹,每一不同规格组设有4个平行和1个对照组。
在红螯相手蟹不同密度对毛蚶苗种存活影响的实验中,实验蟹甲壳宽(25.20±0.60) mm,毛蚶壳长(12.60±0.85)mm。蟹被分为4个不同的密度组:1、2、4、8/0.5m2,每一密度组内放置毛蚶20个体,设置4个平行组和1个对照组。
在红螯相手蟹的性别对毛蚶存活率影响的实验中,雌雄蟹甲壳宽为(25.20±0.60)mm,毛蚶壳长为(12.60±0.85)mm,每0.5m2内放置1只雌蟹或1只雄蟹和20个毛蚶,不同性别组设有4个平行和1个对照组;实验持续24 h。
1.4 不同温度对毛蚶存活率的影响
实验海水温度为11℃、16℃和21℃,每一温度组放置1只红螯相手蟹(甲壳宽(25.20±0.60)mm)和30个毛蚶(壳长(12.60±0.85)mm),设置4个平行和一个对照组,实验持续24 h。
1.5 数据处理
实验数据用平均值±标准误表示,采用SPSS16.0 软件进行双因素(在不同的底质条件下进行毛蚶不同放养密度和规格、红螯相手蟹不同密度和规格、蟹的不同性别、不同温度的试验)方差分析(Two-way ANOVA),并用Duncan进行多重比较分析,设置P<0.05为差异显著。
2 结果
2.1 毛蚶不同放养密度和规格时的存活率
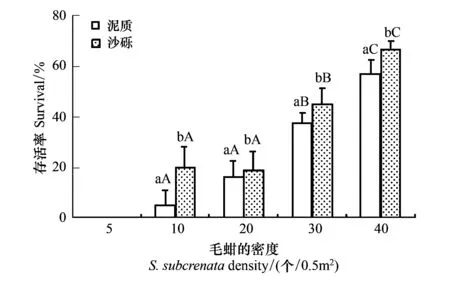
图1 不同放养密度对毛蚶存活的影响
不同放养密度对毛蚶存活有显著性影响,随着毛蚶密度的增加,其存活率也显著增加(P<0.05),但在10和20密度组之间毛蚶的存活率并没有显著性差异,在40密度组中毛蚶的存活率达到最高(图1)。随毛蚶密度的减少,存活率降低,表明低密度底播苗种会导致低的存活率。两种不同的底质类型对毛蚶存活也有显著的影响(P<0.05),在泥质底中毛蚶的存活率要低于沙砾底中,不同密度和底质类型之间的交互作用没有对毛蚶的存活产生显著性的影响。
随着毛蚶个体增大,其存活率显著升高(P<0.05),在大个体组中只有少数毛蚶被摄食,毛蚶的存活率显著高于小个体组,无论在泥质还是沙砾底质中当苗种壳长达到20mm以上时,存活率均较高且没有显著性差异(图2);毛蚶不同规格和底质类型之间的交互作用并没有对苗种的存活产生显著性的影响(P>0.05)。在泥底区域红螯相手蟹的捕食能力强于在沙砾底中,因此在沙砾底中的毛蚶有显著更高的存活率(P<0.05)。
2.2 红螯相手蟹的不同规格、密度和性别对毛蚶存活的影响
如图3所示,红螯相手蟹的规格对毛蚶存活率有显著影响(P<0.05),随着红螯相手蟹个体的增大其捕食能力明显增强,而毛蚶的存活率则显著下降,大个体的红螯相手蟹导致了更多毛蚶苗种的死亡,而在小个体组中毛蚶的存活率则较高。对于毛蚶的存活,不同的底质类型也产生显著的影响 (P<0.05),相对于沙砾底,在泥质底中更多的毛蚶被捕食;红螯相手蟹的不同规格和底质类型之间的交互作用并没有对毛蚶的存活产生显著性的影响(P>0.05)。
不同放养密度的红螯相手蟹对毛蚶的存活产生了显著性的影响(P<0.05,图4);随着笼内红螯相手蟹密度的增加,毛蚶的死亡率降低,红螯相手蟹在高密度放养时彼此间的争斗使毛蚶的存活率显著升高。红螯相手蟹的不同密度和底质类型之间的交互作用并没有对毛蚶的存活产生显著性的影响(P>0.05)。相对于在泥质底中的试验,红螯相手蟹在沙砾底质中捕食了较少的苗种,因而毛蚶的存活率较高(P<0.05),但当红螯相手蟹的密度增加到4或8只/笼时,不同底质类型对毛蚶的存活则没有产生显著性的影响。
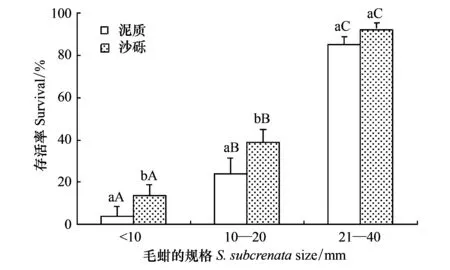
图2 不同的放养规格对毛蚶存活的影响
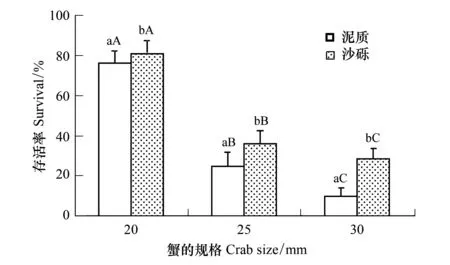
图3 不同放养规格的红螯相手蟹对毛蚶存活的影响
实验结果表明不同性别的红螯相手蟹对毛蚶存活有显著影响(P<0.05),雄蟹凭借强有力的螯在单位时间内能够捕食更多的毛蚶,从而导致苗种存活率下降;而雌蟹较小的螯决定了它必须花费更多的时间捕获和处理毛蚶,所以苗种的存活率较高(图5)。红螯相手蟹的性别和底质类型之间的交互作用对毛蚶存活产生了显著性的影响(P<0.05)。与泥质底中相比,在沙砾底质中雄蟹捕食了较少的苗种,因而毛蚶会有显著较高的存活(P<0.05);然而在雌蟹处理组中,不同的底质类型则没有对苗种的存活产生显著性的影响。
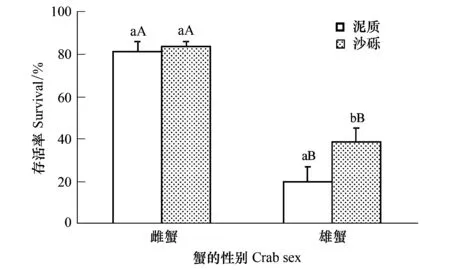
图5 不同性别的红螯相手蟹对毛蚶存活的影响
2.3 不同温度时毛蚶的存活率
不同温度对毛蚶的存活产生显著性的影响(P<0.05),随着温度的逐渐升高,红螯相手蟹的捕食能力增强,在21℃时毛蚶的存活率显著下降(图6)。同时实验结果也表明底质类型对毛蚶的存活有显著性影响(P<0.05),泥质底中毛蚶的存活率显著低于沙砾底中,沙砾质底可能为毛蚶的存活提供了更多的“庇护空间”而增加了红螯相手蟹的搜索时间,从而使毛蚶的存活率升高。不同温度和底质类型之间的交互作用并没有对毛蚶的存活产生显著性的影响(P>0.05)。
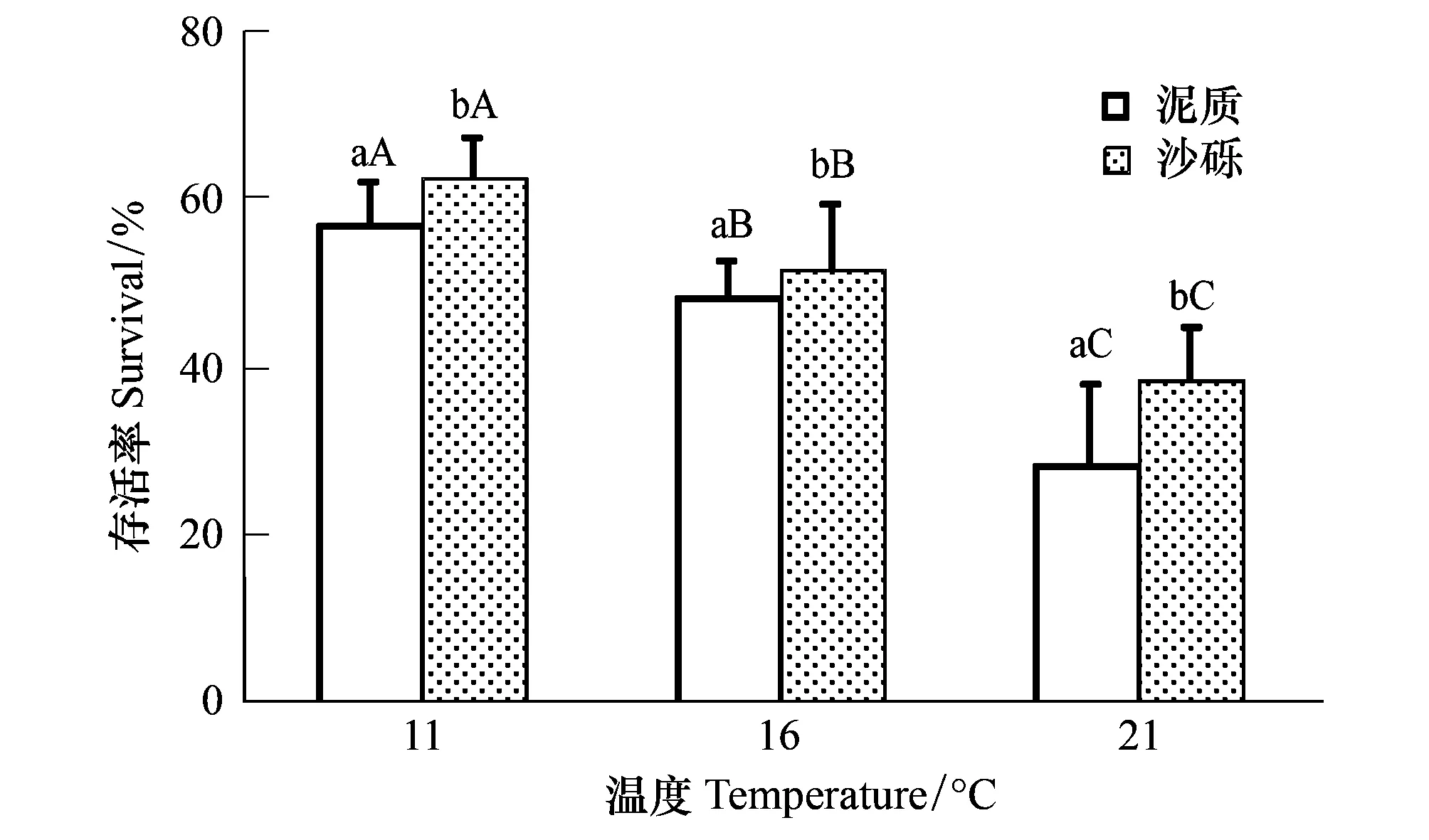
图6 不同温度对毛蚶存活的影响
3 讨论
随着毛蚶密度的增加,毛蚶的存活率显著升高。捕食者在短期内会表现出一种功能反应(即每个捕食者所摄食的被食者的数量与被食者密度有关),对功能反应的区分是非常重要的,因为功能反应的不同类型对被食者种群的稳定性有明显不同的影响。第一种类型的功能反应(线性的、不依赖于密度的)几乎是不常见的,因为大多数的捕食者都会主动的寻找它们的猎物;在第二种功能反应中,随着被食者密度的减少死亡率增加;而在第三种类型的功能反应中,随着被食者密度的降低死亡率下降[11]。根据本实验数据,在低密度组中随着毛蚶密度的降低,死亡率增加,因此就能够确定红螯相手蟹表现了第二种类型的功能反应,在第二种功能反应中,低密度放养毛蚶时红螯相手蟹的捕食能力最强,因此这种捕食是危险的并且可能会导致底播苗种的大规模死亡。在巨大的捕食压力作用下,集群反应可能是逃避捕食的一种有效地方式,因为集群反应即高密度的猎物聚集会减少死亡。例如,地中海贻贝(Geukensiademissa)通过聚集成捕食者很难袭击的团块形状从而逃避捕食[12],而当美洲牡蛎(Crassostreavirginica)高密度聚集成团块状时也较少受到捕食者的攻击[13- 14]。在这个实验中,随着放养密度的增加,很多毛蚶个体在高密度组中并没有被捕食。然而高密度的底播贝类苗种也可能会导致捕食者的大量聚集,因为蟹是非常善于运动的高效捕食者,同时高密度的底播苗种也使猎物增加了种内对生存空间和饵料生物的竞争。许多研究都证明苗种在放流以后由捕食所导致的死亡数立刻就会达到最高,因此必须要确定捕食者的功能反应类型和集群反应,在放流前充分调查捕食者的丰度和分布,根据捕食者的丰度和分布采取不同的应对措施,例如选择捕食者密度较低的放流区域,或者甚至可以在放流前将敌害生物进行诱捕移除。
在小个体毛蚶处理组中,红螯相手蟹的捕食能力明显更强,而大个体的毛蚶则表现了相对较高的存活。蟹能够捕食的猎物个体规格取决于螯的大小和生物力学机制,螯的间隙决定了蟹能够捕食的猎物的最大规格[15- 16]。 Boulding等[17]发现贝壳能否被蟹轻易压碎取决于贝壳的特点,包括贝壳大小、厚度、膨胀度以及两壳间是否存在间隙。对大个体毛蚶而言,蟹很难直接压碎其坚硬的外壳,而聪明的捕食者通常会选择“边缘切割”的摄食策略,因而在实验结束后发现许多贝壳的边缘都是破碎不完整的。也就是说随着贝类的逐渐生长,贝壳的厚度和硬度都增加了,当长到某一规格时,“大小的庇护”就实现了。然而在许多猎物的选择实验中,不同规格的猎物和捕食者被一起放在同一个实验容器中,贝壳形态学上的差异并不是解释较大个体存活率较高的唯一原因。许多软体动物的捕食者喜欢摄食较小的、较少“有利性”(某种特定大小的猎物干重除以处理时间)的猎物,尽管从单位处理时间所获得的能量看较小的猎物并不是最佳的,但从长期看,这种策略却是可取的,因为这减少了损坏摄食附肢的风险。Aronhime和Brown[18]注意到美味优游蟹(Callinectessapidus) 为了减少螯损坏的风险选择较小的Ischadiumrecurvum,或者选择有较短处理时间的猎物以逃避被其它捕食者捕食的风险。因此在底播增殖过程中,放流较大规格的苗种对减少敌害生物的捕食和提高苗种存活率是至关重要的。
在不同规格的捕食者实验中,毛蚶的存活率显示了明显的差异,尽管蟹的个体规格之间差异并不大,但实验结果却表明在摄食相同规格的毛蚶时大个体蟹有明显的优势,螯的大小可能起到了非常重要的作用,限制着蟹能够处理和摄食的苗种规格。在摄食猎物之前,蟹通常会对猎物进行检查以期做出决定是直接压碎贝壳还是采取切割贝壳边缘的摄食策略[19]。蟹通常会采用不同的方法来控制和摄食猎物,例如缺乏强有力的、高度专业化螯的蟹会采取直接将贝壳压碎或边缘切割去暴露肉体部,然后将肉体部从贝壳碎片中分离出来,通过螯运送到口[5]。当蟹想要捕食较大规格贝类时,摄食方法会从直接压碎转为切割贝壳边缘[15],然而来自破碎的贝壳和肉体部碎屑的物理和化学刺激能够吸引更多不同的捕食者,从而干扰捕食者和猎物之间的关系。在小个体和中等个体蟹的处理组中,出现一些被压碎的和有明显被切割痕迹的贝壳,而在大个体蟹的处理组中,地笼底部几乎都是被直接压碎的贝壳碎片。
蟹的不同密度对毛蚶的存活产生了显著不同的影响。当只有一只蟹处于地笼中时,捕食活动不受任何限制,因而导致了毛蚶较高的死亡率。然而当多只蟹存在时,其无法专注于摄食猎物,分散的精力导致毛蚶的存活增加。蟹是一种贪婪的动物,并且当只有一只处于地笼中时其想获得最大的能量摄入,但当多个体存在时,为了获取更多的猎物它们彼此之间往往争斗,而这种同种个体之间的干扰则导致了它们无法摄食或很少摄食。蟹之间争斗的结果可能导致毛蚶的死亡率显著降低,从而提高了放流苗种的成活率。然而,在海洋底栖生态系统中,也发现了捕食者之间争斗的消极影响,例如争斗会使猎物存活率增加,近而加剧对空间和饵料的竞争以至于其它的物种无法生存,并可能导致物种多样性的降低[20]。有两个经验性模型描述了捕食者之间的干扰竞争:一种是喜好模型,即捕食者会优先对其它的捕食者做出反应而不是去摄食;另一种是分散模型,捕食者的注意力分散于猎物和其它的捕食者之间。同种个体之间的集群行为和干扰竞争抑制了摄食,正如在高密度组中所注意到的一些蟹由于打斗失去了螯,而这从长远来看对蟹的存活非常不利。
雌蟹和雄蟹有显著不同的捕食能力,凭借强有力的螯,雄蟹能够捕食更多的猎物;但由于雌蟹的螯较小因此捕获并摄食猎物是相对困难的。螯的间隙决定了蟹能够捕获的猎物规格[15- 16]。雌蟹的螯明显小于雄蟹,由性别所决定的形态学差异性限制了它们分别能够捕获的猎物的规格。蟹的螯在机械学和形态学上特征的差异反应了它们的不同功能,并且也解释了对猎物不同处理方式的原因[21]。在雌蟹处理组中,发现了许多边缘被切割但依然完整的贝壳,被压碎的贝壳碎片数量远远少于雄蟹处理组,这也说明了由于螯的局限性,雌蟹采取了不同的摄食策略。然而在同一栖息地中,雌蟹也可能对猎物的存活表现出明显不利的方面,因为相对较小的螯使得雌蟹能够将某些猎物从狭小的庇护空间中拖拽出来,而这对于较大螯的雄蟹来说则是不可能的[22],因此在放流前调查放流区域的海底条件、特点也是十分重要的。
温度对蟹的摄食产生了显著的影响,随着温度的逐渐升高,在低温条件下潜居的蟹逐渐开始变的活跃起来,逐渐增加的能量消耗需要通过不断增大对食物的摄取来补充,体内新陈代谢的增加也驱使着其去更加主动的搜寻猎物,进而在单位时间内蟹的捕食强度逐渐增大,在21℃时毛蚶的死亡率达到最高,因此在较低温度时底播有利于毛蚶的存活。同时在毛蚶底播增殖的过程中,还要考虑毛蚶较为适宜的环境温度,虽然毛蚶对温度的适应范围为2—28℃[23],但陈建华等[24]总结我国北方地区毛蚶浅海养殖的经验,认为毛蚶底播的时机以春秋两季(4—5月和9—10月)海水温度较低时为宜。这与本实验结果相似,温度较低时不仅蟹的活力低,而且底播毛蚶的存活率较高,因此底播增殖时需要考虑两方面的因素从而确定最佳的放流季节。
由于底质条件的高度复杂性和异质性增加了空间“庇护所”的数量,从而可能有效降低捕食的风险,增加捕食者对猎物的搜索时间并降低二者之间的相遇速率,导致捕食速率降低,猎物的存活率升高。Arnold[25]发现美味优游蟹(C.sapidus)对埋藏在光滑的底质中(泥或泥沙)的硬壳蛤(Mercenariamercenaria)表现了较高的摄食速率,而对由牡蛎壳和沙砾组成的底质中的硬壳蛤的摄食率则较低。Sponaugle and Lawton[26]在圆趾蟹(Ovalipesocellatus) 摄食硬壳蛤(M.mercenaria)的研究中也观察到相似的现象,并且证实了由于底质异质性的增加,蟹对硬壳蛤的搜索时间增加,这可能是由于底质中类似贝壳碎片形状的物质的存在使捕食者很难区分真正的猎物和碎片。猎物有两种方式能够减少捕食者的捕食[27],一种方式是逃避行为,另一种方式是躲避行为。逃避行为较少受到底质类型的影响,尤其像毛蚶在附着变态后并不能像扇贝等物种那样进行游动,因而逃避行为无法保护毛蚶免受敌害捕食的风险。对猎物的搜寻需要化学感受器和机械感受器的结合作用[28],螯和四肢上的嗅毛能够察觉外部不同的刺激并进而做出决定是否对猎物进行捕获和摄食[29],贝壳和砂砾碎屑的存在可能会混淆不同的刺激从而迷惑捕食者做出正确的判断,这样就有可能使猎物能够躲避捕食者的搜索,进而提高存活率。
因此根据本实验的结果,在放流毛蚶苗种时,应事先对放流区域的底质条件进行调查,确定放流区域的底质类型和蟹的丰度、分布以及大小规格;同时为了提高存活率,应在春季或秋季海水温度较低时选择砂质底的区域进行高密度底播,苗种壳长应至少达到20mm,从而减少蟹的捕食对底播毛蚶苗种所带来的损失。
[1] 农业部渔业局. 中国渔业统计年鉴. 北京: 中国农业出版社, 2011: 29- 30.
[2] Quayle D B, Newkirk G F. Farming bivalve molluscs: methods for study and development // Sandifer P A. Advances in World Aquaculture, World Aquaculture Society. Baton Rouge: Louisiana State University, 1989.
[3] Hickman R W. Mussel cultivation // Gosling E. The MusselMytilus: Ecology, Physiology, Genetics and Culture. New York: Elsevier, 1992.
[4] 王克行. 虾蟹类增养殖学. 北京: 中国农业出版社, 1996: 35- 46.
[5] McDermott J J. The western Pacific brachyuranHemigrapsussanguineus(Grapsidae) in its new habitat along the Atlantic coast of the United States: feeding, cheliped morphology and growth // Schramm F R, von Vaupel Klein J C. Crustaceans and the Biodiversity Crisis. Leiden: Brill Press, 1999.
[6] Paine R T. Size-limited predation: an observational and experimental approach with theMytilus-Pisasterinteraction. Ecology, 1976, 57(5): 858- 873.
[7] Whetstone J M, Eversole A G. Effects of size and temperature on mud crab,Panopeusherbstii, predation on hard clams,Mercenariamercenaria. Estuaries, 1981, 4 (2): 153- 156.
[8] Seed R, Hughes R N. Criteria for prey size-selection in molluscivorous crabs with contrasting claw morphologies. Journal of Experimental Marine Biology and Ecology, 1995, 193 (1/2): 177- 195.
[9] Smallegange I M, Van Der Meer J, Kurvers R H J M. Disentangling interference competition from exploitative competition in a crab-bivalve system using a novel experimental approach. Oikos, 2006, 113(1): 157- 167.
[10] Moksnes P O, Pihl L, van Montfrans J. Predation on postlarvae and juveniles of the shore crabCarcinusmaenas: importance of shelter, size and cannibalism. Marine Ecology Progress Series, 1998, 166: 211- 225.
[11] Holling C S. The functional response of invertebrate predators to prey density. Memoirs of the Entomological Society of Canada, 1966, 98(S48): 5- 86.
[12] Lin J. Influence of location in a salt marsh on survivorship of ribbed mussels. Marine Ecology Progress Series, 1989, 56: 105- 110.
[13] Eggleston D B. Functional responses of blue crabsCallinectessapidusRathbun feeding on juvenile oystersCrassostreavirginica(Gmelin): effects of predator sex and size, and prey size. Journal of Experimental Marine Biology and Ecology, 1990, 143(1/2): 73- 90.
[14] Eggleston D B. Behavioral mechanisms underlying variable functional responses of blue crabs,Callinectessapidusfeeding on juvenile oysters,Crassostreavirginica. Journal of Animal Ecology, 1990, 59(2): 615- 630.
[15] Elner R W, Hughes R N. Energy maximization in the diet of the shore crab,Carcinusmaenas. Journal of Animal Ecology, 1978, 47(1): 103- 116.
[16] Hughes R N, Elner R W. Tactics of a predator,Carcinusmaenasand morphological responses of the prey,Nucellalapillus. Journal of Animal Ecology, 1979, 48(1): 65- 78.
[17] Boulding E G. Crab-resistant features of shells of burrowing bivalves: decreasing vulnerability by increasing handling time. Journal of Experimental Marine Biology and Ecology, 1984, 76(3): 201- 223.
[18] Aronhime B R, Brown K M. The roles of profit and claw strength in determining mussel size selection by crabs. Journal of Experimental Marine Biology and Ecology, 2009, 379(1/2): 28- 33.
[19] Elner R W. The mechanics of predation by the shore-crab,Carcinusmaenas(L.), on the edible mussel,MytilusedulisL.. Oecologia, 1978, 36(3): 333- 344.
[20] Enderlein P, Wahl M. Dominance of blue mussels versus consumer-mediated enhancement of benthic diversity. Journal of Sea Research, 2004, 51(2): 145- 155.
[21] Seed R. Predator-prey relationships between the mud crab,Panopeusherbstii, the blue crab,Callinectessapidusand the Atlantic ribbed musselGeukensia(=Modiolus)demissa. Estuarine Coastal and Shelf Science, 1980, 11(4): 455- 458.
[22] Luppi T A, Spivak E D, Anger K. Experimental studies on predation and cannibalism of the settlers ofChasmagnathusgranulataandCyrtograpsusangulatus(Brachyura: Grapsidae). Journal of Experimental Marine Biology and Ecology, 2001, 265(1): 29- 48.
[23] 王如才, 王昭萍. 海水贝类养殖学. 青岛: 中国海洋大学出版社, 2008: 370- 371.
[24] 陈建华, 阎斌伦, 高焕. 毛蚶生物学特性及其研究进展. 河北渔业, 2006, (9): 24- 25.
[25] Arnold W S. The effects of prey size, predator size, and sediment composition on the rate of predation of the blue crab,CallinectessapidusRathbun, on the hard clam,MercenariaMercenaria(Linné). Journal of Experimental Marine Biology and Ecology, 1984, 80(3): 207- 219.
[26] Sponugle S, Lawton P. Portunid crab predation on juvenile hard clams: effects of substrate type and prey density. Marine Ecology Progress Series, 1990, 67: 43- 53.
[27] Sih A. Predators and prey lifestyles: an evolutionary and ecological overview // Kerfoot C W, Sih A. Predation: Direct and Indirect Impacts on Aquatic Communities. Hanover and London: University Press of New England, 1987.
[28] Bush B M H, Laverack, M S. Mechanoreception // Abele L G. The biology of Crustacea. New York: Academic Press, 1982.
[29] Jubb C A, Hughes K N, Ap Rheinallt T. Behavioural mechanisms of size-selection by crabs,Carcinusmaenas(L.) feeding on mussels,MytilusedulisL.. Journal of Experimental Marine Biology and Ecology, 1983, 66(1): 81- 87.
Impact of ecological factors on the predation of the bloody clam (Scapharcasubcrenata) by crabs (Sesarmahaematocheir)
GAO Xiaolong1, LI Li2, QIU Zhaoxing2, ZHENG Yongyun2, LI Qi1,*
1FisheriesCollege,OceanUniversityofChina,Qingdao266003,China2MarineBiologyInstituteofShandongProvince,Qingdao266104,China
Predation is a key determinant in the regulation of species abundance and composition in marine benthic communities. The effect of predator density, size, sex, prey density, size, and temperature, substrate condition on predation was investigated using the crab (Sesarmahaematocheir) and bloody clam (Scapharcasubcrenata). The results indicate that crabs displayed the type II functional response,S.subcrenataseeded at high density improved the survival rate significantly. The feeding rates of crabs decreased significantly when shell length of the clam reached 20 mm. The feeding rates increased as crab size increased, and the survival rate of the clam decreased significantly. Interference competition between conspecifics improved the clam survival rate significantly as crab density increased. Male crabs with stronger claws leaded to higher deaths ofS.subcrenata. Releasing ofS.subcrenatain spring and autumn at relatively low temperature improved survival rate. Substrate of complexity and heterogeneity provided more spatial refuges for the clam survival, which reduced the loss from predation.
Sesarmahaematocheir;Scapharcasubcrenata; density; size; sex; temperature; substrate
国家海洋公益性行业科研专项(201205023); 国家科技支撑计划项目(2011BAD13B01)
2013- 07- 24;
2014- 06- 12
10.5846/stxb201307241943
*通讯作者Corresponding author.E-mail: qili66@ouc.edu.cn
高霄龙, 李莉, 邱兆星, 郑永允, 李琪.生态因子对红螯相手蟹捕食毛蚶苗种的影响.生态学报,2015,35(11):3562- 3568.
Gao X L, Li L, Qiu Z X, Zheng Y Y, Li Q.Impact of ecological factors on the predation of the bloody clam (Scapharcasubcrenata) by crabs (Sesarmahaematocheir).Acta Ecologica Sinica,2015,35(11):3562- 3568.
