硫化钙的氧化行为研究*
2015-02-07巫建锋杨秀山孔行健张志业王辛龙
巫建锋,杨秀山,杨 林,孔行健,张志业,王辛龙
(四川大学化学工程学院,四川成都610065)
硫化钙的氧化行为研究*
巫建锋,杨秀山,杨 林,孔行健,张志业,王辛龙
(四川大学化学工程学院,四川成都610065)
硫化钙(CaS)是磷石膏分解时的中间产物,稳定性极差,不易于保存。采用可控程序高温管式炉在N2/O2气氛下,研究了CaS在不同温度、O2浓度和不同时间下的氧化特性,并通过X射线粉末衍射仪(XRD)来表征氧化产物物相。结果表明,在300℃左右CaS开始氧化,最终稳定产物为硫酸钙(CaSO4),且随温度升高,氧化产物中CaSO4的含量增加;温度为700℃时CaS基本氧化完全,即达到最佳理想状态;O2浓度越高,CaS越容易被氧化,φ(O2)=21%时氧化产物中CaSO4的质量分数高达91.13%。CaS的氧化速度较快,80%都在10 min左右被氧化。
磷石膏;硫化钙;氧化;硫酸钙
磷石膏是硫酸法萃取磷酸生产时排放的固体废弃物,主要成分是二水硫酸钙CaSO4·2H2O,每生产1 t磷酸(以100%P2O5计,质量分数)大约副产5~6 t(干基)磷石膏,然而磷石膏的产量还会随着高浓度磷复肥产量的提高而增加[1-5]。目前,全世界磷石膏的利用率仅为4.5%,2013年中国全年排放的磷石膏约为7 000万t,堆存量已达2.5亿t,相关企业基本采用堆存方式处理,其利用率仅为24.28%。这些废渣不仅占用大量土地资源,而且极易污染环境。磷石膏的综合利用,主要可用于矿井的填充、水泥缓凝剂、石膏板和石膏砌块等建材产品[6-10]。杨秀山等[11]提出了一种用硫磺还原分解石膏制备硫化钙的方法,所得的固体产物CaS即是石膏分解过程中产生的中间产物,而尾气SO2则用于生产硫酸,从而使硫资源得到循环利用,减少了环境的污染。
然而CaS在常温下极容易被氧化,化学性质很不稳定。研究者对CaS的氧化机理做了一系列的研究。肖海平等[12]用热重-傅里叶变换红外光谱联用分析仪,研究了分析纯CaS在不同反应温度下的氧化特性,实验划分为3个温度区,在1 300~1 400℃下初始CaS中的硫分基本释放完全,并且提高O2浓度和降低反应温度有利于提高固硫效果。李文等[13]利用加压热天平研究了分析纯CaS在730~970℃和不同压力下的氧化行为,认为提高温度和增加压力有利于CaS的氧化,整个过程基本上受扩散控制。D. C.Lynch等[14]利用连续热重分析仪和碘量滴定法研究了CaS在O2分压为1.013 25~101.325 kPa、温度为950~1 580℃下的氧化特性。结果表明:在高温、低O2分压下产物的质量减少,氧化产物为CaO和SO2;在低温、高O2分压下产物的质量增加,氧化产物为CaSO4;在中间温度段呈CaO和CaSO4交替产生的振荡现象。
上述学者研究了分析纯CaS在O2气氛和700~1 580℃区域内的氧化机理,但对于磷石膏分解过程中产生的CaS的氧化性研究还未见报道。笔者采用磷石膏分解后的CaS作原料,在氧化性气氛中研究了1 100℃及以下温度区间内CaS的氧化特性,以期为磷石膏分解过程的工艺控制提供参考。
1 实验原料和方法
1.1 原料与仪器
实验原料来自湖南省祁东县建辰五金矿产有限公司的CaS,其粒度为42.03 μm,原料中含有部分CaSO4及其他杂质,其主要化学成分见表1。
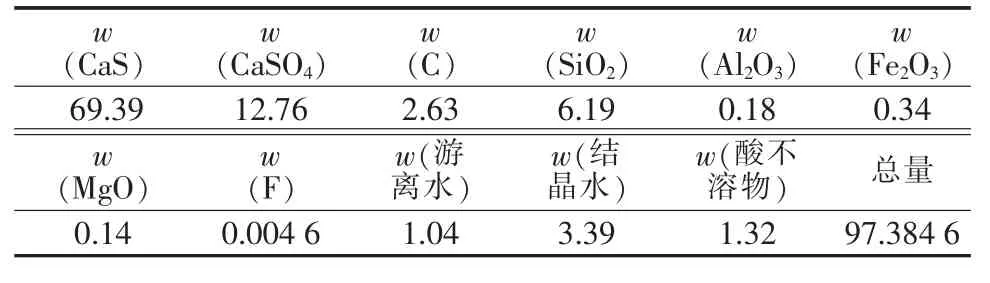
表1 硫化钙的主要物相组成 %
实验所用O2和N2来自成都东风气体有限公司,其体积分数分别为99.2%和99.5%。
仪器:GSL-1500X-50型气氛可调程序控温管式炉、X′pert PW3040/60型X射线粉末衍射仪(XRD)、RIPSCU型配气系统。
1.2 实验方法
将一定质量的CaS粉末放在瓷舟内,置于气氛可调程序控温管式炉中,在一定的反应温度、时间和O2浓度下进行氧化反应。对反应后固体产物进行XRD表征,并用重量法分析产物中CaSO4的含量。
2 热力学分析
硫化钙的氧化过程可能发生的主要反应:
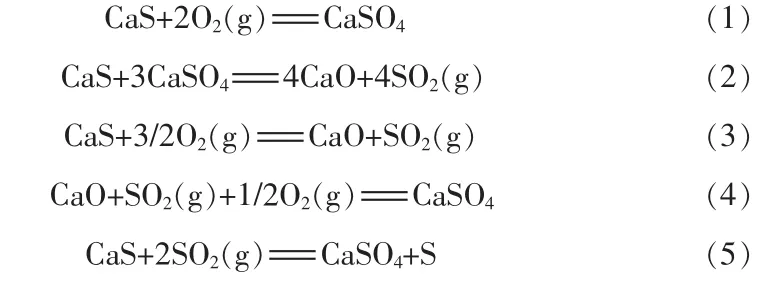
上述5个反应的标准Gibbs自由能(ΔG)的变化与反应温度的关系见图1。从图1可见,在0~1 200℃的温度区间内,式(1)的 ΔG在 0℃时为-864.25 kJ/mol,随着温度增加,ΔG也逐渐增加,但在1 200℃以下始终最低,其生成在热力学上存在最佳优势。而式(2)的ΔG直到1 200℃左右时才为负值,在低于该温度时不能自发进行,其热力学优势不佳。式(3)和式(4)的ΔG也始终为负值,但是式(3)的ΔG随温度升高变化幅度不明显,而式(4)的ΔG随温度升高增加较快,900℃后式(3)优于式(4)先进行。式(5)的ΔG在低于780℃时才为负值,热力学优势还不及式(3)。由图1可知,在考察温度范围内,式(1)的发生优先于其他反应。即从热力学上来说,CaS是极易被氧化为CaSO4的,但是在高温下,由于式(2)能够发生可能导致CaS氧化后生成CaO和SO2,因此在热力学上,低温下CaS的氧化产物只可能为CaSO4,而在高温下才可能有CaO产生。

图1 标准Gibbs自由能的变化与反应温度的关系
3 结果与讨论
3.1 温度对CaS氧化性的影响
3.1.1 XRD分析
图2为CaS在不同温度下氧化产物的XRD谱图。用图2中25.4°处的CaSO4衍射峰和31.5°处的CaS衍射峰来比较在不同温度下所得产物的相对强度,可以看出,在相同的氧化时间和氧气浓度下,随着温度的升高,CaSO4的衍射峰不断增强,而CaS的衍射峰逐渐减弱,这说明氧化反应的转化率也在增加;在300℃以前,氧化产物的XRD谱图与CaS原料的谱图相比几乎没有变化,而在300℃时能够看到25.4°处的CaSO4衍射峰明显增强;在700℃时检测到37.5°处有少量的CaO衍射峰出现,并且随着温度的升高而逐渐增强,其原因归结为在700℃时,没有被氧化的CaS和氧化产物CaSO4发生了固-固反应生成了CaO,即反应式(2)[13],但CaS在氧化温度低于式(2)的理论发生温度时即可氧化生成CaO,这可能与磷石膏分解后得到的硫化钙中含有的杂质有关,对此还有待于进一步研究。
综上所述,在 700℃以前,CaS氧化产物中CaSO4衍射峰强度在增加,其原因可归因于CaS和O2之间的气-固反应,即式(1),氧化产物为CaSO4,700℃时出现CaO的衍射峰,其原因归结于式(1)进行的同时发生了CaS和CaSO4之间的固-固反应。因此实验表明,温度低于700℃的时候,有利于CaS和O2进行气-固反应,而温度高于700℃时,则将有利于CaS和CaSO4之间发生固-固反应。

图2 不同温度下反应产物的XRD谱图
3.1.2 不同温度下CaSO4含量和质量变化率的关系
图3为在相同氧化时间和O2浓度下,不同氧化温度的产物CaSO4含量与其质量变化率的关系。从图3可以看出,在0~300℃时,CaSO4含量的增加不明显且基本趋于平缓,而且产品质量损失严重,相当于原料处在干燥阶段;在300~700℃时,CaSO4含量随着反应温度的升高而快速增加,质量分数最高达到91.24%,只有少部分没有生成CaSO4,而产品的质量从损失转为增加,与CaSO4含量呈线性关系增加;然而在700~1 100℃时,CaSO4含量出现缓慢减少现象,并且质量损失率也和CaSO4含量呈线性关系下降,说明在这个温度段内反应得到的CaSO4部分转化成了CaO,整个氧化过程中产品的质量呈现先损失后增加再减少的趋势[12]。从上述分析可知,700℃前CaS的氧化产物是CaSO4,与XRD分析的结果一致,但CaS不容易完全氧化。

图3 不同温度下反应产物的CaSO4含量和质量变化率的关系
3.2 O2浓度对CaS氧化性的影响
在相同氧化温度和时间下,随着O2浓度的提高,CaS的氧化程度也在不断加深。图4为CaS在700℃时,不同O2浓度下反应产物的CaSO4含量和质量变化率的关系。从图4可见,随着O2浓度的提高,产物中CaSO4含量明显增加,在φ(O2)=21%时,CaSO4质量分数达到91.13%,绝大部分都生成了CaSO4,但还是有少量CaS没能被氧化,即CaS氧化程度是随着O2的增加而不断加深的。在99.2%(体积分数)N2(O4的体积分数为0%)气氛下,CaS氧化初期质量损失率为11.78%,而在φ(O2)=21%时,最终的质量增长率为17.11%,而且质量损失率和CaSO4含量是呈线性增加的,这是因为O2在体系中起着主导作用的结果,并且该结果和肖海平等[15]的研究结果一致。从上述分析可知,O2浓度的增加有利于CaS的氧化;在700℃前,CaS的氧化产物绝大部分是CaSO4,与热力学分析和温度对实验结果的影响一致。
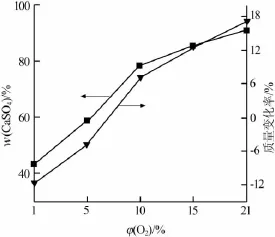
图4 不同O2浓度下反应产物的CaSO4含量和质量变化率的关系
3.3 反应时间对CaS氧化性的影响
为了避免在700℃时出现少量的CaO对分析结果产生影响,实验考察了CaS原料在500℃条件下,不同反应时间得到产物的XRD谱图,结果见图5。由图5可见,反应产物只有25.4°处的CaSO4衍射峰明显增强,在2 h时衍射峰强度基本达到最高,而31.5°处的CaS衍射峰几乎没有变化,同时也没有出现CaO的衍射峰,说明CaS在2 h后氧化就能达到最大值。
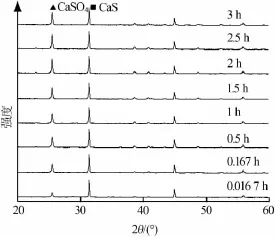
图5 不同时间下反应产物的XRD谱图
图6为不同时间下的CaSO4含量与质量变化率的关系。从图6可见,CaSO4含量越大则质量损失率越小,在2 h时CaSO4质量分数达到最高值61.02%,质量损失率则达到最小值;2 h后CaSO4含量开始减少,与XRD分析结果吻合,同时产物质量开始增加,因此不同时间下的CaSO4含量与质量变化率呈相反的关系。其次,在氧化初期,氧化速率非常快,10 min时CaSO4的质量分数就达到49.10%,为总含量的80%,此后阶段的氧化速率极其缓慢,这说明CaS的氧化主要集中在反应的初始阶段。与温度和O2浓度对CaS氧化的影响比较可知,三者的结果是相辅相承的,但温度和O2浓度对CaS的氧化起着主导性的作用。
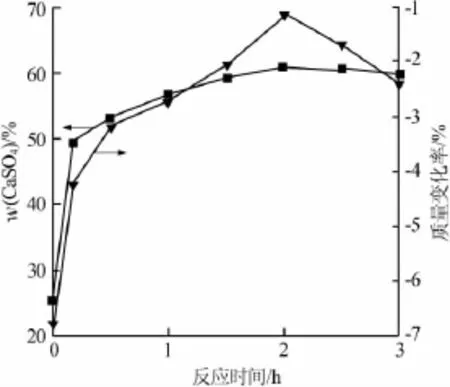
图6 不同时间下反应产物的CaSO4含量和质量变化率的关系
3 结论
在真空管式高温烧结炉上对硫化钙的氧化过程做了实验研究,利用X射线粉末衍射仪表征了氧化后产物的物相组成,以重量法分析了氧化后产物中CaSO4含量,得到结论:1)在相同时间和氧气浓度下,CaS大量氧化的起始温度为300℃,最佳氧化温度为700℃,氧化的直接产物为CaSO4,但是CaS是不容易氧化完全的;2)根据不同温度下反应产物质量变化率的关系分析,整个氧化反应中产物的质量呈先损失后增加再损失的趋势;3)在相同时间和温度下,O2浓度越高,越有利于CaS转化成CaSO4;4)在相同温度和氧气浓度下,CaS的氧化速度非常快,80%都在10 min左右就被氧化,但需要2 h才能达到最高值。
[1] 钟本和,张志业,王辛龙,等.化学法处理磷石膏的新途径[J].无机盐工业,2011,43(9):1-4.
[2] 钟本和,王辛龙,张志业,等.我国磷石膏利用途径的探讨[J].磷肥与复肥,2010,25(3):61-63,66.
[3] 王辛龙,张志业,杨秀山,等.我国磷石膏利用新途径的分析[J].现代化工,2011,31(5):1-3,5.
[4] 杨秀山,刘荆风,余家鑫,等.磷石膏制硫酸的研究进展[J].现代化工,2010,30(9):8-12.
[5] 万甜明,张志业,王辛龙,等.磷石膏和硫化钙反应过程的熔融特性研究[J].现代化工,2011,31(12):63-67.
[6] 夏英彪.必须进一步加大磷石膏综合利用的力度和步伐——浅析安徽省磷石膏综合利用的现状及努力方向[J].安徽化工,2013,39(4):1-3.
[7] 张跃,王秀萍,龚家竹.磷石膏环保问题及资源利用的科技创新[J].无机盐工业,2013,45(5):30-32.
[8] 舒艺周.我国磷石膏现有资源化利用方式[J].磷肥与复肥,2013,28(1):73-75.
[9] 周智武,金苏闽.我国磷石膏综合利用技术进展[J].硫酸工业,2013(2):5-7.
[10] 汪家铭.磷石膏综合利用技术现状与前景展望[J].中国石油和化工经济分析,2012(9):52-55.
[11] 杨秀山,王辛龙,张志业,等.一种用硫磺还原分解石膏制备硫化钙的方法:中国,101708825A[P].2010-05-19.
[12] 肖海平,周俊虎,刘建忠,等.CaS氧化反应特性的热重研究[J].浙江大学学报:工学版,2006,40(6):982-985,990.
[13] 李文,韩翔宇,陈皓侃,等.加压下硫化钙氧化反应动力学和模型[J].化工学报,2003,54(5):625-632.
[14] Lynch D C,Elliott J F.Analysis of the oxidation reactions of CaS[J].Metallurgical Transactions,1980,11(3):415-425.
[15] 肖海平,周俊虎,刘建忠,等.高温下CaS氧化反应特性的实验研究[J].高校化学工程学报,2006,20(3):494-498.
Study on oxidation behaviors of CaS
Wu Jianfeng,Yang Xiushan,Yang Lin,Kong Xingjian,Zhang Zhiye,Wang Xinlong
(College of Chemical Engineering,Sichuan University,Chengdu 610065,China)
Calcium sulfide(CaS)is the intermediate product of the phosphogypsum decomposition.It is not stable and hard to preserve.High-temperature programmed tubular oven was used to study the oxidation characters of CaS under different temperatures,O2concentrations,and times in N2/O2atmosphere.X-ray powder diffraction(XRD)was used to determine phases of oxidation products.Results showed that the oxidation reaction of CaS began at about 300℃,the final stable product for oxidation was calcium sulphate(CaSO4),and with the increase of temperature,CaSO4content in the oxidation products also increased;when the temperature was 700℃,CaS was basically oxidized completely,i.e.the ideal state.High oxygen concentration tended to lead easier oxidation of CaS.21%(volume fraction)oxygen concentration could get 91.13%high CaSO4mass fraction in the final oxidation products.CaS had a fast oxidation speed,80%of it was oxided at about 10 min.
phosphogypsum;calcium sulfide;oxidation;calcium sulphate
TQ132.32
A
1006-4990(2015)08-0026-04
2015-02-12
巫建锋(1992— ),男,本科,主要研究方向为磷石膏的综合利用,已公开发表文章2篇。
王辛龙
国家高技术研究发展计划(863计划)资助项目(2011AA06A106)。
联系方式:wangxl@scu.edu.cn
