肿瘤对小鼠肾上腺皮质细胞胆固醇稳态分子表达的影响
2015-02-07潘志强方肇勤卢文丽刘小美张园园
潘志强,方肇勤,卢文丽,刘小美,张园园
(上海中医药大学基础医学院,上海 201203)
细胞内胆固醇稳态机制在肝脏、主动脉研究很深入[1,2],而胆固醇作为类固醇激素合成的前体物质,如何被肾上腺细胞用于合成皮质激素以适应各种应激尚缺乏深入研究。现有研究表明[3],肾上腺皮质细胞通过3 种方式获得类固醇激素合成的原料:①摄取血液胆固醇(人主要是低密度脂蛋白胆固醇,啮齿类动物主要是高密度脂蛋白胆固醇),②在内质网中从头合成胆固醇,③将脂滴中酯化胆固醇酶解为游离胆固醇。一旦细胞内胆固醇积聚过量,则通过细胞膜上三磷酸腺苷结合盒转运蛋白体A1 和G1 将胆固醇逆转运至细胞外。此外,肝X 受体、固醇调节元件结合蛋白、过氧化物酶体增殖物激活受体等信号分子还参与细胞内胆固醇进出与转运调节[4,5],肾上腺皮质细胞正是通过这一精密调控机制以确保胞内胆固醇的稳态。
然而,在肿瘤状态下,机体为适应肿瘤的慢性应激,肾上腺分泌皮质激素以抵御应激反应,那么,肿瘤大小是否对肾上腺皮质细胞胆固醇稳态有影响,尚未发现相关研究报道。本文在课题组对H22 肝癌小鼠肾上腺皮质酮合成与分泌的研究基础上[6],重点比较了不同肿瘤大小的肝癌小鼠肾上腺皮质细胞内胆固醇稳态分子的表达差异,发现肿瘤越大者,小鼠肾上腺皮质细胞对胆固醇需求越高,用于皮质激素的合成以抵御肿瘤的慢性应激。
1 材料和方法
1.1 材料
1.1.1 实验动物
SPF 级KM 雄性小鼠250 只,7 周龄,体重(21±1)g,购自上海斯莱克实验动物有限责任公司【SCXK(沪)2007-0005】;实验在上海中医药大学动物实验中心设施内进行【SYXK(沪)2009-0069】。
1.1.2 试剂
乙二胺四乙酸二钾盐(EDTA-2K)抗凝剂购自国药集团;总胆固醇、甘油三酯、高密度脂蛋白胆固醇检测试剂盒购自南京建成生物工程研究所。Trizol 购自Invitrogen,反转录试剂盒PrimeScript® RT Reagent Kit 和PCR 试剂盒SYBR® Premix Ex TaqTM(Tli RNaseH Plus)II 购自TaKaRa 公司。SRB1、ApoA1、GAPDH 抗体购自Abcam 公司,BCA 蛋白质定量检测试剂盒购自上海碧云天生物技术有限公司,免疫印迹化学发光试剂ECL 试剂盒购自Pierce公司。
1.1.3 仪器
Elx800 型酶标仪(美国Bio-TEK 公司),Elx50型自动洗板机(美国Bio-TEK 公司)。5417R 型冷冻台式离心机(德国Eppendorf 公司),Eco-Illumina实时荧光定量PCR 仪(美国Illumina 公司),GBOX CheMI 凝胶扫描与分析系统。
1.2 方法
1.2.1 H22 肝癌小鼠模型建立
随机取30 只小鼠作正常对照组,另220 只小鼠腋下接种H22 肝癌腹水癌细胞(课题组前期采用并保种冻存于-196℃液氮中),每只0.2 mL(细胞浓度1 ×107个/mL)。
1.2.2 小鼠分组、处死、取材与组织湿重
采用游标卡尺精确测量小鼠腋下肿瘤最长直径(a)和最短横径(b),通过肿瘤体积预测公式V =0.5ab2,估算肿瘤大小,按照肿瘤体积大小排序,选择瘤体最大者18 只,瘤体最小者18 只,同时选择体重居中的18 只正常小鼠作为正常对照组,于接种肿瘤细胞后第11 天处死瘤体大组、瘤体小组和正常组小鼠,摘眼球取血,常规分离血浆,剥离肿瘤并称重,多余小鼠用于后续实验。
1.2.3 血脂含量检测
按照试剂盒及所提供的方法进行操作,检测血浆总胆固醇、甘油三酯、高密度脂蛋白胆固醇含量。
1.2.4 实时荧光定量PCR 检测基因表达
上下游引物序列采用Primer3 (v.0.4.0)在线软件合成(参见表1),委托Life Technologies 公司上海合成部完成。按照Trizol 试剂盒说明书抽提肾上腺总RNA;逆转录反应体系20 μL,反应条件为37℃×15 min,85℃×5 s,4℃(逆转录反应程序结束,可以取出,也可以过任意时间后取出);PCR 扩增反应体系为20 μL,反应程序为95℃×3 min,95℃×30 s,60℃×30 s,40 cycles。基因相对表达量分析方法:采用2-ΔΔCT法分析[7],以正常组作为对照组,以GAPDH 和β-actin 基因Ct 均值作为内参组,ΔCt=Ct目的基因- Ct内参基因(其中,Ct 值为扩增n 个循环基因的荧光数值),ΔΔCt=ΔCT 肿瘤组- ΔCT 对照组,目的基因相对表达量=2-ΔΔCT。
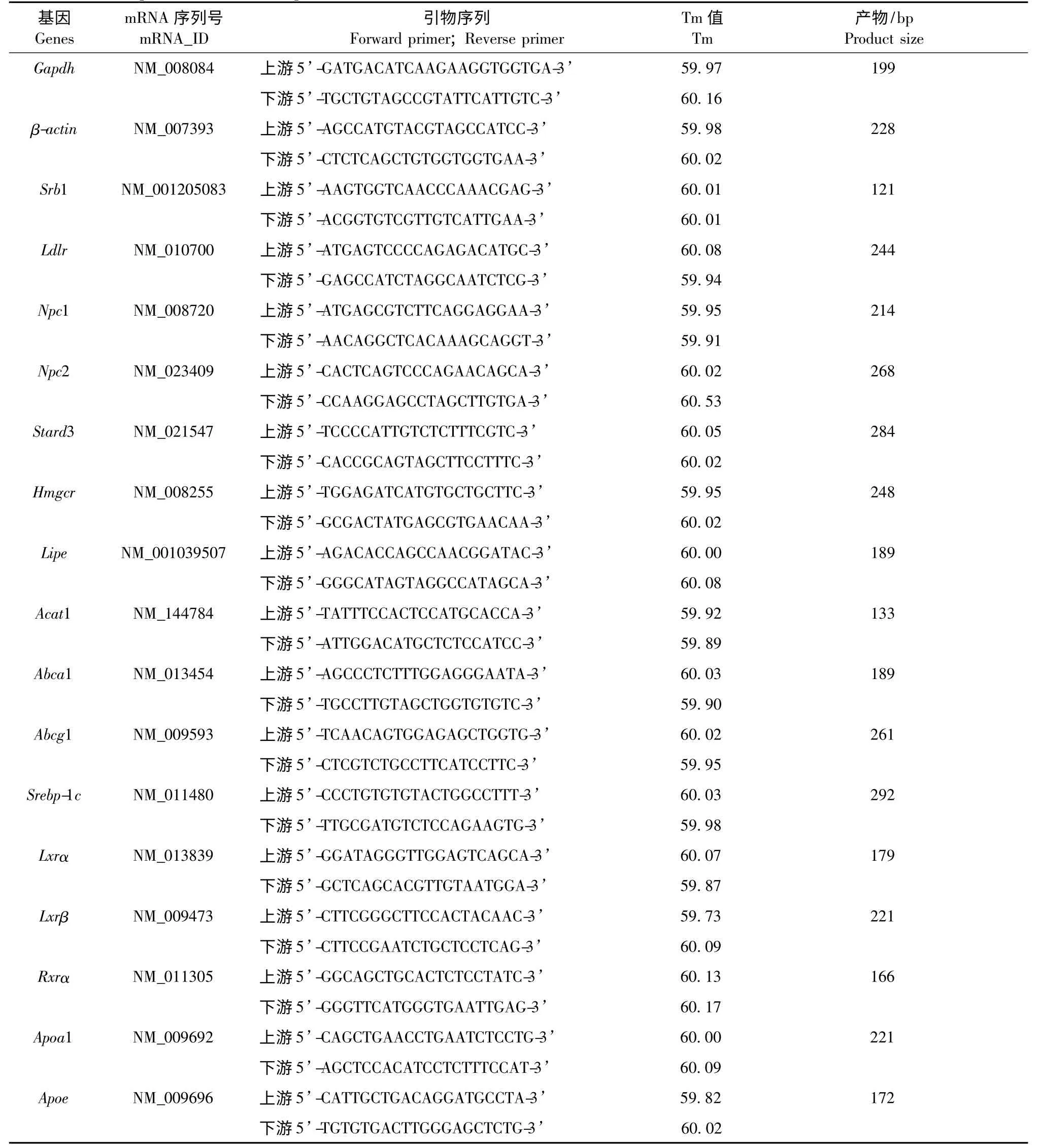
表1 小鼠上、下游引物序列Tab.1 Sequences of the mose primers
1.2.5 Western blot 检测蛋白表达
采用RIPA 裂解液裂解肾上腺组织,依据BCA蛋白质定量试剂方法进行蛋白定量,采用10% SDSPAGE 凝胶电泳分离蛋白,并进行PVDF 转膜与5%脱脂奶粉封闭,加入一抗(SRB1 抗体1∶1000 稀释、ApoA1 抗体1 ∶2000 稀释、GAPDH 抗体1 ∶2000 稀释)4℃过夜,用TBST 洗涤,再加入相应辣根过氧化物酶标记的山羊抗兔IgG 二抗(1∶2000 稀释)孵育,TBST 洗涤,ECL 化学发光显影,最后用GBOX Che-MI 凝胶扫描与分析系统进行半定量分析。
1.2.6 统计学方法
应用SPSS 15.0 统计软件,两组比较采用t 检验,三组比较采用单因素方差分析对实验指标进行统计。P≤0.05 为差异有统计学意义。
2 结果
2.1 小鼠去瘤体重与肿瘤质量比较
与正常组比较,两组肝癌小鼠去瘤体重差异无显著性;与瘤体小组比较,瘤体大组小鼠肿瘤质量明显增大(P <0.05)(见表2)。
2.2 血脂含量比较
与正常组比较,两组肝癌小鼠血浆TC 和TG 差异均无显著性,而HDL-C 显著下降(P <0.05),提示肝癌小鼠胆固醇逆向转运至肝脏的代谢能力下降(见表3)。
表2 各组小鼠去瘤体重与肿瘤质量比较(±s,n =18)Tab.2 Comparison of body weight and tumor weight among the mice of all groups

表2 各组小鼠去瘤体重与肿瘤质量比较(±s,n =18)Tab.2 Comparison of body weight and tumor weight among the mice of all groups
注:与瘤体小组比较,▲P <0.05。Note.▲P <0.05 compared with the small tumor group.
组别Groups去瘤体重/g Body weight肿瘤/g Tumor weight正常组Control group 27.10±1.44 -瘤体大组Large tumor group 29.45±3.67 3.05±0.64 ▲瘤体小组Small tumor group 28.47±2.05 1.51±0.43
2.3 肾上腺皮质细胞胆固醇摄取与转运相关基因表达
与正常组比较,瘤体大组肝癌小鼠肾上腺胆固醇摄取分子高密度脂蛋白受体(Srb1)和低密度脂蛋白受体(Ldlr)基因表达显著升高(P <0.05),且瘤体大组肝癌小鼠Ldlr 基因表达显著高于瘤体小组(P <0.05)。Ldlr 通过质膜内吞进入胞内体,释放胆固醇并通过含START 结合域蛋白3(Stard3)、C型尼曼-匹克病基因(Npc1 和Npc2)等蛋白转运至内质网,然而这几个胆固醇转运分子基因表达在各组间差异无显著性(见表4)。
表3 各组小鼠血脂含量比较(±s,mmol/L)Tab.3 Comparison of blood TC,TG and HDL-C among the mice of all groups

表3 各组小鼠血脂含量比较(±s,mmol/L)Tab.3 Comparison of blood TC,TG and HDL-C among the mice of all groups
注:与正常组比较,* P <0.05。Note.* P <0.05 compared with the control group.
组别Groups总胆固醇TC高密度脂蛋白胆固醇HDL-C甘油三酯TG正常组Control group 4.39±0.61 1.18±0.28 1.27±0.35瘤体大组Large tumor group 3.52±0.64 0.87±0.13* 1.70±0.39瘤体小组Small tumor group 3.49±0.72 0.62±0.18*1.65±0.45
表4 各组小鼠肾上腺细胞胆固醇摄取与转运相关基因表达(±s)Tab.4 Comparison of the expression of cholesterol uptake and transport-related genes among all groups

表4 各组小鼠肾上腺细胞胆固醇摄取与转运相关基因表达(±s)Tab.4 Comparison of the expression of cholesterol uptake and transport-related genes among all groups
注:与正常组比较,* P <0.05;与瘤体小组比较,▲P <0.05;Stard3 又名Mln64,Npc1 又名Nmf164。Note.* P <0.05,compared with the control group;▲P <0.05,compared with the small tumor group.Stard3 also known as Mln64.Npc1 also known as Nmf164.
组别Groups Srb1 Ldlr Npc1 Npc2 Stard3正常组Control group 1.00±0.21 1.00±0.13 1.00±0.21 1.00±0.02 1.00±0.28瘤体大组Large tumor group 1.89±0.24* 2.20±0.47*▲ 1.24±0.11 0.83±0.09 1.06±0.08瘤体小组Small tumor group 1.35±0.21 1.33±0.15 1.16±0.13 0.92±0.06 1.29±0.11
2.4 肾上腺皮质细胞胆固醇合成、转化与流出相关基因表达
与正常组比较,瘤体大组肝癌小鼠酰基辅酶A:胆固醇酰基转移酶(Acat1)与胆固醇逆向流出胞外的三磷酸腺苷结合盒转运蛋白体G1(Abcg1)基因表达显著下降(P <0.05);与瘤体小组比较,瘤体大组肝癌小鼠酯化胆固醇的激素敏感脂肪酶(Lipe)、Acat1、Abca1 基因表达显著下调(P <0.05);然而,内质网胆固醇合成的3-羟基-3-甲基戊二酰辅酶A还原酶(Hmgcr)各组间差异无显著性(见表5)。
2.5 调节胆固醇稳态分子的基因表达
与正常组比较,瘤体大组肝癌小鼠肝X 受体β(Lxrβ)与载脂蛋白a1(Apoa1)基因表达显著升高(P<0.05),瘤体小组肝癌小鼠固醇调节元件结合蛋白-1c(Srebp-1c)、Lxrβ 基因 表达明 显升高(P <0.05),而Apoa1 表达显著下调(P <0.05);与瘤体小组比较,瘤体大组肝癌小鼠Srebp-1c 和Apoa1 显著升高(P <0.05),而肝X 受体α(Lxrα)与载脂蛋白e(Apoe)基因表达各组间差异无显著性(见表6)。
2.6 肾上腺SRB1 与ApoA1 蛋白表达
与正常组比较,瘤体大组肝癌小鼠肾上腺SRB1蛋白表达显著升高(P <0.05),而瘤体小组ApoA1蛋白表达显著下降(P <0.05);且瘤体大组肝癌小鼠ApoA1 蛋白表达显著高于瘤体小组(P <0.05)(见图1A、B)。
表5 各组小鼠肾上腺细胞胆固醇合成、转化、流出相关基因表达(±s)Tab.5 Comparison of expression of cholesterol synthesis,transform and efflux-related genes in all groups

表5 各组小鼠肾上腺细胞胆固醇合成、转化、流出相关基因表达(±s)Tab.5 Comparison of expression of cholesterol synthesis,transform and efflux-related genes in all groups
注:与正常组比较,* P <0.05;与瘤体小组比较,▲P <0.05;Lipe 又名Hsl。Note.* P <0.05,compared with the control group;▲P <0.05,compared with the small tumor group.Lipe also known as Hsl.
组别Groups Hmgcr Lipe Acat1 Abca1 Abcg1正常组Control group 1.00±0.33 1.00±0.09 1.00±0.06 1.00±0.21 1.00±0.37瘤体大组Large tumor group 1.03±0.24 0.91±0.15▲ 0.68±0.05*▲ 0.76±0.13▲ 0.54±0.08*瘤体小组Small tumor group 0.78±0.01 1.36±0.08 1.06±0.06 1.19±0.05 0.76±0.09
表6 各组小鼠肾上腺细胞胆固醇稳态调节分子基因表达(±s)Tab.6 Comparison of the expression of cholesterol homeostasis-related genes in the mice of all groups

表6 各组小鼠肾上腺细胞胆固醇稳态调节分子基因表达(±s)Tab.6 Comparison of the expression of cholesterol homeostasis-related genes in the mice of all groups
注:与正常组比较,* P <0.05;与瘤体小组比较,▲P <0.05。Note.* P <0.05,compared with the control group;▲P <0.05,compared with the small tumor group.
组别Groups Srebp-1c Lxrα Lxrβ Rxrα Apoa1 Apoe正常组Control group 1.00±0.12 1.00±0.25 1.00±0.09 1.00±0.10 1.00±0.21 1.00±0.09瘤体大组Large tumor group 1.06±0.19▲ 0.81±0.13 1.52±0.32* 1.30±0.28 1.79±0.16*▲ 1.11±0.08瘤体小组Small tumor group 1.88±0.21* 1.12±0.12 1.40±0.06* 1.38±0.06* 0.18±0.01*1.24±0.03

图1 SRB1(A)、ApoA1(B)蛋白相对表达量Fig.1 SRB1 (A)and ApoA1 (B )protein relative expression in the mice
3 讨论
胆固醇是肾上腺皮质细胞合成类固醇激素的重要前体物质,在肝癌疾病状态下,机体为适应肿瘤的慢性反复应激,肾上腺皮质需合成糖皮质激素以抵御应激反应,因此,维持肾上腺皮质细胞充裕的胆固醇是必需的。课题组对各组小鼠血浆激素检测结果表明[6],肿瘤形成后,小鼠血浆皮质酮水平均高于正常对照组,且瘤体越大者,血浆促肾上腺皮质激素含量显著升高,并存在垂体-肾上腺皮质轴的负反馈机制。那么,对于皮质激素合成前期过程而言,与肝细胞、主动脉内皮细胞、巨噬细胞类似,肾上腺皮质细胞也存在一套精密的调控胆固醇稳态机制,既可通过质膜上高密度脂蛋白受体和低密度脂蛋白受体摄入血液中的胆固醇并储存于脂滴中备用,又可在内质网中从头合成胆固醇,此外,胞内过量的胆固醇还将通过三磷酸腺苷结合盒转运蛋白体相关蛋白逆向流出胞外,而且,肝X 受体、固醇调节元件结合蛋白、过氧化物酶体增殖物激活受体等信号分子还参与细胞内胆固醇的维稳过程[8,9]。因此,生理状态下,肾上腺皮质细胞能充分协调有效利用各种途径的胆固醇并转运至线粒体内合成类固醇激素,在肿瘤病理状态下,有报道显示胆固醇代谢、血清胆固醇水平及胆固醇合成抑制剂与结直肠癌的关系密切[10],那么,在肿瘤慢性应激过程中,肾上腺皮质细胞对胆固醇的利用如何?我们以H22 肝癌小鼠为观察对象,深入研究不同大小肝癌的小鼠肾上腺皮质细胞胆固醇摄入、运输、转化、合成、流出及其参与维稳的调控分子表达差异,以阐明肿瘤对肾上腺皮质激素合成前胆固醇利用与稳态的影响。
基于Srb1 与Apoa1 协同作用是小鼠肾上腺皮质细胞摄取血浆胆固醇的主要方式,而Ldlr 对胆固醇的内吞作用也很重要,结果表明肿瘤越大,肝癌小鼠肾上腺Srb1、Apoa1、Ldlr 基因表达升高越显著(P<0.05),相应的蛋白表达检测显示肿瘤大组肾上腺SRB1 蛋白表达显著升高(P <0.05)、而ApoA1蛋白表达在肿瘤大组明显高于肿瘤小组(P <0.05),提示肿瘤越大,肝癌小鼠为适应肿瘤慢性反复的应激,需要摄取更多的胆固醇用于合成皮质激素以抵御应激。Lipe 主要将脂滴中酯化胆固醇分解为游离胆固醇,而Acat1 则是将摄入的胆固醇通过酯化形式储存于脂滴中,结果显示肿瘤大组肝癌小鼠肾上腺Lipe 和Acat1 基因表达显著低于肿瘤小组(P <0.05),提示肿瘤大的肝癌小鼠为适应肿瘤慢性反复的应激,随时启动fight or flight response、相比脂滴中胆固醇的储备量减少。然而,Abca1 和Abcg1主要负责将胞内过量的胆固醇逆向转出胞外,结果显示肿瘤大组肝癌小鼠肾上腺Abca1 和Abcg1 基因表达显著低于肿瘤小组(P <0.05),提示肿瘤大的肝癌小鼠肾上腺皮质细胞内胆固醇流程减少,主要用于线粒体内合成皮质激素。然而内质网自身合成胆固醇的关键酶Hmgcr 在各组间无显著性变化。
细胞主要通过调节胆固醇的胞内合成、胞外摄取、酯化及外流等途径之间的平衡以维持正常的胞内胆固醇浓度,其中,Lxr 和Srebps 对维持细胞内胆固醇平衡发挥重要作用。结果显示肿瘤大组肝癌小鼠肾上腺Srebp-1c、Lxrα 与Rxrα 基因表达无明显变化,而肿瘤小组Srebp-1c、Lxrβ 与Rxrα 基因表达显著升高(P <0.05),提示肿瘤越大,因胆固醇更多用于运输至线粒体内合成皮质激素、流出胞外减少,相应地调节肾上腺皮质细胞内胆固醇稳态的能力减弱。
综上,本研究发现,在肝癌状态下,小鼠血浆HDL-C 含量下降,提示肝脏胆固醇代谢能力减弱,为适应肿瘤慢性反复的应激,瘤体越大者,维持胞内胆固醇稳态能力越弱,即储存于脂滴和流出胞外的胆固醇减少,相反,肾上腺皮质细胞通过摄取血胆固醇并即刻转运至线粒体内合成糖皮质激素,而以适应机体的各种应激反应。结合课题组张园园等研究结果[11],化疗药物局部介入治疗联合索拉非尼灌胃治疗对H22 肝癌小鼠抑瘤作用好,且对中医气血阴阳证候有影响,本研究结果将有助于从内分泌角度拓展认识肿瘤对机体的影响。
[1]Yang T,Espenshade PJ,Wright ME,et al.Crucial step in cholesterol homeostasis:sterols promote binding of SCAP to INSIG-1,a membrane protein that facilitates retention of SREBPs in ER[J].Cell,2002,110:489 -500.
[2]Kalaany NY,Gauthier KC,Zavacki AM,e t al.LXRs regulate the balance between fat storage and oxidation[J].Cell Metab,2005,1:231 -244.
[3]Miller WL,Auchus RJ.The molecular biology,biochemistry,and physiology of human steroidogenesis and its disorders[J].Endocr Rev,2011,32:81 -151.
[4]Cummins CL,Mangelsdorf DJ.Liver X receptors and cholesterol homeostasis:spotlight on the adrenal gland[J].Biochem Soc Trans,2006,34:1110 -1113.
[5]Xia X,Jung D,Webb P,et al.Liver X receptor β and peroxisome proliferator-activated receptor δ regulate cholesterol transport in murine cholangiocytes[J].Hepatology,2012,56:2288-2296.
[6]潘志强,方肇勤,卢文丽,等.不同程度邪毒证H22 肝癌小鼠血液激素含量动态变化分析[J].中国中西医结合杂志,2012,32:1361 -1365.
[7]Livak KJ,Schmittgen TD.Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T))method[J].Methods,2001,25:402 -408.
[8]Yang F,Vought BW,Satterlee JS,et al.An ARC/mediator subunit required for SREBP control of cholesterol and lipid homeostasis[J].Nature,2006,442:700 -704.
[9]Zelcer N,Hong C,Boyadjian R,et al.LXR regulates cholesterol uptake through Idol-dependent ubiquitination of the LDL receptor[J].Science,2009,325:100 -104.
[10]杨永涛,盛华,李志文,等.胆固醇代谢与结直肠癌的关系及其机制[J].中华内分泌代谢杂志,2014,30(3):254-257.
[11]张园园,方肇勤,王艳明.不同治疗方案对H22 肝癌荷瘤小鼠的疗效比较[J].中国实验动物学报,2014,22(3):67 -71,77.
