冰己抑瘤丸对胶质瘤患者化疗敏感性及P21、VEGF表达的影响
2015-02-03王存吉肖茂良
王存吉 肖茂良
[摘要] 目的 探讨冰己抑瘤丸对胶质瘤患者化疗敏感性及P21、VEGF表达的影响。 方法 将90例确诊为神经脑胶质瘤的患者随机分为A组(冰己抑瘤丸+替莫唑胺)30例、B组(汉防己+替莫唑胺)30例、C组(安慰剂+替莫唑胺)30例。对比3组总有效率、化疗敏感率及毒副反应发生率。分析治疗前后3组P21、VEGF表达水平的变化。 结果 A组总有效率、化疗敏感率高于B、C组(P<0.05),毒副反应发生率低于B、C组(P<0.05)。A组治疗后P21、VEGF表达水平显著低于B、C组(P<0.05)。 结论 冰己抑瘤丸可提高胶质瘤患者化疗敏感性及治疗效果,抑制P21、VEGF表达水平,促进患者预后。
[关键词] 冰己抑瘤丸;脑胶质瘤;化疗敏感性;P21蛋白;血管内皮生长因子
[中图分类号] R979.1 [文献标识码] A [文章编号] 1674-4721(2014)12(c)-0086-03
脑胶质瘤是颅内常见的原发肿瘤,化疗是治疗脑胶质瘤常用的治疗方法,替莫唑胺(TMZ)由于毒副作用小,已成为治疗胶质瘤的有效药物之一[1]。TMZ不直接发挥作用,在生理pH下,经非酶途径自发快速转化为活性化合物,从而起抑制肿瘤生长及增殖的作用,但患者容易对TMZ产生耐药性,影响其在脑胶质瘤中的应用效果[2]。有研究表明,胶质瘤的多药耐药性与P21蛋白及血管内皮细胞因子过度表达有关[3]。相应的转运蛋白抑制剂可以阻断多药耐药机制,对肿瘤耐药有一定的逆转作用[4]。中药汉防己的提取物汉防己碱(TET)可逆转多种实体瘤的耐药,同时能有效抑制肿瘤生长,通过应用冰片开放血-脑脊液屏障增加汉防己在瘤体内浓度[5]。本研究探讨冰己抑瘤丸对胶质瘤患者化疗敏感性及P21、VEGF表达的影响,旨在为脑胶质瘤患者临床治疗提供指导。
1 资料与方法
1.1 一般资料
选取2012年5月~2014年5月在本院肿瘤科收治的90例神经胶质瘤为研究对象,纳入标准:①经病理组织确诊为神经胶质瘤;②ECOG评分≤2分;③6个月内未接受过烷化剂化疗;④签署知情同意书。排除标准:①有化疗禁忌证者;②已知对本研究用药存在过敏者;③合并其他疾病预计不能进行本研究者;④精神疾病或不能配合治疗者。根据随机数字表分为冰己抑瘤丸+TMZ组(A组)、汉防己+TMZ组(B组)、安慰剂+TMZ组(C组),各30例。A组:男16例,女14例;年龄18~75岁,平均(42.9±3.4)岁;KAP评分52~75分,平均(65.3±4.3)分;临床分期:Ⅲ级15例,Ⅳ级15例;肿瘤直径3~10 cm,平均(5.3±0.8) cm。B组:男15例,女15例;年龄18~74岁,平均(43.2±3.6)岁;KAP评分54~75分,平均(66.3±4.8)分;临床分期:Ⅲ级16例,Ⅳ级14例;肿瘤直径3~10 cm,平均(5.4±1.1) cm。C组:男16例,女14例;年龄18~74岁,平均(42.9±2.2)岁;KAP评分54~75分,平均(65.2±4.3)分;临床分期:Ⅲ级14例,Ⅳ级16例;肿瘤直径3~11 cm,平均(4.9±0.8) cm。3组临床资料比较差异无统计学意义(P>0.05),具有可比性。
1.2 方法
3组均行标准TMZ化疗方案6个周期,研究中所用冰己抑瘤丸、汉防己及安慰剂均由本院药剂科制备,服用方法均为2次/d,服TMZ开始连服21 d停7 d。①TMZ治疗方案:治疗28 d为1个周期,最初剂量为按体表面积口服一次150 mg/m2,1次/d,在28 d为1个治疗周期内连续服用5 d;如果治疗周期内,第22天与第29天(下一个周期的第1天)测得的绝对中性粒细胞数(ANC)≥1.5×109/L,血小板数为≥100×109/L时,下一个周期剂量为按体表面积口服一次200 mg/m2, 1次/d,在28 d的治疗周期内连续服用5 d;在治疗期间,第22天(首次给药后的21 d)或其后48 h内检测患者的全血数,之后每星期测定一次,直到测得的ANC≥1.5×109/L,血小板数≥100×109/L时,再进行下一个周期的治疗;在任意治疗周期内,如果测得的ANC<1.0×109/L或者血小板数<50×109/L时,下一个周期的剂量将减少50 mg/m2,但不得低于最低推荐剂量100 mg/m2。②冰己抑瘤丸制备:以汉防己超微颗粒4.5 g及冰片0.15 g制成胶囊,为单次用量。③汉防己:以汉防己超微颗粒4.5 g制成胶囊,为单次用量。④安慰剂:以面粉4.5 g制成胶囊,为单次用量。
1.3 疗效评价
治疗结束后采用RECIST 1.1标准对患者近期疗效进行评价,完全缓解(CR):病灶疾病消失或肿瘤直径<10 mm;部分缓解(PR):病灶较治疗前缩小体积>30%;疾病稳定(SD):患者病灶既无增长又不见消失;疾病进展(PD):病灶较治疗前体积增长>20%。总有效(RR)率=(CR+PR)例数/总例数×100%。
1.4 评价方法
①化疗敏感性:采用影像学方法根据患者治疗前后肿瘤大小、病灶密度、瘤体血供情况进行评定。肿瘤直径较之前显著下降>50%,病灶密度显著减少,瘤体血供水平下降则为敏感。②P21蛋白、VEGF水平:采用ELISA法测定两组患者血清P21蛋白、VEGF水平。P21蛋白试剂盒由上海基免生物技术有限公司提供,VEGF试剂盒由上海酶联生物科技有限公司提供。③毒副反应:包括恶心呕吐、骨髓抑制、腹泻、口腔黏膜炎等。
1.5 统计学方法
采用SPSS 17.0软件进行统计分析,计量资料以均数±标准差(x±s)表示,组间比较采用方差分析,进一步两两比较采用LSD-t法,计数资料采用χ2检验,以P<0.05为差异有统计学意义。
2 结果
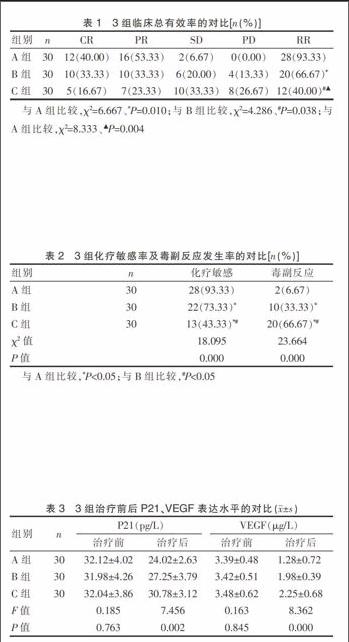
2.1 3组临床总有效率的对比
A、B组总有效率显著高于C组,A组总有效率高于B组,差异均有统计学意义(P<0.05)(表1)。
2.2 3组化疗敏感率及毒副反应发生率的对比
A组化疗敏感率高于B、C组(P<0.05),毒副反应发生率低于B、C组(P<0.05)(表2)。
2.3 3组治疗前后P21、VEGF表达水平的对比
A组治疗后P21、VEGF表达水平显著低于B、C组(P<0.05)(表3)。
3 讨论
脑胶质瘤常使用烷化剂进行治疗,传统烷化剂副作用大,新型烷化剂TMZ毒副作用小,已成为治疗胶质瘤的有效药物之一[6-7]。TMZ不直接作用于肿瘤组织,在生理pH下,经非酶途径自发快速转化为活性化合物。TMZ细胞毒性作用主要是通过对DNA鸟嘌呤的甲基化作用[8]。临床实践表明胶质瘤术后化疗的临床效果仍难以遏制肿瘤生长,其原因与胶质瘤常发生耐药机制有关[9]。增加脑胶质瘤化疗敏感性对提高患者治疗效果,促进患者预后具有重要意义。
近年研究发现,很多有效的逆转剂都存在作用靶点单一、有较多不良反应等缺点,大大限制了临床应用[10]。血-脑脊液屏障阻止了大多药物进入胶质瘤,使药物的选择谱更为狭窄是导致肿瘤耐药的重要机制[11]。近年研究发现中医冰片能有效开放血-脑脊液屏障,口服冰片后可经胃肠迅速吸收,5 min后即可透过血-脑脊液屏障进入脑组织[12]。另有研究表明,冰片能明显抑制细胞膜上P-gp的活性,从而使进入化疗的药物被排除的概率降低[13]。本研究结果显示,A组总有效率、化疗敏感率高于B、C组(P<0.05),毒副反应发生率低于B、C组(P<0.05),从而提示以冰片开放血-脑脊液屏障可有效增加汉防己在瘤体内浓度,提高汉防己抑瘤效果,同时能增加化疗药物的敏感性,使机体抗肿瘤能力大大提高。可能原因如下:冰己抑瘤丸能有效改善血-脑脊液屏障结构,增加吞饮小泡数量,促使基膜局部增厚、分层,减少血管壁外周胶质膜数量生成,使脑组织间有完整的紧密连接[14]。
近年研究发现,P21癌蛋白与肿瘤的发生及进展具有密切的关系,它是Ras基因突变后形成的蛋白,其高表达水平可作为细胞癌前病变的标志[15]。VEGF可调节血管的生成及生长,并通过与受体结合促使血管及淋巴管生成。癌细胞的生长、转移依赖新生血管的形成,而VEGF是最有效的促血管生长因子,因此通过增强机体免疫功能,抑制P21癌蛋白及VEGF表达水平,对抑制肿瘤生长及迁移具有重要作用。本研究结果显示,3组治疗后P21、VEGF水平均低于治疗前(P<0.05),A组疗后P21、VEGF水平均低于B、C组,且B组低于C组(P<0.05),这提示冰己抑瘤丸治疗脑胶质瘤的作用机制主要通过抑制P21、VEGF水平,阻断肿瘤血管生成,从而抑制肿瘤增生、黏附、侵袭及转移等一系列生理过程抑制肿瘤的生长及转移,因此能有效改善患者病情,提高患者生存质量。
综上所述,冰己抑瘤丸可增加胶质瘤患者化疗敏感性及治疗效果,抑制P21、VEGF表达水平,促进患者预后。
[参考文献]
[1] 王天晓,雷凯健.异汉防己碱增强多药耐药肿瘤细胞对阿霉素的敏感性及其机制[J].肿瘤防治研究,2009,36(1):1-4.
[2] 徐萌,周蓓.汉防己甲素逆转肺癌化疗耐药和凋亡抗性的实验研究[J].新中医,2006,38(6):90-91.
[3] Yu B,Ruan M,Dong X,et al.The mechanism of the opening of the blood-brain barrier by borneol:a pharmacodynamics and pharmacokinetics combination study[J].J Ethnopharmacol,2013,150(3):1096-1108.
[4] McCarthy RC,Kosman DJ.Activation of C6 glioblastoma cell ceruloplasmin expression by neighboring human brain endothelia-derived interleukins in an in vitro blood-brain barrier model system[J].Cell Commun Signal,2014,12(1):65-66.
[5] 陈宝安,王为,林国为,等.汉防己甲素抗肿瘤作用的研究进展[J].南京中医药大学学报(自然科学版),2001,17(2):128-130.
[6] 顾建华,郭仁德,张志斌,等.汉防己甲素对人胰腺癌耐药细胞株SW1990-GEM多药耐药性的逆转机制[J].天津医药,2013,41(1):48-51.
[7] 殷华芳,钱晓萍,刘宝瑞,等.汉防己甲素抗肿瘤机制研究进展[J].现代肿瘤医学,2011,19(3):582-584.
[8] Park MJ,Kim JY,Lee JS,et al.Emodin suppresses maintenance of stemness by augmenting proteosomal degradation of EGFR/EGFRv Ⅲ in glioma stem cells[J].Stem Cells Dev,2014,17(5):96-98.
[9] 闫婧,王婷婷,钱晓萍,等.汉防己甲素抑制恶性腹腔积液中原代肿瘤细胞作用的观察[J].中华肿瘤防治杂志,2008,15(24):1868-1871.
[10] Hu J,Zhang Y,Ding S,et al.Dynamic observation on opening of the blood-brain barrier in the primary stage of severely scalded rabbits,a multimodal study[J].J Burn Care Res,2014,7(2):78-79.
[11] 王振华,刘云会,马腾,等.大鼠局灶性脑缺血再灌注早期血脑屏障通透性变化的研究[J].中国医科大学学报,2012,41(12):1073-1076.
[12] 吕旭潇,孙明江,孙凤志,等.冰片促进药物透过血脑屏障的研究进展[J].中国中药杂志,2012,37(7):878-881.
[13] 倪彩霞,曾南,许福会,等.芳香开窍药对脑缺血再灌注损伤大鼠血脑屏障影响的实验研究[J].中国中药杂志,2011,36(18):2562-2566.
[14] 王淑兰,邹艳萍.复方汉防己颗粒治疗肝硬化160例[J].中国药业,2014,23(16):102-103.
[15] Banerjee S,Lu J,Cai Q,et al.EBNA3C augments Pim-1 mediated phosphorylation and degradation of p21 to promote B-cell proliferation[J].PLoS Pathog,2014,10(8):78-79.
(收稿日期:2014-11-07 本文编辑:李亚聪)
