老化对睡眠依赖性记忆巩固的影响*
2015-02-02贵文君
贵文君 雷 旭 袁 宏 高 东 喻 婧
(1西南大学心理学部,重庆 400715)(2第三军医大学附属大坪医院野战外科研究所睡眠心理中心,重庆 400042)
1 引言
睡眠占人生命 1/3左右的时间,不仅影响人的生理机能,也会影响人的认知功能。1994年研究证实了睡眠能够促进记忆巩固(Karni;Tanne;Rubenstein;Askenasy,&Sagi,1994)。在随后的10年,睡眠依赖性学习和记忆巩固方面的研究增长了近 5倍,而这种通过睡眠发生的记忆巩固效应被称为睡眠依赖性记忆巩固(sleep-dependent memory consolidation,SDC)(Stickgold,2005)。SDC 效应广泛存在于人和动物群体中,随着年龄的增加,老年人的记忆力不断衰退,与此同时,老年人的睡眠问题也越来越突出,年龄与SDC之间的关系及相关机制成为近年来研究者探讨的热点。研究人员尝试回答老年人SDC效应是否下降以及与年龄相关的SDC效应主要体现在睡眠的哪个阶段等一系列问题。考虑到老年人睡眠质量与记忆功能同时下降(Hornung,Danker-Hopfe,&Heuser,2005;Yaffe,Falvey,&Hoang,2014),深入探讨SDC受老化的影响对老年人记忆的改善具有重要的临床意义。本文分不同记忆类型和睡眠阶段评述SDC效应受老化影响的机制,同时指出异常老化下SDC效应的变化机制,尝试推进学界对老年人睡眠依赖性记忆巩固的研究进程,为老年人睡眠依赖性记忆的改善提供理论基础。
2 老化对睡眠的影响
2.1 神经系统功能方面的变化
睡眠‒觉醒周期(sleep-wake cycle)发生紊乱的几率随着年龄的增长而上升(Cajochen,Münch,Knoblauch,Blatter,&Wirz-Justice,2006)。临床上可见实际睡眠时间减少、睡眠潜伏期延长、夜间觉醒次数增多、白天打盹儿次数增多、睡眠效率降低等现象(Hornung et al.,2005;Phillips &Ancoli-Israel,2001;Spencer,Gouw,&Ivry,2007)。而视交叉上核(suprachiasmatic nucleus,SCN)功能紊乱、松果体增龄性钙化,褪黑素分泌量减少及夜间皮质醇分泌水平上升通常被视为老年人睡眠周期紊乱的神经生物学基础(van Cauter,Leproult,&Plat,2000;Wu &Swaab,2007)。与正常老化相似,在阿尔兹海默症(Alzheimer's disease,AD)临床前期患者中也观察到褪黑素分泌水平的大幅下降及SCN和松果体时钟基因振荡(pineal clock gene oscillation disturbed)紊乱(Wu et al.,2006;Wu &Swaab,2007)。其中,时钟基因振荡是指一系列呈节律表达的时钟基因和编码的时钟蛋白质相互作用,构成一个或者多个反馈回路,以接近于24小时的周期进行昼夜节律振荡(Hardin,Hall,&Rosbash,1990;Sehgal,Price,Man,&Young,1994),这对维持规律的睡眠‒觉醒周期具有重要意义。AD的小鼠模型研究发现 β-淀粉样蛋白(amyloid-β,Aβ)沉积形成后,小鼠的睡眠‒觉醒周期严重紊乱(Roh et al.,2012)。同时另有研究证实Aβ集聚的病人伴随着觉醒增加的现象(Gerstner,Perron,&Pack,2012)。这些结果提示睡眠‒觉醒周期的紊乱有可能成为早期识别AD的一个生物标记。
2.2 睡眠结构的变化
增龄除了对睡眠的神经机制产生影响外,还会使睡眠结构发生变化。根据脑电图特征、眼球运动情况和肌肉张力的变化,睡眠周期可分为非快速眼动睡眠(non-rapid eye movement sleep,NREM)和快速眼动睡眠(rapid eye movement sleep,REM)。前者由浅入深分为睡眠Ⅰ期、睡眠Ⅱ期、睡眠Ⅲ期,其中睡眠Ⅲ期又被称为慢波睡眠(slow wave sleep,SWS)(Iber,Ancoli-Israel,Chesson,Quan,&Westchester,2007)。使用脑电(electroencephalography,EEG)和多导睡眠监测仪(polysomnography,PSG)对老年人的睡眠进行监测发现,相较于轻度睡眠(睡眠Ⅰ、Ⅱ期),SWS占睡眠时间的比例在老化过程中显著下降(Pandi-Perumal,Zisapel,Srinivasan,&Cardinali,2005),而REM睡眠则表现为潜伏期缩短、REM密度减小等(Dykierek et al.,1998;Floyd,Janisse,Jenuwine,&Ager,2007)。此外,大量研究显示老年人睡眠纺锤波(sleep spindles)数量、密度和持续时间均下降,并伴随睡眠Ⅱ期 K-复合波数量和密度的减小(Clemens,Fabó,&Halász,2005;Crowley,Trinder,Kim,Carrington,&Colrain,2002)。已有研究发现睡眠纺锤波参与新旧知识的整合(Tamminen,Payne,Stickgold,Wamsley,&Gaskell,2010),而 K-复合波能隔离感觉皮层传入的刺激,从而保证睡眠的连续性(Jahnke et al.,2012)。区别于正常老化,AD患者的 SWS时间虽然也呈增龄性递减(Dykierek et al.,1998),但AD患者在SWS阶段会出现更高频率的 theta波,其频率跟病情严重程度呈正相关。这被解释为 AD患者的补偿机制,即高频的theta节律补偿由神经元缺失和结构功能紊乱所造成的记忆的严重衰退(Hot et al.,2011)。除AD患者外,研究还发现随着帕金森(parkinson's disease,PD)患者病程的发展,其SWS和REM睡眠也逐渐减少(Diederich,Vaillant,Mancuso,Lyen,&Tiete,2005)。
3 老化对睡眠依赖性记忆巩固的影响
近年来,越来越多的研究证实睡眠参与了记忆巩固的过程,研究证据主要来自以下两方面:1)学习后的睡眠剥夺使记忆成绩下降,而学习后的睡眠帮助提高记忆,直接说明记忆巩固需要在睡眠阶段完成(Gais,Lucas,&Born,2006);2)个体暴露于丰富的环境或者学习后会改变其随后的睡眠结构,间接说明记忆巩固需要睡眠参与(Ganguly-Fitzgerald,Donlea,&Shaw,2006;李洋,王得春,胡志安,2008)。随着神经影像学的发展,SDC效应的神经生理机制更是成为研究者关注的重点。海马‒新皮层对话模型(hippocampo-neocortical dialogue model)认为记忆巩固过程主要包括三个阶段:1)新皮层慢波振荡(neocortical slow oscillations);2)海马再激活(hippocampal reactivations);3)丘脑‒皮层的睡眠纺锤波活动(thalamo-cortical sleep spindles)。SWS期间慢波振荡诱发尖波‒涟漪波(sharp-wave ripple),促使觉醒期间在海马和皮质层编码的信息被重新激活。同时慢波振荡诱导纺锤波发生,伴随着低胆碱能活性和低皮质醇水平,海马信息向新皮层转移,使记忆痕迹在新皮层得到长时存储(Diekelmann &Born,2010;Girardeau &Zugaro,2011;Harand et al.,2012;Walker,2008)。然而随着年龄的增长,老年人的海马和皮质层等开始萎缩(Chowdhury et al.,2011;Hoffstaedter et al.,2015;Mander et al.,2013;Nosheny et al.,2014),其SWS时长和纺锤波的数量也逐渐减少,同时伴随慢波振荡减慢的现象,海马‒新皮层之间的信息转移或因此受到影响。下文将从不同记忆类型、睡眠结构对SDC受正常和异常老化影响的研究进行介绍和评述。
3.1 正常老化对睡眠依赖性记忆巩固的影响
3.1.1 不同记忆类型
记忆类型可分为陈述性记忆和非陈述性记忆,陈述性记忆又分为情景记忆和语义记忆,而非陈述性记忆包括条件反射和程序性记忆(Walker &Stickgold,2004)。研究显示睡眠对陈述性记忆和程序性记忆都会发生巩固效应,但SDC效应受老化影响在不同的记忆类型中表现出不一致的结果。
程序性记忆的SDC效应一直是该领域的研究热点,研究采用的实验任务大多是序列学习任务(sequence-learning task),即被试根据线索提示在屏幕上呈现的空间位置进行相应的手指按键反应。近年来,老化影响程序性记忆SDC效应的研究取得了较为一致的结果。Wilson等(2012)采用序列学习任务考察老年人SDC效应的变化。结果发现相较于及时回忆,青年组在睡眠后延迟回忆阶段的平均反应时显著降低,而中年组和老年组在睡眠前后的反应时下降量并不明显。随后的回归分析发现年龄和睡眠前后变化量呈负相关,提示在经历睡眠之后年龄越大的被试其记忆提高越少。Spencer等(2007)将内隐学习变量引入序列学习任务中,通过呈现不同的指导语将被试分为外显组和内隐组。外显组被告知屏幕上呈现的刺激序列存在规律,而内隐组未被告知。研究表明虽然老年组和青年组在编码阶段达到相似的学习程度,但通过睡眠青年组在两种任务中的平均反应时都显著下降,而睡眠前后老年组在两种记忆任务中的反应时没有显著变化。结果提示,当选择反应时作为统计指标时,老年人不管是外显还是内隐程序性记忆的SDC效应均受损。为了进一步验证老年人SDC效应受损是否由睡眠时间减少所导致,研究者对被试的睡眠日志进行分析,发现老年组平均睡眠时长为7.0小时,青年组为7.3小时,二者并没有显著性差异,提示老年人 SDC效应受损和睡眠时长的增龄性变化没有直接联系(Spencer et al.,2007)。伴随着神经影像技术的发展,与SDC相关的神经机制随年龄的变化也逐渐得到分析与探讨。Fogel等(2014)最近采用午睡的研究范式证实午睡能促进青年人程序性记忆巩固,但对老年人程序性记忆的促进较小。结合PSG和功能性磁共振成像技术(functional Magnetic Resonance Imaging,fMRI),研究还发现老年人程序性 SDC效应下降和睡眠纺锤波数量减少及相关脑区(壳核、纹状体)的激活减弱呈正相关。结果提示睡眠纺锤波振荡减少以及任务执行状态下纹状体激活程度的减弱或可能为老年人SDC效应受损的神经生理机制之一。
而关于陈述性记忆的SDC效应受老化影响的研究结果目前还存在分歧。Wilson等(2012)将被试分为青年组、中年组和老年组,每个年龄组又分为清醒组和睡眠组。清醒组在早上9点开始执行编码和及时回忆任务,当天晚上 9点执行延迟回忆任务,中间经历 12h的清醒时间。而睡眠组在当天晚上九点进行编码和及时回忆任务,第二天早上9点执行延迟回忆任务,期间经历12 h的睡眠时间。他们使用配对词语学习任务(word pair learning task)研究老化对陈述性记忆SDC效应的影响。该任务由互不关联的配对词组构成(e.g.,cat-coach;desk-ice),编码阶段被试依次学习所有配对词组,但在及时回忆和延迟回忆阶段,只呈现配对词组的一半,被试回忆对应的另外一半。结果发现睡眠组所有被试的遗忘率都显著低于觉醒组,即睡眠通过减少学习的遗忘量达到了巩固记忆的目的。然而当纳入年龄因素作分析时发现,睡眠组三个年龄阶段的被试遗忘率并不显著,研究者认为陈述性记忆 SDC效应并未随着增龄而衰减(Wilson et al.,2012)。除此之外,有研究组从情景记忆的角度比较青年人和老年人的SDC效应。他们使用韦氏记忆量表第三版(Wechsler Memory Scale III,WMS-III)的逻辑记忆测验部分和问题清单的形式(由 12个问题组成,要求被试自述某天早上或在此前一天晚上他们所经历的第一次/最后一次对话、接到的第一个/最后一个电话等),结果发现,睡眠组不同年龄阶段的被试在两种任务中的记忆成绩都显著提高,并且睡眠时间越长的老年人,其成绩提高的幅度越大(Aly &Moscovitch,2010)。与此相反,最近一项研究使用视空二维目标定位任务(visuospatial two-dimensional objectlocation task),即学习阶段,在屏幕上任意两个空间方格里同时呈现配对的两张图片,被试通过编码记住他们各自的空间位置,而回忆阶段只呈现其中一张图片的空间位置,被试回忆与之对应的另一张图片的位置,并操纵鼠标将其拖入相应的空间方格里。结果显示睡眠条件下与觉醒条件下老年人的遗忘率没有显著差异,只在青年组观察到了显著的 SDC效应,提示老年人情景记忆的SDC效应可能受损(Cherdieu,Reynaud,Uhlrich,Versace,&Mazza,2014)。
综上,正常老化对SDC效应的影响受到记忆类型的调节。多数研究表明非陈述记忆(尤指程序性记忆)的 SDC效应随着年龄的增加而衰减。虽然陈述性记忆(尤指情景记忆)下降是老年人记忆受损的首要特征,然而陈述性记忆的SDC效应受老化影响的研究结果却并不一致。可能的解释包括:1)实验材料的异质性或许是导致结果不一致的因素之一。当记忆材料涉及到情绪和自我加工的时候,SDC效应并不会随着年龄的增加而下降(Carstensen &Turk-Charles,1994;Rahhal,May,&Hasher,2002)。而Aly组采用的实验任务刚好是涉及到自我加工的情景记忆;2)被试的异质性,特别是老年人的个体差异非常大。在Wilson等的研究中(2012)发现睡眠降低了各年龄组被试的遗忘效率,即SDC的年龄效应不显著。但该结果是在排除学习阶段成绩不达标的被试的情况下得出的,当纳入所有被试做分析时,SDC年龄效应却变得显著;3)计算指标的差异。由于陈述性记忆痕迹容易消退,因此该类记忆的巩固效应通常指在睡眠后的再测任务中表现出较小的遗忘效应,而非记忆水平的提高。Wilson研究组采用的是特定序列组块之间平均反应时的差值来定义遗忘效应的大小,而 Aly研究组的计算指标是后测所能回忆的事件数量与所给予的事件总数的比率。近年来不同记忆类型SDC效应受老化影响的研究及其研究结果概述见表1。
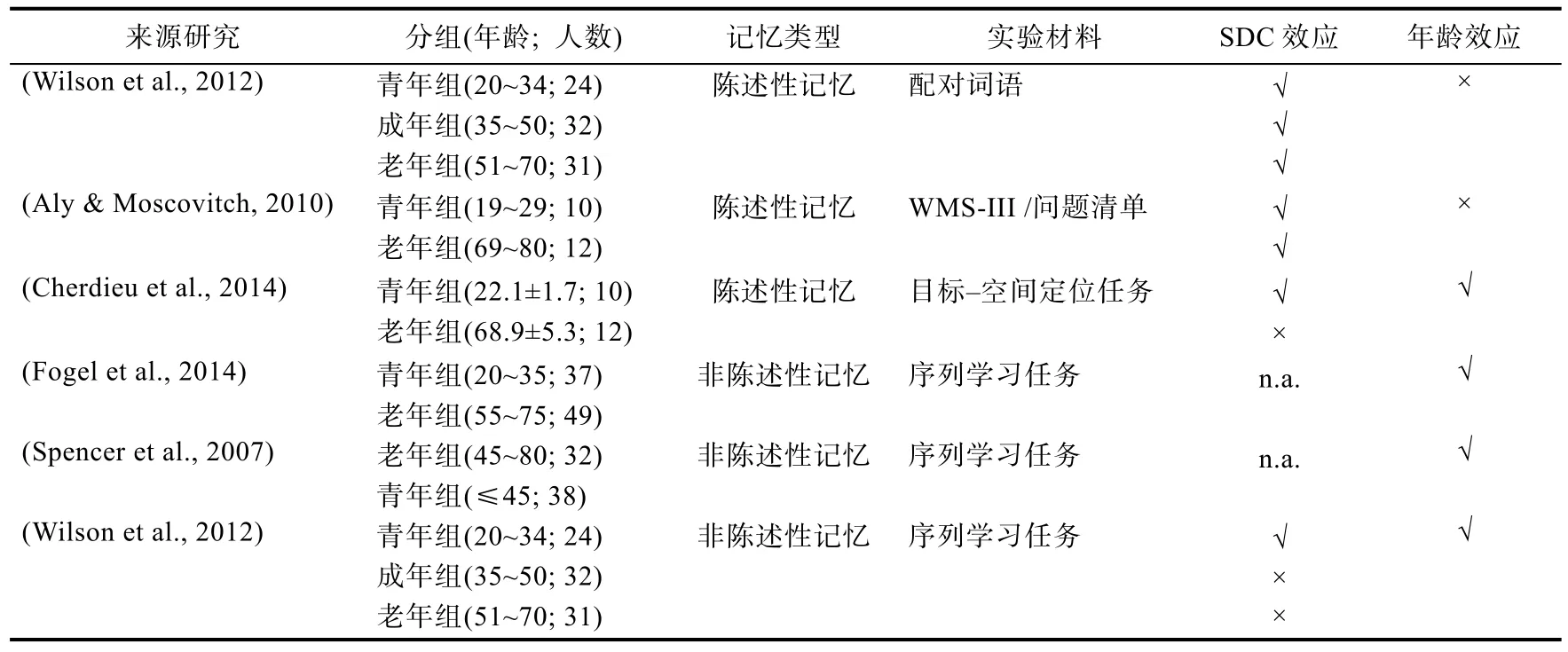
表1 近年来不同记忆类型SDC效应受老化影响的文献总结
3.1.2 不同睡眠阶段
fMRI研究显示觉醒时期与认知任务相关的脑区在睡眠阶段被重新激活(Fogel et al.,2014;Sweegers,Takashima,Fernandez,&Talamini,2014)。而不同记忆类型发生 SDC效应的睡眠阶段存在差异,目前主要存在两种假说:1)双处理模型假说,认为程序性记忆的巩固主要发生在REM阶段和睡眠Ⅱ期,而陈述性记忆/情景记忆的巩固主要发生在SWS阶段(Plihal &Born,1997);2)序列假说,即不考虑记忆的类型,认为 NREM 和REM 睡眠的循环对记忆巩固的效果有着十分重要的意义(Giuditta et al.,1995)。随着年龄的增加,老年人的SWS和REM比例逐渐减少(Mazzoni et al.,1999),不同睡眠阶段下老年人记忆巩固效应的改变成为研究者关注的重点。
Hornung研究组(2007)通过设置REM睡眠剥夺组(在快速眼动睡眠阶段唤醒被试)与REM增加组(剥夺后自然恢复REM睡眠以及注射药物增加REM 睡眠),发现不管是通过剥夺还是自然恢复REM睡眠时长,其动作技能成绩受影响都较小。但在实验前六晚连续给被试注射乙酰胆碱酯酶抑制剂,被试REM睡眠比例增加的同时动作技能成绩也得到显著提高(Hornung,Regen,Danker-Hopfe,Schredl,&Heuser,2007)。该研究表明老年人REM睡眠时间的长短并不直接导致其程序性记忆SDC效应量的增加或降低,而胆碱能的活性可能是参与 REM 睡眠依赖性记忆巩固的一个重要成分(Hornung,Regen,Schredl,Heuser,&Danker-Hopfe,2006)。为了探索老年人 SWS和陈述性记忆巩固之间的关系,Cherdieu等(2014)采用视空二维目标定位任务,同时使用PSG记录老年人的睡眠。结果表明老年人的SDC效应减弱,但在对PSG数据分析时发现尽管老年人的睡眠效率和总睡眠时间减少,但SWS所占比例变化并不明显,即老年人SWS比例的变化并不是导致其 SDC效应减弱的直接因素(Cherdieu et al.,2014)。但另有研究指出,睡眠前中年组和青年组达到相似的学习程度,在经过睡眠早期(SWS所占比例较大)后,中年人回忆配对词的正确率显著低于青年人,同时EEG也记录到青年人 SWS占睡眠的比例显著大于中年人。而在睡眠晚期(SWS所占比例较小)的被试中,中年组与青年组回忆配对词的正确率没有显著差异,并且该实验条件下的所有年龄组被试的回忆成绩都比经历睡眠早期的被试差。当平衡两个年龄组的SWS比例,例如将经历睡眠早期的中年组和经历睡眠晚期的青年组相比,两个组的回忆成绩的正确率不存在显著差异。研究表明30岁之后,SWS比例随着年龄的增加而显著衰减,这些结果提示从中年时期开始下降的陈述性记忆SDC效应可能与早期睡眠中SWS时间的减少相关。该研究对老年人 SDC效应的损伤做出了间接回答,但SWS和老年人 SDC效应之间的关系尚需进一步验证(Backhaus et al.,2007)。
综上,年龄因素究竟通过影响睡眠的哪个阶段而导致SDC效应损伤,现有研究并没有给出明确的结论。未来应加强其影响因素的实证研究,更好地控制实验变量,明确睡眠结构与记忆巩固之间的关系:1) SWS和REM变化比例的相对差异。虽然老年人的SWS和REM占夜间睡眠比例都呈下降趋势,但两者变化的相对比例是否存在差异及其与SDC效应之间的关系亟需进一步的实证研究加以证实。Backhaus研究组(2007)显示SWS占睡眠比例从 30岁开始显著下降,并伴随着陈述性记忆巩固效应的下降,而REM受年龄的影响较小(Backhaus et al.,2007)。但该年龄效应并没有在老年群体中得到直接验证,未来加强各睡眠阶段相对比例的变化与记忆巩固的关系的研究或可以更好地验证老年人SDC效应与睡眠结构之间的关系;2)关于睡眠分期与记忆巩固,一些研究者并不赞同陈述性记忆巩固发生在SWS阶段,而程序性记忆巩固在需要在 REM 睡眠期完成的观点,他们认为NREM和 REM睡眠周期的循环性对记忆巩固的效果有着十分重要的意义(Plihal,&Born,1997)。强行把SWS和REM分开讨论,可能会导致研究结果因缺乏SWS和REM周期连续性而受到影响(Gais,Plihal,Wagner,&Born,2000)。今后应加强对睡眠分期理论的实证研究,才能更好地探索睡眠分期和记忆巩固之间的关系;3)随着年龄的增长,除了睡眠质量下降及睡眠结构的改变外,老年人身体机能的其他方面也出现衰退的现象,诸如乙酰胆碱活性的降低、与睡眠相关脑区的萎缩等,这些因素是否得到控制也会对研究结果产生影响。在今后的研究中应试图综合多因素,尝试建立老化影响SDC效应的多通道混合模型。
3.2 异常老化对睡眠依赖性记忆巩固的影响
相较于正常老化个体,记忆衰退问题在病理性老化个体中更加突出,如 AD、PD、轻度认知障碍(mild cognitive impairment,MCI)、老年抑郁症等,他们的慢波睡眠时间更少,睡眠效率也更低(Chen et al.,2009;Hot et al.,2011;Naismith et al.,2011;Westerberg et al.,2012;Wu,Tseng,Yuan,Hsieh,&Hu,2014)。
研究者采用情景记忆任务对 AD患者和正常对照组做比对研究,结果发现睡眠后正常对照组在两种延迟回忆任务中的SDC效应均大于AD患者(Hot et al.,2011)。类似的结果在MCI患者上也得到了证实。MCI患者主要表现为陈述性记忆受损,其发展成为痴呆的年转归率为 10%~15%(Gauthier et al.,2006),而正常老年人仅为 1% ~2%。研究发现经过睡眠之后 MCI组在配对词语回忆和面孔再认任务(陈述性记忆)中的SDC效应显著低于正常对照组,即正常对照组通过睡眠提高了陈述性记忆成绩,而MCI组成绩提高幅度较小(Westerberg et al.,2012)。深入探究异常老化群体的睡眠神经机制和SDC效应的关系,发现AD和MCI患者均表现出睡眠纺锤波数量和密度的显著下降,并与其SDC效应下降显著正相关。而在脑电节律方面,与MCI患者theta波频率下降不同的是,AD患者的theta波频率非常高,且频率越高的患者SDC效应受损越严重,提示theta波的活动可能是 AD患者记忆严重受损的一种补偿机制(Hot et al.,2011;Rauchs et al.,2008;Westerberg et al.,2012)。
此外,研究人员还对另一种多发于老年人群的神经退行性疾病PD患者的SDC效应进行了研究。Terpening研究组(2013)首次探讨了睡眠结构对PD患者动作记忆巩固的影响。研究发现PD组和正常控制组的再测成绩都没有通过睡眠得到显著提高,但和 PD组相比,正常控制组被试的SWS持续时间更长,第二天的再测成绩也更好。提示PD患者程序性记忆的SDC效应受损,且程度比正常控制组更甚(Terpening et al.,2013)。最近台北的一项研究发现经过睡眠之后 PD患者的视觉记忆成绩比觉醒时期得到了提高,即 PD患者的SDC效应依然保留(Wu et al.,2014)。同时,关于抑郁症患者的研究表明,尽管被试的记忆成绩在学习阶段不存在显著差异,但和觉醒组相比,睡眠条件下正常对照组的动作记忆得到显著提高,而抑郁组中18%的被试并未表现出SDC效应。值得注意的是这种差异只有在年龄大于 30的群体中才显著(Dresler,Kluge,Genzel,Schüessler,&Steiger,2007;Dresler,Kluge,Genzel,Schüssler,&Steiger,2010)。老年抑郁症患者的SDC是否区别于正常老化的衰退目前尚缺乏直接证据。
综上,在异常老化群体中,受不同病理变化的影响,SDC效应的变化并不一致:1)和正常控制组相比,认知障碍患者情景记忆的SDC效应下降更加显著,这与他们情景记忆严重受损的临床表现十分吻合;2)老化对PD患者SDC效应的影响不一致,这可能由实验材料不一样所致,Terpening研究组主要采用序列学习任务(程序性记忆),而另一研究采用的是视觉任务(陈述性记忆);运动障碍是 PD患者的典型症状,提示患者在执行动作技能任务时可能会受到一定影响,导致其记忆成绩下降;3)值得注意的是,受神经退行性病变影响,与 SDC效应相关的脑电节律,如睡眠纺锤波与 theta波的活动或可成为老年人相关疾病诊治的一个重要指标。
4 讨论与展望
4.1 老化‒睡眠‒记忆交互模型
增龄会改变睡眠神经机制(SCN功能紊乱、松果体钙化等)以及睡眠结构(SWS比例下降、REM潜伏期延长、睡眠纺锤波数量和密度的减少等)(Farajnia,Deboer,Rohling,Meijer,&Michel,2014;Fogel et al.,2014;Mahlberg et al.,2009;Moraes et al.,2014)。与睡眠周期节律紊乱相似,负责个体记忆的神经机制也会随年龄的增长而衰退。迄今为止,对老年人记忆减退及其与睡眠相关的生理机制的探讨主要集中在以下几个方面:1)与记忆相关脑区的突触发生形态学变化。睡眠内稳态假说认为睡眠的目的在于减弱脑内突触连接强度至基线水平,以便于随后的学习记忆。然而老年人突触神经元可塑性的降低导致突触的连接强度无法在睡眠过程中顺利减弱至基线水平,从而影响接下来学习记忆的存储;2)老年人中枢神经递质系统的衰退,如胆碱能神经元退化以及胆碱能核团体积减少(Fibiger,1991)。已有研究表明老年人乙酰胆碱活性的降低是影响睡眠记忆巩固的重要因素(Hornung et al.,2006);3)最近更有研究指出受老化影响,脑区协同性和记忆功能呈显著负相关,即随着脑区协同性的增加记忆功能逐渐减弱(Chan,Park,Savalia,Petersen,&Wig,2014)。除此之外,同时记录 EEG和 fMRI数据,发现睡眠纺锤波参与青年人皮层‒纹状体网络的调节,该网络直接参与记忆巩固过程;而老年人的睡眠纺锤波仅调节皮层‒小脑网络,该网络不参与记忆巩固的过程(Fogel et al.,2014)。这些研究结果提示相关脑区功能的增龄性改变以及某些睡眠机制对记忆巩固相关的脑网络调节作用的减弱也可能是老年人记忆巩固衰退的潜在机制。
睡眠中的记忆巩固是记忆痕迹选择性再活化的结果,并且和皮质醇、乙酰胆碱的水平相关(BuzsÁk,1998;Gai &Born,2004;Power,2004)。觉醒期间,对于刺激信息的编码主要在新皮层和海马发生(图1绿色箭头所示)。而在睡眠(尤其是SWS)期间,伴随着尖波和睡眠纺锤波的同步振荡活动,觉醒时期被编码的信息在海马脑区被重新激活。而REM睡眠期间低水平的皮质醇和高水平的乙酰胆碱促使记忆痕迹从海马通向新皮层并在此处得到巩固与长时存储(图1黄色箭头所示)(Harand et al.,2012)。然而老年人皮质醇水平的上升以及乙酰胆碱活性的降低(图1①);SWS、慢波与尖波同步振荡的减少(图1②③),加上与记忆巩固相关的脑区的(特别是前额叶皮层)结构与功能的变化(图1④),导致老年人的 SDC效应受到干扰(Hornung et al.,2007;Jiang et al.,2014;Wu &Swaab,2007)。
综上,老年人SDC效应受损可能至少由三方面导致:1)睡眠记忆巩固神经通路受损,包括皮质醇水平上升和乙酰胆碱水平降低,尖波和慢波同步振荡活动减弱,前额皮质层萎缩(图1红圈所示);2)睡眠神经生理机制改变,主要指由于 SCN节律紊乱、松果体钙化以及褪黑素夜间分泌水平降低所造成的睡眠‒觉醒周期紊乱;3)脑功能改变及脑网络失调,即随着年龄的增加,脑区功能分化性减弱,由于各个脑区分工变得不明显,一项任务的完成需要同时调动几个脑区,导致大脑负荷过重。同时,某些睡眠机制(如睡眠纺锤波)对记忆巩固相关的脑网络的调节作用减弱,在一定程度上损伤老年人的SDC效应。

图1 SDC效应受老化影响的神经模型(资料来源:Harand et al.,2012)
4.2 同步采集脑电和脑成像数据
对于睡眠的研究最早得益于EEG技术,它提供了人们睡眠或觉醒期的客观脑活动指标。但受限于EEG技术的空间分辨率,该方面的研究通常无法对睡眠相关的精细解剖结构进行深入探讨。而睡眠神经成像借助于 fMRI等技术,可对全脑血氧代谢进行无创记录。近年来 fMRI以其毫米量级的空间分辨率帮助人们找到了睡眠的关键性脑解剖结构(Nofzinger,2005)。前期存在同步采集年轻被试睡眠时期的脑电和脑成像数据的研究,但考虑到老年人更加容易受到核磁扫描过程中的噪声干扰等因素,老年群体的现有研究多是在睡眠阶段采集脑电数据,在记忆任务阶段采集脑成像数据。未来研究应着力于改良实验范式以及实验室环境,结合 EEG和 fMRI技术,我们将能够同步采集老年人睡眠分期的数据以及脑区活动的数据,特别是不同睡眠分期下海马‒新皮层之间的连接与激活的变化,由此可以对老化过程中SDC效应的动态变化提供更直接的证据(Lei,Wang,Yuan,&Chen,2014;Lei,Wang,Yuan,&Mantini,2014)。
4.3 从睡眠角度提出记忆干预的方案
虽然分别针对睡眠和记忆干预的研究已经存在(Chan,Sze,Woo,&Yu,2014;Pa et al.,2014),但SDC通路老化作为老年人记忆下降的影响因素之一,从睡眠对记忆巩固影响的角度改善老年人记忆的研究目前尚还缺乏:1)已有研究发现服用乙酰胆碱酯酶抑制剂在增加老年人 REM 睡眠的同时也提高了他们的记忆成绩(Hornung et al.,2007)。但该研究旨在探讨 REM和记忆巩固之间的关系,乙酰胆碱酯酶抑制剂、REM和记忆成绩之间的因果关系以及该制剂是否可用于老年人临床记忆的改善还有待进一步考究;2)此外,有研究表明睡前高强度的动作技能训练可以增加睡眠纺锤波的数量,而睡眠纺锤波和程序性记忆的巩固显著相关,提示睡前通过一定程度的肢体运动或可增强老年人记忆巩固的效果,从而达到改善记忆的目的(Fogel &Smith,2006;Morin et al.,2008);3)美国西北大学研究人员(2009)证实在SWS阶段再次听到与睡前记忆内容相匹配的声音(例如,猫的图片‒猫叫声)有助于记忆巩固,而在觉醒时期听声音并没有加深记忆的效果(Rudoy,Voss,Westerberg,&Paller,2009)。最近也有研究发现SWS阶段重新给被试播放声音刺激能提高其外显记忆成绩(Cousins,El-Deredy,Parkes,Hennies,&Lewis,2014)。类似的,Rasch研究组(2007)也证实在 SWS阶段再次给被试施加气味刺激能促进其陈述性记忆的巩固(Rasch,Büchel,Gais,&Born,2007)。这一系列的研究表明,在睡眠时给予大脑额外的刺激信息能够巩固之前已经形成的记忆,然而这些效应在老年群体中是否存在尚未得到验证。未来研究可以考虑在睡眠阶段,从听觉、嗅觉以及感觉刺激等通路施加刺激,考察在老年群体中是否存在相应的记忆巩固效应。如果老年人的记忆能够在睡眠之中通过额外的刺激信息得到巩固,比如单纯地通过听声音,闻气味,光线调整就可达到记忆巩固的目的,那将为老年人临床记忆改善提供一个有效且易操作的全新思路。
5 结语
探究老化对SDC效应的影响,将有利于深入揭示增龄与 SDC效应以及记忆衰退之间的关系,为改善老年群体的睡眠问题、提高其记忆功能提供理论依据。从针对病理性老化群体的基础研究中,发现与SDC效应异常变化相关的睡眠波和睡眠阶段,将对于其临床诊断与检测提供一种新的思路。基于前人研究,本文梳理了老化和睡眠及SDC效应之间的关系,搭建老化、睡眠问题与记忆下降之间的交互模型,并试图从睡眠干预的角度寻找改善老年人记忆的方法,理论模型尚待实证研究的进一步考证。
李洋,王得春,胡志安.(2008).睡眠的记忆巩固功能研究进展.生物化学与生物物理进展,35,1219–1224.
Aly,M.,&Moscovitch,M.(2010).The effects of sleep on episodic memory in older and younger adults.Memory,18,327–334.
Backhaus,J.,Born,J.,Hoeckesfeld,R.,Fokuhl,S.,Hohagen,F.,&Junghanns,K.(2007).Midlife decline in declarative memory consolidation is correlated with a decline in slow wave sleep.Learning &Memory,14,336–341.
BuzsÁk,G.(1998).Memory consolidation during sleep:A neurophysiological perspective.Journal of Sleep Research,7(S1),17–23.
Cajochen,C.,Münch,M.,Knoblauch,V.,Blatter,K.,&Wirz-Justice,A.(2006).Age-related changes in the circadian and homeostatic regulation of human sleep.Chronobiology International,23,461–474.
Carstensen,L.L.,&Turk-Charles,S.(1994).The salience of emotion across the adult life span.Psychology and Aging,9,259–264.
Chan,A.S.,Sze,S.L.,Woo,J.,&Yu,R.H.(2014).A Chinese Chan-based lifestyle intervention improves memory of older adults.Frontiers in Aging Neuroscience,6,50.
Chan,M.Y.,Park,D.C.,Savalia,N.K.,Petersen,S.E.,&Wig,G.S.(2014).Decreased segregation of brain systems across the healthy adult lifespan.Proceedings of the National Academy of Sciences of the United States of America,111,E4997–E5006.
Chen,K.M.,Chen,M.H.,Chao,H.C.,Hung,H.M.,Lin,H.S.,&Li,C.H.(2009).Sleep quality,depression state,and health status of older adults after silver yoga exercises:Cluster randomized trial.International Journal of Nursing Studies,46,154–163.
Cherdieu,M.,Reynaud,E.,Uhlrich,J.,Versace,R.,&Mazza,S.(2014).Does age worsen sleep-dependent memory consolidation?.Journal of Sleep Research,23,53–60.
Chowdhury,M.H.,Nagai,A.,Bokura,H.,Nakamura,E.,Kobayashi,S.,&Yamaguchi,S.(2011).Age-related changes in white matter lesions,hippocampal atrophy,and cerebral microbleeds in healthy subjects without major cerebrovascular risk factors.Journal of Stroke and Cerebrovascular Diseases,20,302–309.
Clemens,Z.,Fabó,D.,&Halász,P.(2005).Overnight verbal memory retention correlates with the number of sleep spindles.Neuroscience,132,529–535.
Cousins,J.N.,El-Deredy,W.,Parkes,L.M.,Hennies,N.,&Lewis,P.A.(2014).Cued memory reactivation during slow-wave sleep promotes explicit knowledge of a motor sequence.The Journal of Neuroscience,34,15870–15876.
Crowley,K.,Trinder,J.,Kim,Y.,Carrington,M.,&Colrain,I.A.(2002).The effects of normal aging on sleep spindle and K-complex production.Clinical Neurophysiology,113,1615–1622.
Diederich,N.J.,Vaillant,M.,Mancuso,G.,Lyen,P.,&Tiete,J.(2005).Progressive sleep ‘destructuring’ in Parkinson's disease.A polysomnographic study in 46 patients.Sleep Medicine,6,313–318.
Diekelmann,S.,&Born,J.(2010).The memory function of sleep.Nature Reviews Neuroscience,11,114–126.
Dresler,M.,Kluge,M.,Genzel,L.,Schüessler,P.,&Steiger,A.(2007).Synergistic effects of age and depression on sleep-dependent memory consolidation.Pharmacopsychiatry,40,238–239.
Dresler,M.,Kluge,M.,Genzel,L.,Schüssler,P.,&Steiger,A.(2010).Impaired off-line memory consolidation in depression.European Neuropsychopharmacology,20,553–561.
Dykierek,P.,Stadtmüller,G.,Schramm,P.,Bahro,M.,van Calker,D.,Braus,D.F.,...Riemann,D.(1998).The value of REM sleep parameters in differentiating Alzheimer's disease from old-age depression and normal aging.Journal of Psychiatric Research,32,1–9.
Farajnia,S.,Deboer,T.,Rohling,J.H.T.,Meijer,J.H.,&Michel,S.(2014).Aging of the suprachiasmatic clock.The Neuroscientist,20,44–55.
Fibiger,H.C.(1991).Cholinergic mechanisms in learning,memory and dementia:A review of recent evidence.Trends in Neurosciences,14,220–223.
Floyd,J.A.,Janisse,J.J.,Jenuwine,E.S.,&Ager,J.W.(2007).Changes in REM-sleep percentage over the adult lifespan.Sleep,30,829–836.
Fogel,S.M.,Albouy,G.,Vien,C.,Popovicci,R.,King,B.R.,Hoge,R.,...Doyon,J.(2014).fMRI and sleep correlates of the age-related impairment in motor memory consolidation.Human Brain Mapping,35,3625–3645.
Fogel,S.M.,&Smith,C.T.(2006).Learning-dependent changes in sleep spindles and Stage 2 sleep.Journal of Sleep Research,15,250–255.
Gais,S.,&Born,J.(2004).Low acetylcholine during slow-wave sleep is critical for declarative memory consolidation.Proceedings of the National Academy of Sciences of the United States of America,101,2140–2144.
Gais,S.,Lucas,B.,&Born,J.(2006).Sleep after learning aids memory recall.Learning &Memory,13,259–262.
Gais,S.,Plihal,W.,Wagner,U.,&Born,J.(2000).Early sleep triggers memory for early visual discrimination skills.Nature Neuroscience,3,1335–1339.
Ganguly-Fitzgerald,I.,Donlea,J.,&Shaw,P.J.(2006).Waking experience affects sleep need in Drosophila.Science,313,1775–1781.
Gauthier,S.,Reisberg,B.,Zaudig,M.,Petersen,R.C.,Ritchie,K.,Broich,K.,...Winblad,B.(2006).Mild cognitive impairment.The Lancet,367,1262–1270.
Gerstner,J.R.,Perron,I.J.,&Pack,A.I.(2012).The nexus of Aβ,aging,and sleep.Science Translational Medicine,4(150),150fs34.
Girardeau,G.,&Zugaro,M.(2011).Hippocampal ripples and memory consolidation.Current Opinion in Beurobiology,21,452–459.
Giuditta,A.,Ambrosini,M.V.,Montagnese,P.,Mandile,P.,Cotugno,M.,Zucconi,G.G.,&Vescia,S.(1995).The sequential hypothesis of the function of sleep.Behavioural Brain Research,69,157–166.
Harand,C.,Bertran,F.,Doidy,F.,Guénolé,F.,Desgranges,B.,Eustache,F.,&Rauchs,G.(2012).How aging affects sleep-dependent memory consolidation?.Frontiers in Neurology,3,8.
Hardin,P.E.,Hall,J.C.,&Rosbash,M.(1990).Feedback of the Drosophila period gene product on circadian cycling of its messenger RNA levels.Nature,343,536–540.
Hoffstaedter,F.,Grefkes,C.,Roski,C.,Caspers,S.,Zilles,K.,&Eickhoff,S.B.(2015).Age-related decrease of functional connectivity additional to gray matter atrophy in a network for movement initiation.Brain Structure and Function,220,999–1012.
Hornung,O.P.,Danker-Hopfe,H.,&Heuser,I.(2005).Age-related changes in sleep and memory:Commonalities and interrelationships.Experimental Gerontology,40,279–285.
Hornung,O.P.,Regen,F.,Danker-Hopfe,H.,Schredl,M.,&Heuser,I.(2007).The relationship between REM sleep and memory consolidation in old age and effects of cholinergic medication.Biological Psychiatry,61,750–757.
Hornung,O.P.,Regen,F.,Schredl,M.,Heuser,I.,&Danker-Hopfe,H.(2006).Manipulating REM sleep in older adults by selective REM sleep deprivation and physiological as well as pharmacological REM sleep augmentation methods.Experimental Neurology,197,486–494.
Hot,P.,Rauchs,G.,Bertran,F.,Denise,P.,Desgranges,B.,Clochon,P.,&Eustache,F.(2011).Changes in sleep theta rhythm are related to episodic memory impairment in early Alzheimer's disease.Biological Psychology,87,334–339.
Iber,C.,Ancoli-Israel,S.,Chesson,A.L.,Quan,S.F.,Westchester,I.L.(2007).The AASM manual for the scoring of sleep and associated events:Rules,terminology and technical specifications.Westchester,I.L.:American Academy of Sleep Medicine.
Jahnke,K.,von Wegner,F.,Morzelewski,A.,Borisov,S.,Maischein,M.,Steinmetz,H.,&Laufs,H.(2012).To wake or not to wake? The two-sided nature of the human K-complex.Neuroimage,59,1631–1638.
Jiang,J.Y.,Sachdev,P.,Lipnicki,D.M.,Zhang,H.B.,Liu,T.,Zhu,W.L.,...Wen,W.(2014).A longitudinal study of brain atrophy over two years in community-dwelling older individuals.Neuroimage,86,203–211.
Karni,A.,Tanne,D.,Rubenstein,B.S.,Askenasy,J.J.,&Sagi,D.(1994).Dependence on REM sleep of overnight improvement of a perceptual skill.Science,265,679–682.
Lei,X.,Wang,Y.L.,Yuan,H.,&Chen,A.T.(2014).Brain scale-free properties in awake rest and NREM sleep:A simultaneous EEG/fMRI study.Brain Topography,28,292–304.
Lei,X.,Wang,Y.L.,Yuan,H.,&Mantini,D.(2014).Neuronal oscillations and functional interactions between resting state networks.Human Brain Mapping,35,3517–3528.
Mahlberg,R.,Kienast,T.,Hädel,S.,Heidenreich,J.O.,Schmitz,S.,&Kunz,D.(2009).Degree of pineal calcification(DOC) is associated with polysomnographic sleep measures in primary insomnia patients.Sleep Medicine,10,439–445.
Mander,B.A.,Rao,V.,Lu,B.,Saletin,J.M.,Lindquist,J.R.,Ancoli-Israel,S.,...Walker,M.P.(2013).Prefrontal atrophy,disrupted NREM slow waves and impaired hippocampal-dependent memory in aging.Nature Neuroscience,16,357–364.
Mazzoni,G.,Gori,S.,Formicola,G.,Gneri,C.,Massetani,R.,Murri,L.,&Salzarulo,P.(1999).Word recall correlates with sleep cycles in elderly subjects.Journal ofSleep Research,8,185–188.
Moraes,W.,Piovezan,R.,Poyares,D.,Bittencourt,L.R.,Santos-Silva,R.,&Tufik,S.(2014).Effects of aging on sleep structure throughout adulthood:A population-based study.Sleep Medicine,15,401–409.
Morin,A.,Doyon,J.,Dostie,V.,Barakat,M.,Tahar,A.H.,Korman,M.,...Carrier,J.(2008).Motor sequence learning increases sleep spindles and fast frequencies in post-training sleep.Sleep,31,1149–1156.
Naismith,S.L.,Rogers,N.L.,Lewis,S.J.,Terpening,Z.,Ip,T.,Diamond,K.,...Hickie,I.B.(2011).Sleep disturbance relates to neuropsychological functioning in late-life depression.Journal of Affective Disorders,132,139–145.
Nofzinger,E.A.(2005).Neuroimaging and sleep medicine.Sleep Medicine Reviews,9,157–172.
Nosheny,R.L.,Insel,P.S.,Truran,D.,Schuff,N.,Jack,C.R.,Aisen,P.S.,...Alzheimer's Disease Neuroimaging Initiative.(2014).Variables associated with hippocampal atrophy rate in normal aging and mild cognitive impairment.Neurobiology of Aging,36,273–282.
Pa,J.,Goodson,W.,Bloch,A.,King,A.C.,Yaffe,K.,&Barnes,D.E.(2014).Effect of exercise and cognitive activity on self-reported sleep quality in community-dwelling older adults with cognitive complaints:A randomized controlled trial.Journal of the American Geriatrics Society,62,2319–2326.
Pandi-Perumal,S.R.,Zisapel,N.,Srinivasan,V.,&Cardinali,D.P.(2005).Melatonin and sleep in aging population.Experimental Gerontology,40,911–925.
Phillips,B.,&Ancoli-Israel,S.(2001).Sleep disorders in the elderly.Sleep Medicine,2,99–114.
Plihal,W.,&Born,J.(1997).Effects of early and late nocturnal sleep on declarative and procedural memory.Journal of Cognitive Neuroscience,9,534–547.
Power,A.E.(2004).Slow-wave sleep,acetylcholine,and memory consolidation.Proceedings of the National Academy of Sciences of the United States of America,101,1795–1796.
Rahhal,T.A.,May,C.P.,&Hasher,L.(2002).Truth and character:Sources that older adults can remember.Psychological Science,13,101–105.
Rasch,B.,Büchel,C.,Gais,S.,&Born,J.(2007).Odor cues during slow-wave sleep prompt declarative memory consolidation.Science,315,1426–1429.
Rauchs,G.,Schabus,M.,Parapatics,S.,Bertran,F.,Clochon,P.,Hot,P.,...Anderer,P.(2008).Is there a link between sleep changes and memory in Alzheimer's disease?.Neuroreport,19,1159–1162.
Roh,J.H.,Huang,Y.F.,Bero,A.W.,Kasten,T.,Stewart,F.R.,Bateman,R.J.,&Holtzman,D.M.(2012).Sleep-wake cycle and diurnal fluctuation of amyloid-β as biomarkers of brain amyloid pathology.Science Translational Medicine,4(150),150ra122.
Rudoy,J.D.,Voss,J.L.,Westerberg,C.E.,&Paller,K.A.(2009).Strengthening individual memories by reactivating them during sleep.Science,326,1079.
Sehgal,A.,Price,J.L.,Man,B.,&Young,M.W.(1994).Loss of circadian behavioral rhythms and per RNA oscillations in the Drosophila mutant timeless.Science,263,1603–1606.
Spencer,R.M.C.,Gouw,A.M.,&Ivry,R.B.(2007).Age-related decline of sleep-dependent consolidation.Learning &Memory,14,480–484.
Stickgold,R.(2005).Sleep-dependent memory consolidation.Nature,437,1272–1278.
Sweegers,C.C.G.,Takashima,A.,Fernández,G.,&Talamini,L.M.(2014).Neural mechanisms supporting the extraction of general knowledge across episodic memories.Neuroimage,87,138–146.
Tamminen,J.,Payne,J.D.,Stickgold,R.,Wamsley,E.J.,&Gaskell,M.G.(2010).Sleep spindle activity is associated with the integration of new memories and existing knowledge.Journal of Neuroscience,30,14356–14360.
Terpening,Z.,Naismith,S.,Melehan,K.,Gittins,C.,Bolitho,S.,&Lewis,S.J.G.(2013).The contribution of nocturnal sleep to the consolidation of motor skill learning in healthy ageing and Parkinson's disease.Journal of Sleep Research,22,398–405.
van Cauter,E.,Leproult,R.,&Plat,L.(2000).Age-related changes in slow wave sleep and REM sleep and relationship with growth hormone and cortisol levels in healthy men.JAMA-Journal of the American Medical Association,284,861–868.
Walker,M.P.,&Stickgold,R.(2004).Sleep-dependent learning and memory consolidation.Neuron,44,121–133.
Walker,M.P.(2008).Sleep-dependent memory processing.Harvard Review of Psychiatry,16,287–298.
Westerberg,C.E.,Mander,B.A.,Florczak,S.M.,Weintraub,S.,Mesulam,M.,Zee,P.C.,&Paller,K.A.(2012).Concurrent impairments in sleep and memory in amnestic mild cognitive impairment.Journal of the International Neuropsychological Society,18,490–500.
Wilson,J.K.,Baran,B.,Pace-Schott,E.F.,Ivry,R.B.,&Spencer,R.M.C.(2012).Sleep modulates word-pair learning but not motor sequence learning in healthy older adults.Neurobiology of Aging,33,991–1000.
Wu,D.,Tseng,I.J.,Yuan,R.Y.,Hsieh,C.Y.,&Hu,C.J.(2014).Memory consolidation and inducible nitric oxide synthase expression during different sleep stages in Parkinson disease.Sleep Medicine,15,116–120.
Wu,Y.H.,Fischer,D.F.,Kalsbeek,A.,Garidou-Boof,M.-L.,van der Vliet,J.,van Heijningen,C.,...Swaab,D.F.(2006).Pineal clock gene oscillation is disturbed in Alzheimer’s disease,due to functional disconnection from the “master clock”.The FASEB Journal,20,1874–1876.
Wu,Y.H.,&Swaab,D.F.(2007).Disturbance and strategies for reactivation of the circadian rhythm system in aging and Alzheimer’s disease.Sleep Medicine,8,623–636.
Yaffe,K.,Falvey,C.M.,&Hoang,T.(2014).Connections between sleep and cognition in older adults.The Lancet Neurology,13,1017–1028.
