3-乙基-3-烯丙基甲氧基氧杂环丁烷的合成及作为阳离子型UV固化稀释剂性能研究
2015-02-01谢王付黄笔武万时策雍涛韩文娟
谢王付,黄笔武,万时策,雍涛,韩文娟
3-乙基-3-烯丙基甲氧基氧杂环丁烷的合成及作为阳离子型UV固化稀释剂性能研究
谢王付,黄笔武*,万时策,雍涛,韩文娟
摘要:以3-乙基-3-羟甲基氧杂环丁烷和烯丙基溴为原料,以四丁基溴化铵为相转移催化剂,在氢氧化钾碱溶液作用下合成活性单体3-乙基-3-烯丙基甲氧基氧杂环丁烷,考察了原料配比、催化剂使用量、反应温度和反应时间对产物收率的影响,较佳反应条件为:n(3-乙基-3-羟甲基氧杂环丁烷)∶n(烯丙基溴)=1∶1.4,m(3-乙基-3-羟甲基氧杂环丁烷)∶m(四丁基溴化铵)=23.2∶1,反应温度为0 ℃,反应时间为24 h。同时把3-乙基-3-烯丙基甲氧基氧杂环丁烷作为稀释剂加入到环氧树脂E-51中,利用三芳基锍鎓六氟锑酸盐作为光引发剂,制备了阳离子型紫外光固化涂料,当活性单体投入量为20%时,其紫外光固化膜的拉伸强度为35.18 MPa,断裂伸长率为4.78%,冲击强度为30 kg·cm。
关键词:紫外光固化氧杂环丁烷烯丙基溴活性单体
紫外光(UV)固化技术具有固化速度快、固化产物性能优异、节能、污染少等特点[1-2],主要应用在涂料、油墨、电子产品、快速成型等领域[3-5]。UV固化技术主要有自由基[6-8]和阳离子型两种固化机理[9-11],自由基型光固化具有速度快、固化膜性能易于调节、单体种类较多等优点[12-13],但也有固化膜体积收缩率大、附着力差、反应易受氧气阻聚等缺点[14];阳离子型光固化具有具有体积收率低、附着力强、耐磨和硬度高等优点,特别适用于精度要求较高的立刻光刻快速成型技术。然而可用于阳离子UV固化材料体系的活性单体种类目前还不多,且通常脂环族环氧活性单体合成工艺复杂,价格较昂贵,芳香族环氧活性单体中,由于苯环的存在,对环氧基产生吸电子效应,影响环氧基光敏性,不利于开环聚合,限制了其实际的应用。笔者以3-乙基-3-羟甲基氧杂环丁烷(EHO)和烯丙基溴为原料,以四丁基溴化铵为相转移催化剂,在氢氧化钾碱溶液作用下合成活性单体3-乙基-3-烯丙基甲氧基氧杂环丁烷,将其作为一种活性稀释剂加入到含有双酚A型环氧树脂和阳离子型光引发剂的体系中,制备了一种阳离子型UV固化涂料。
1实验
1.1 原料及仪器
烯丙基溴、氢氧化钾、四丁基溴化铵、二氯甲烷、无水硫酸镁,阳离子光引发剂(UV-6976,即三芳基锍鎓六氟锑酸盐),均为分析纯;双酚A型环氧树脂(E-51)为工业品。
FT-IR EQUINOX55型红外光谱仪、AVANCE Ⅲ 600 MHz型核磁共振波谱仪,均由瑞士布鲁克(Bruker)公司制造;电子拉力试验机,深圳市瑞格尔仪器有限公司;工字型漆膜涂布器,QCJ型冲击强度试验机,QHD型摆杆阻尼试验仪,QTX-1型弹性漆膜测定器,均由天津永利达材料试验机有限公司制造,INTELLI-RAY400智能控制紫外光固化机系统,深圳市慧硕机电有限公司。
1.2 3-乙基-3-烯丙基甲氧基的合成
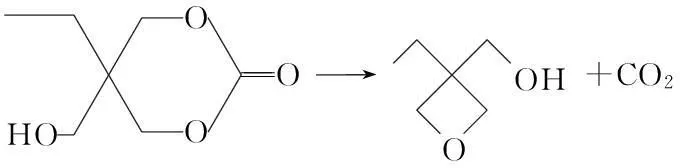
先以碳酸二乙酯和三羟基丙烷在碱环境下发生酯交换反应,生成六元环内酯结构的中间体,然后再在高温下裂解脱去CO2即制得前驱体3-乙基-3-羟甲基氧杂环丁烷,减压蒸馏收集130~135 ℃/21.3 kPa的馏分。将前驱体与氢氧化钾水溶液加入到带有磁力搅拌子,温度计、滴液漏斗和回流装置的三口烧瓶中,在强烈搅拌下加入四丁基溴化铵,控制滴液漏斗的液滴速度,缓慢加入烯丙基溴,在0 ℃下维持24 h,使反应进行完全;然后取一定量二氯甲烷和蒸馏水加入到反应产物中,利用分液漏斗分相,有机相再用蒸馏水洗涤两次,然后通过无水硫酸镁干燥过滤,用旋转蒸发器减压蒸馏除去多余的烯丙基溴及萃取剂二氯甲烷,最后残留分再进行减压蒸馏,收集55~60 ℃/0.4 kPa的馏分,产物即为3-乙基-3-烯丙基甲氧基氧杂环丁烷(AllylEHO)。
*通信联系人,E-mail:hbwjxnc@sina.com。
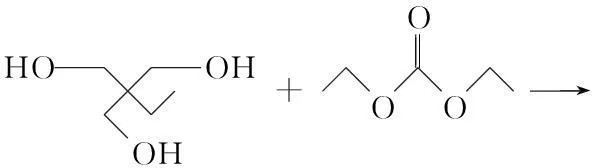


2结果与讨论
2.1 合成工艺参数的确定
2.1.1原料配比
本实验中3-乙基-3-羟甲基氧杂环丁烷的投料固定为23.2 g(0.2 mol),烯丙基溴的投料摩尔数按照相应比例变化。表1为烯丙基溴的用量对收率的影响。
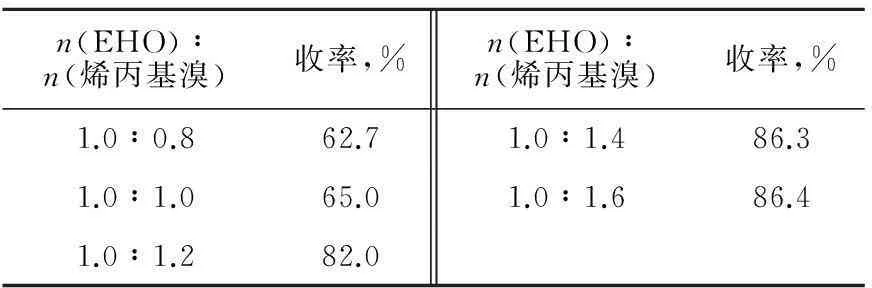
表1 烯丙基溴的用量对产物收率的影响
注:50 g 50%氢氧化钾水溶液,1.0 g相转移催化剂四丁基溴化铵,温度为0 ℃,反应时间为24 h。
如表1所示:随着烯丙基溴的增加,产物收率逐步升高,当3-乙基-3-羟甲基氧杂环丁烷与烯丙基溴的起始摩尔比为1.0∶1.4时为最佳。烯丙基溴用量较少时,收率较低;这可能是由于烯丙基溴很活泼,较容易挥发,同时在强碱的作用下很容易水解并发生脱水,从而发生副反应。
2.1.2催化剂及其用量
3-乙基-3-羟甲基氧杂环丁烷和烯丙基溴发生威尔姆逊醚化反应与双酚A和烯丙基溴的醚化反应不同。因双酚A上的苯环可以与氧原子形成具有吸电子作用的大π键,从而使酚羟基显弱酸性,两者之间的反应相对较容易进行;而3-乙基-3-羟甲基氧杂环丁烷上的羟基不易失去氢原子,两者之间的反应相对较难。故通常用NaOH、KOH浓溶液或NaH固体等强碱性物质处理脂肪醇,使其成为溶于水的醇钠(钾)盐,再将烯丙基溴滴加到醇钠(钾)盐水溶液中。由于有机物难溶于水,故反应通常需要很长时间,反应不完全且通常收率不高,故通常会采用相转移催化法。上述反应中,在相转移催化剂存在下,于一定温度下,通过相转移催化剂的作用,通常可以显著缩短反应时间,提高收率。
在冰水浴环境下,控制3-乙基-3-羟甲基氧杂环丁烷与烯丙基溴的投料摩尔比为1∶1.4,向50 g 50%的氢氧化钾水溶液中加入3-乙基-3-羟甲基氧杂环丁烷0.2 mol,反应时间为24 h,分别考察了苄基三乙基氯化铵和四丁基溴化铵的不同用量对产物收率的影响,结果如图1所示。由图1可知:该反应选用四丁基溴化铵作为相转移催化剂优于苄基三乙基氯化铵,反应产物收率明显较高,较佳投料比为四丁基溴化铵/3-乙基-3-羟甲基氧杂环丁烷(摩尔比)0.015。
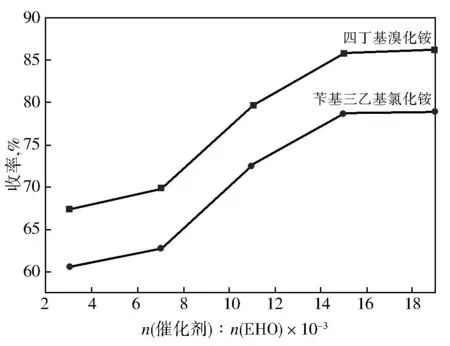
图1 四丁基溴化铵及苄基三乙基氯化铵的用量对收率的影响
2.1.3反应温度
固定3-乙基-3-羟甲基氧杂环丁烷用量23.2 g,50 g50%氢氧化钾水溶液,烯丙基溴与3-乙基-3-羟甲基氧杂环丁烷的摩尔比为1.4∶1,1 g四丁基溴化铵,反应时间24 h,考察反应温度对收率的影响,结果见图2。

图2 反应温度对产物收率的影响
由图2可知:随着温度的升高,产物收率呈现下降趋势。在初始阶段,收率的下降相对平缓,但当温度超过5 ℃时,收率有较明显的下降,主要原因可能是烯丙基溴是一种很活泼的物质,较容易挥发,同时在强碱作用下很容易水解并发生脱水醚化反应,与主反应属于竞争关系,故而影响产物收率。综合考虑,实验较佳反应温度为0 ℃。
2.1.4反应时间
3-乙基-3-羟甲基氧杂环丁烷与烯丙基溴的投料分别为23.20 g和33.88 g,加入1 g相转移催化剂四丁基溴化铵和50 g 50%氢氧化钾水溶液,反应在0 ℃下进行,考察反应时间对产物收率的影响,结果见图3。由图3可知:较佳反应时间为24 h。
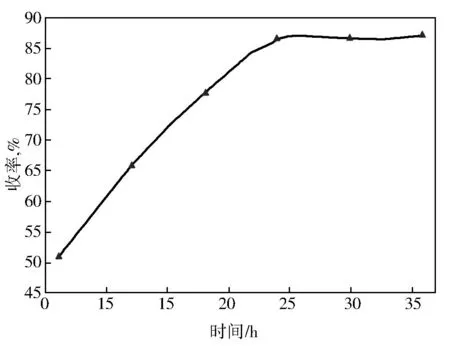
图3 反应时间对收率的影响
2.2 反应产物结构表征分析
2.2.1FT-IR
图4为EHO与产物3-乙基-3-烯丙基甲氧基氧杂环丁烷(AllylEHO)的红外光谱。由图4可知:EHO曲线中,3 418 cm-1为处O—H的吸收峰;2 964,2 866,1 478 cm-1处为甲基中C—H吸收峰;2 934 cm-1处为亚甲基中C—H吸收峰;827 cm-1处是氧杂环丁烷四元环的对称变形振动吸收峰;982 cm-1为氧杂环丁烷四元环的反对称变形振动吸收峰。在产物AllylEHO曲线中,可以明显观察到3 418 cm-1处羟基的吸收峰消失,而在3 080、1 645、926 cm-1处出现烯丙基的特征吸收峰。说明产物就是3-乙基-3烯丙基甲氧基氧杂环丁烷。
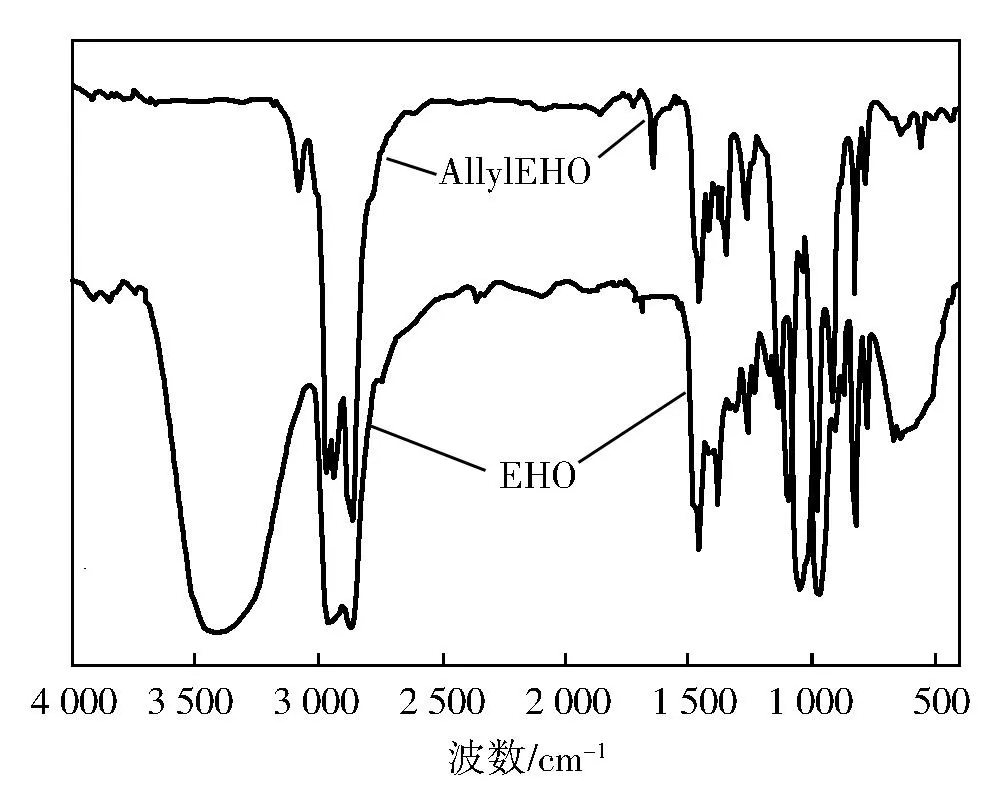
图4 EHO与3-乙基-3羟甲基氧杂环丁烷的红外光谱
2.2.21H NMR
图5为采用CDCl3作为氘代溶剂时测得的3-乙基-3-烯丙基甲氧基氧杂环丁烷核磁共振氢谱。由图5可知,产物的核磁共振氢谱有8个吸收峰,具体分析为(δ):0.790~0.836 (q, 3H, CH3),1.600~1.762 (m,2H, CH2),3.502~3.542(s, 2H, CH2),3.946~4.088(t, 2H, CH2),4.292~4.314(t,2H,CH2),4.359~4.382 (t, 2H,CH2),5.142~5.308(m,2H,CH2),5.812~5.952(m,H,CH)
8个吸收峰的峰面积比为3∶2∶2∶2∶2∶2∶1∶2。符合3-乙基-3-烯丙基甲氧基氧杂环丁烷分子结构式上氢原子的种类数目及个数比。间接验证了实验所得的最终产物基本为3-乙基-3-烯丙基甲氧基氧杂环丁烷。
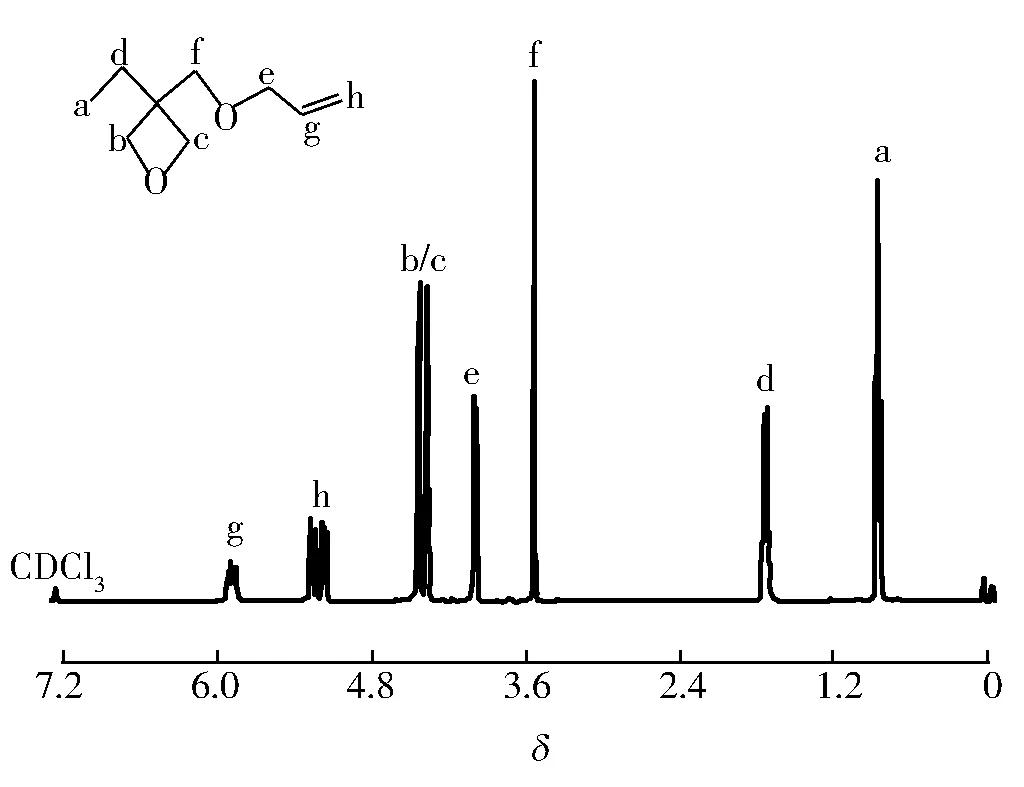
图5 3-乙基-3-烯丙基氧杂环丁烷的核磁共振氢谱
2.3 AllylEHO改性紫外光固化材料体系探讨
2.3.1稀释效应
双酚A型环氧树脂E-51在室温(25 ℃)黏度达到9 937 mPa·s,其黏度较大,流动性较差,使用困难,通常需加入稀释剂调节其黏度,图6表示25 ℃时在一系列100 g双酚A型环氧树脂E-51中加入不同量的AllylEHO对其体系黏度影响的曲线。
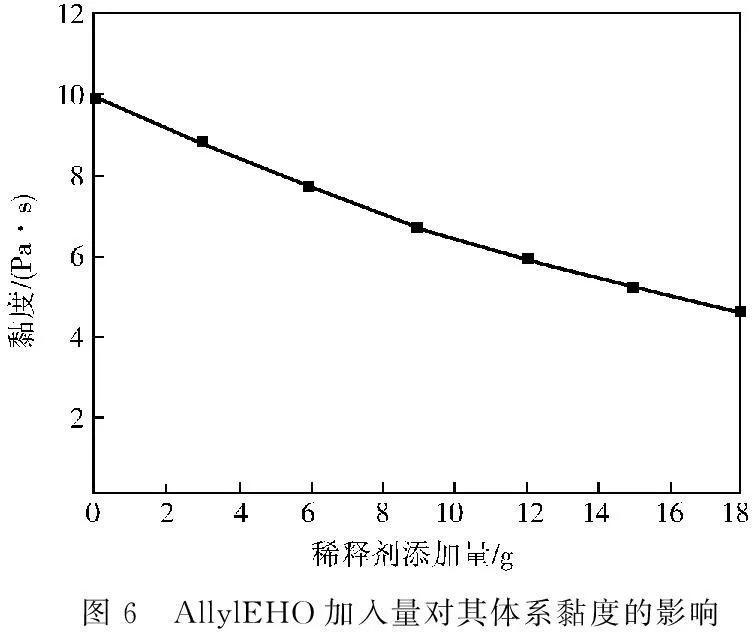
图6 AllylEHO加入量对其体系黏度的影响
从图6可知:随着稀释剂AllylEHO的加入,其体系黏度逐渐下降,从而使其紫外光固化材料涂布施工变得较为方便。当加入AllylEHO达到12 g时,其光敏材料体系的黏度已将为5 953 mPa·s,即6 000 mPa·s以下,已达到了可进行涂布施工的较佳黏度值范围内,这说明3-乙基-3-烯丙基甲氧基氧杂环丁烷是一种优良的阳离子型紫外光固化材料稀释剂。
2.3.2光敏性
在100 g双酚A型环氧树脂E-51中,加入12 g AllylEHO和5 g UV-6976,配制成阳离子型紫外光固化光敏树脂,然后取一系列样品放于紫外光固化机中,曝光不同的时间后,利用凝胶率法[15]对其光敏性进行了探讨。从图7可知:这种阳离子型紫外光固化光敏树脂在曝光1~6 min内,随着曝光时间的加长,凝胶率显著增加,在4 min时,凝胶率已达到97%以上,这说明这种光敏树脂只需4 min就能基本固化完全,这也说明用3-乙基-3-烯丙基甲氧基氧杂环丁烷作为稀释剂配制的光敏树脂的光敏性较好。
2.3.3活性稀释剂的含量对紫外光固化材料的影响
将新合成的活性稀释剂AllylEHO与E-51按照不同质量比为混合均匀,另外一组为纯E-51,再分别加入等量的阳离子光引发剂UV-6976,引发剂的量为整个固化体系的5%,然后将各固化体系放入超声波振荡仪超声振荡约3 min。根据各类试样制作要求,利用工字型漆膜涂布机制样,涂层厚度为0.400 mm。把制好的试样放入紫外光固化机系统中,调节光强为90%,辐射时间为4 min,考察不同活性稀释剂含量的紫外光固化材料的性能变化,结果见表2。
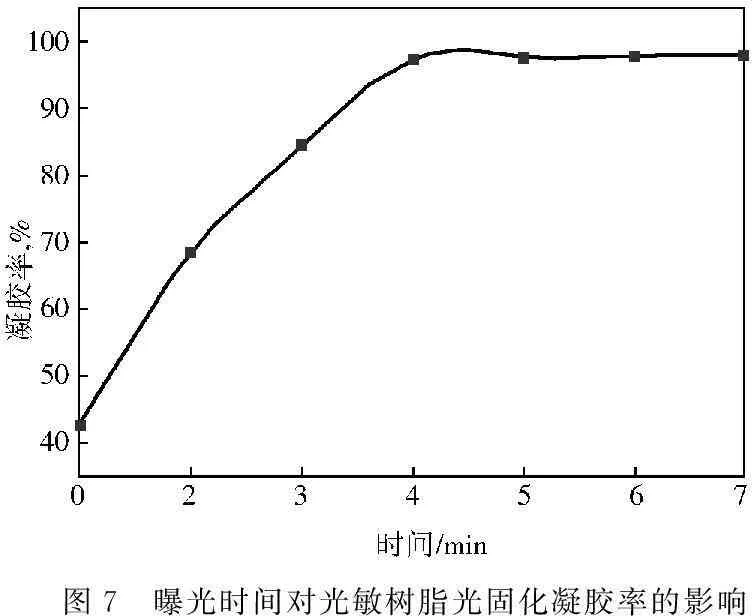
图7 曝光时间对光敏树脂光固化凝胶率的影响
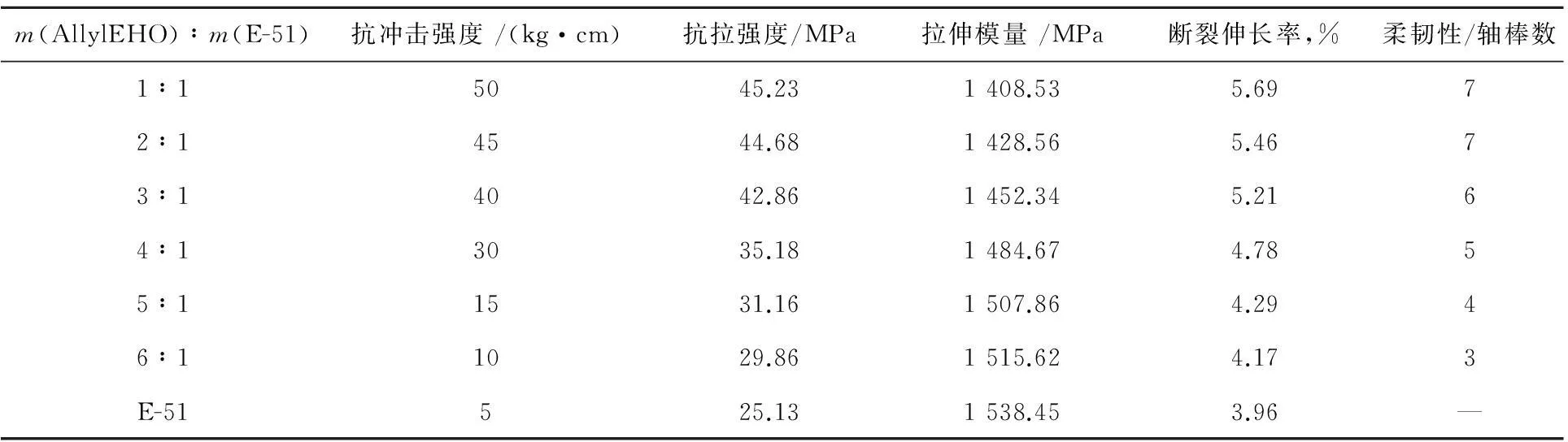
表2 不同E-51与活性稀释剂投料比对固化材料冲击性能、柔韧性的影响
由表2可知:随着固化体系中3-乙基-3-烯丙基甲氧基氧杂环丁烷含量的增加,固化材料的抗冲击强度、柔韧性、拉伸强度以及断裂伸长率显著提升,当体系中无活性稀释剂的加入时,纯E-51配制而成的光敏树脂固化后,固化材料的冲击强度仅为5 kg·cm,拉伸强度仅为25.13 MPa,断裂伸长率仅为3.96%,且固化材料较脆,柔韧性较差,而当AllylEHO与E-51的投料比为1∶1时,固化物冲击强度提升至50 kg·cm,拉伸强度可达45.23 MPa,断裂伸长率可达5.69%,固化膜可通过轴棒7的弯曲测试。这主要是由于3-乙基-3-烯丙基甲氧基氧杂环丁烷分子量较低,且链段旋转度高,分子结构中引入较多柔性基团醚键,固化材料中显刚性的苯环占比降低,使得固化材料柔软抗冲击,受拉时可进行分子链重排,故呈现出较优的综合性能。
2.3.4固化物的红外光谱分析
图8为固化前后的红外光谱。由图8可见:3 486 cm-1为—OH的伸缩振动峰,3 057 cm-1和1 648 cm-1为烯丙基的特征吸收峰,2 966、2 929、2 872 cm-1为CH3与—CH2中C—H伸缩振动峰,1 607、1 509、1 458、1 406 cm-1为苯环4条特征谱带,1 247 cm-1为芳香醚的伸缩振动特征峰,976 cm-1为氧杂环丁烷的环醚吸收峰,829 cm-1为对位取代苯环的吸收峰。对比固化前后红外吸收光谱,976 cm-1处环醚吸收峰消失,是由于氧杂环丁烷中的环醚开环聚合,同时说明固化较完全,而1 648 cm-1处吸收峰减弱,是由于阳离子光引发剂光解反应中会同时产生阳离子与自由基,部分碳碳双键断开参加聚合的结果。
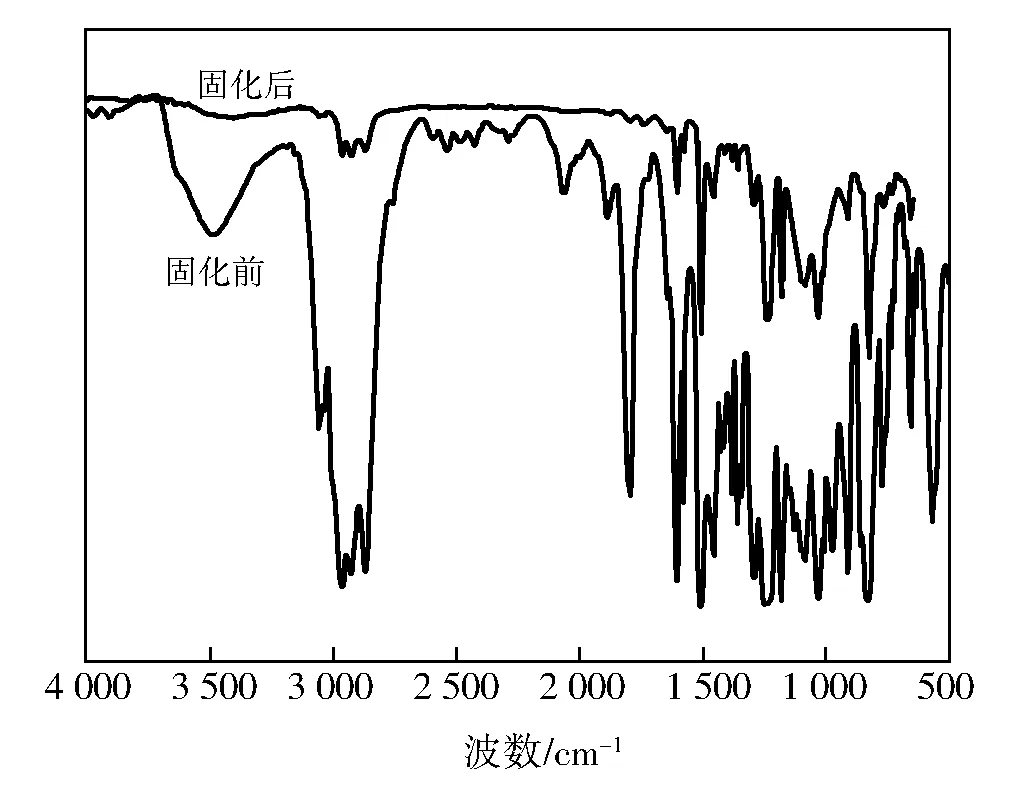
图8 固化前后的红外光谱
3结论
a.以3-乙基-3-羟甲基氧杂环丁烷和烯丙基溴为原料,以四丁基溴化铵为相转移催化剂,在氢氧化钾碱溶液作用下合成活性单体3-乙基-3-烯丙基甲氧基氧杂环丁烷,得到了较佳的合成工艺参数为:n(3-乙基-3-羟甲基氧杂环丁烷)∶n(烯丙基溴)=1∶1.4,m(3-乙基-3-羟甲基氧杂环丁烷)∶m(四丁基溴化铵)=23.2∶1,反应温度为0 ℃,反应时间为24 h。
b.把体3-乙基-3-烯丙基甲氧基氧杂环丁烷作为活性稀释剂加入到环氧树脂E-51中,然后加入阳离子光引发剂UV-6976,制备阳离子型光敏树脂。3-乙基-3-烯丙基甲氧基氧杂环丁烷是一种良好的阳离子型UV固化稀释剂,在阳离子型UV固化领域将具有一定的推广应用价值。
参考文献
[1]Decker C. Kinetic study and new applications of UV radiation curing[J].Macmmol Rapid Commun, 2002(23):1067-1093.
[2]王坚, 苟小青, 沈学峰. 水性UV涂料在塑料上的应用[J]. 涂料工业, 2009, 39(11): 49-52.
[3]Pham D T, Gault R S. A comparison of rapid prototyping technologies[J]. International Journal of Machine Tools & Manufacture, 1998, 38(10): 1257-1276.
[4]Vassilis C, John G, Vassilis D. Efficient parts nesting schemes for improving stereolithography utilization[J]. Computer-Aided Design, 2013, 45(5): 875-886.
[5]Pati F, Shim J H, Lee J S, et al. 3D printing of cell-laden constructs for heterogeneous tissue regeneration[J]. Manufacturing Letters, 2013, 1(1) : 49-53.
[6]Young J P, Dong H L, Hyun J K, et al. UV-and thermal-curing behaviors of dual-curable adhesives based on epoxy acrylate oligomers[J]. International Journal of Adhesion and Adhesives, 2009, 29: 710-717.
[7]康小孟, 黄莉, 谢晖, 等. UV固化松节油聚氨酯丙烯酸酯的合成及涂膜性能研究[J]. 涂料工业, 2009, 39(2):12-14.
[8]黄笔武,万时策,谢王付. 一种新型紫外光固化光敏预聚物的合成及性能测试[J].精细石油化工, 2015,32(1):18-22.
[9]Crivello J V, Ortiz R A. Design and synthesis of highly reactive photopolymerizable epoxy monomers[J].Journal of Polymer Science Part A-polymer Chemistry, 2001, 39(14): 2385-2395.
[10]Sangermanno M, Malucell G, Morel F, et al. Cationic photopolymerization of vinyl ether systems[J]. European Polymer Journal, 1999, 35(4): 639-645.
[11]Decher C, Bianchi C, Decher D, et al. photoinitiated polymerization of vinyl ether-based systems[J]. Progress in Organic Coatings, 2001, 42(3): 253-266.
[12]Sangermano M, Malucell G, Priola A, et al. Synthesis and characterization of acrylate-oxetane interpenetrating polymer networks through a thermal-UV dual cure process[J]. Progress in Organic Coatings, 2006, 55(3): 225-230.
[13]Sangermano M, Malucell G, Bongiovanni R, et al. Photopolymerization of oxetane based systems[J]. European Polymer Journal, 2004, 40(2): 353-358.
[14]杨娟, 成佳辉, 任冬燕. UV固化涂料研究进展[J]. 广州化工, 2011,24(39):7-8,16.
[15]邱进俊, 刘承美, 包瑞, 等. 可注射性骨修复材料不饱和聚磷酸酯的光引发交联聚合[J]. 感光科学与光化学, 2006, 24(1):28-35.

SYNTHESIS OF 3-ETHYL-3-ALLYLOXYMETHYL OXETANE AND
STUDY ON ITS PROPERTIES AS CATIONIC TYPE UV-CURING DILUENT
Xie Wangfu, Huang Biwu, Wan Shice, Yong Tao, Han Wenjuan
(SchoolofMaterialScienceandEngineering,NanchangUniversity,Nanchang330031,Jiangxi,China)
Abstract:A new reactive monomer called 3-ethyl-3-allyloxymethyl oxetane was synthesized with 3-ethyl-3-hydroxymethyl oxetane and allyl bromide as raw materials, tetrabutyl ammonium bromide as phase transfer catalyst, under the aqueous solution of potassium hydroxide. The effects of feed ratio of the raw materials, amount of catalyst, reaction temperature and reaction time on the yield were researched. The optimal reaction conditions were obtained as that n(3-ethyl-3-hydroxymethyl oxetane)∶n(allyl bromide)=1∶1.4, m(3-ethyl-3-hydroxymethyl oxetane)∶m(tetrabutyl ammonium bromide)=23.2∶1, the reaction temperature was 0 ℃ and the reaction time was 24 h. Meanwhile, the cationic type UV-curing coating was prepared with 3-ethyl-3-allyloxymethyl oxetane, epoxy resin(E-51) and triphenylsulphonium hexafluoroantimonate(UV-6976). The tensile strength was 35.18 MPa, elongation at break was 4.78% and the impact strength was 30 kg·cm when the amount of activated monomer was 20%.
Key words:UV-curing; oxetane; allyl bromide; activated monomer
基金项目:江西省自然科学基金项目(20142BAB206029)。
作者简介:谢王付(1989-),硕士研究生,主要从事紫外光固化材料研究。E-mail:742993759@qq.com。
收稿日期:2015-05-20;修改稿收到日期:2015-10-28。
中图分类号:TQ630.4+93
文献标识码:A
