病灶部位的影像学特征对进展性脑梗死的预测作用☆
2015-02-01张迎生汪凯
张迎生汪凯
·论 著·
病灶部位的影像学特征对进展性脑梗死的预测作用☆
张迎生*△汪凯*
目的探讨不同病灶部位的影像学特征对进展性脑梗死的预测作用。方法收集2010年1月至2014年6月在合肥市第三人民医院神经内科住院的脑梗死患者,所有患者经头颅磁共振明确病灶部位,影像学分型分为:前循环皮质、基底节、放射冠和后循环梗死;再根据病情有无进展分为非进展性和进展性脑梗死。比较各影像学亚型脑梗死在非进展性和进展性脑梗死组间的分布差异,并分析梗死亚型与是否进展的相关性分析,然后进一步回归分析进展性脑梗死的危险因素。结果共150例患者入选,其中非进展性脑梗死99例,进展性脑梗死51例;其影像学分型中,发生在皮质为46例,放射冠25例,基底节47例,后循环32例。不同影像学亚型脑梗死在非进展性和进展性脑梗死组间分布存在显著差异(χ2=19.239,P=0.001),其中,进展性脑梗死发生在前循环皮质的几率显著高于非进展性脑梗死;前循环皮质梗死与是否进展性间的相关性分析,其R和P值分别为0.170、和0.026;进展性脑梗死危险因素的Logistic回归分析显示,梗死的影像学亚型与其有关(P=0.002),表现为前循环皮质梗死发生梗死进展的可能性较其它亚型显著增加,即使经年龄、血糖等相关因素校正后,此种趋势依然存在(P=0.014)。结论梗死部位与其是否进展密切相关,发生在前循环皮质的患者更容易出现病情进展。
进展性脑梗死影像学预测
进展性脑梗死是指发病后局限性脑缺血神经功能缺失症状逐渐进展,呈阶梯式加重,可持续6 h至数天[1]。临床死亡率和致残率较高。既往对进展性脑梗死危险因素报道较多,但大多数研究未进行分型研究。本文根据入院早期病灶部位特点进行影像学分型,旨在探讨不同影像学亚型梗死是否对脑梗死进展具有一定的预测作用。
1 资料与方法
1.1 研究对象收集2010年1月至2014年6月在我科住院的缺血性卒中患者,均符合缺血性脑血管病诊断标准,并经头颅磁共振证实有新发脑梗死。入院时均行头颅CT检查,早期CT提示大面积脑梗死患者除外;既往曾有过卒中病史且留有后遗症者、卒中进展前无头颅磁共振结果者除外;入院期间发热患者排除在外;进行降血压治疗的患者除外;无完整的病史及生化检验结果者亦除外。
1.2 方法
1.2.1 诊断标准 发病后6 h~7 d,治疗后仍出现进行性神经功能恶化,脑卒中量表(NIHSS)评分比基线水平增加大于或等于2分时,判断为进展性脑梗死[2]。
1.2.2 影像学分型根据责任病灶所在位置分型[3]:①前循环皮质梗死:指病灶位于大脑中或大脑前动脉皮层支分布区,可以表现为大脑中动脉主干闭塞;大脑中动脉皮质支闭塞;大脑中动脉前、后交界区(分水岭)梗死或大脑前动脉分布区梗死。②基底节区梗死:即前循环穿动脉分布区梗死。③放射冠梗死:大脑中动脉皮质支和穿动脉分布区的交界区,即为内交界区,主要位于放射冠区。④后循环梗死:椎基底动脉分布区,包括脑干、丘脑、枕叶皮质等。
1.2.3 生化指标测定 患者禁食12 h后取空腹静脉血标本,用全自动生化仪进行直接胆红素、总胆红素、尿酸、血糖、同型半胱氨酸、血脂〔包括总胆固醇(TC),甘油三酯(TG),高密度脂蛋白胆固醇(HDL-C),低密度脂蛋白胆固醇(LDL-C)测定。
1.2.4 头颅磁共振 采用美国GE公司1.5Tesla超导型扫描机,所有患者均在入院1周内行颅脑MR检查。采用常规横断位T1、T2加权像及T2压水及弥散加权功能成像。横断位采用层厚6 mm,层间隔1 mm,从顶至颅底扫描18层;弥散加权序列采用最短回波时间,TR(重复时间)4475 ms;采集数据2次,两B值分别为1000 s/mm2及0 s/mm2。所有弥散加权图像均在GEADW4.4工作站处理做出表观弥散系数图并测量ADC值。判定标准:弥散加权成像呈高信号,表观弥散系数图呈低信号为急性脑梗死。所有图像均由2位经验丰富的神经影像科医生共同评价。
1.3 统计学方法 所有数据录入SPSS13.0软件包分析,计数资料采用卡方检验,相关性采用Pear⁃son相关性分析,危险相关度采用Logistic回归分析,检验水准α=0.05。
2 结果
2.1 一般资料共150例患者入选,男96例,女54例,年龄(66.10±12.95)岁;非进展性脑梗死99例,进展性脑梗死51例,两者基线资料如性别,年龄,有无合并高血压、糖尿病、吸烟、饮酒等的构成比差异无统计学意义;其影像学分型中,发生在皮质为46例,放射冠25例,基底节47例,后循环32例,具体见表1。
2.2 不同影像学亚型在两组间的分布非进展性脑梗组的前循环皮质、放射冠、基底节和后循环梗死分别占20%(20/99)、19%(19/99)、38%(38/99)和22%(22/99),进展性脑梗死组则为51%(26/ 51)、12%(6/51)、18%(9/51)和19%(10/51),两组构成比存在统计学差异(χ2=19.239,P=0.001),其中,进展性脑梗死发生在前循环皮质的几率显著高于非进展性脑梗死(图1)。
2.3 梗死影像学亚型与是否进展的相关性分析不同部位的脑梗死亚组与进展性脑梗死间的相关性分析显示,前循环皮质、放射冠和后循环均与进展性脑梗死具有一定的相关性,R值和P值分别为0.170、-0.178、-0.182和0.038、0.029、0.026,因前循环皮质为唯一正值,说明进展性脑梗死更易于发生在前循环皮质(表2)。
2.4 影像学亚型与进展性脑梗死间的危险相关度单因素的Logistic回归分析显示,年龄和入院时的血糖均与脑梗死是否进展存在相关性,其OR(95%CI)分别为1.04(1.01~1.07)和1.183(1.02~1.37)(表3);影像学亚型亦与进展性脑梗死相关,此处进一步经Logistic回归分析验证(P=0.002),鉴于前循环皮质与其相关性较大,以皮质作为参照,发现其他部位梗死发生进展性脑梗死的几率显著降低,即使经年龄、血糖等因素校正,此种趋势依然维持存在(表4)。
3 讨论
进展性脑梗死的神经功能损害症状呈进行性加重,虽经临床积极治疗仍不能阻止其进展,属于难治性脑血管病。导致脑梗死症状进展的因素众多,如年龄、血压、体温、血糖、血脂、梗死部位、入院时卒中严重程度等,均可能为进展性脑梗死的危险因素。本研究对其相关危险因素作出进一步探讨。其中血压下降、入院时体温及头颅CT提示大面积梗死可以导致病情进展的危险因素在病例入选时已除外,结果证实年龄、血糖均为进展性脑梗死的危险因素。先前也有研究表明梗死部位与病情进展具有相关性,但未进一步根据影像学分型进行研究,本研究根据责任病灶的位置进行影像学分型,分为前循环皮质梗死、基底节区梗死、放射冠梗死、后循环梗死不同亚型。研究结果显示前循环皮质梗死病情更容易进展。
进展性脑梗死与年龄有明显相关性,可能与老年患者脑动脉硬化范围广,脑循环储备能力下降有关[4];年龄老化会造成脑组织萎缩,脑动脉硬化和脑血流减慢等,使脑组织在缺血环境中更容易发生缺血性卒中,并使得症状加重[5]。

表1 脑梗死患者的影像学分型情况
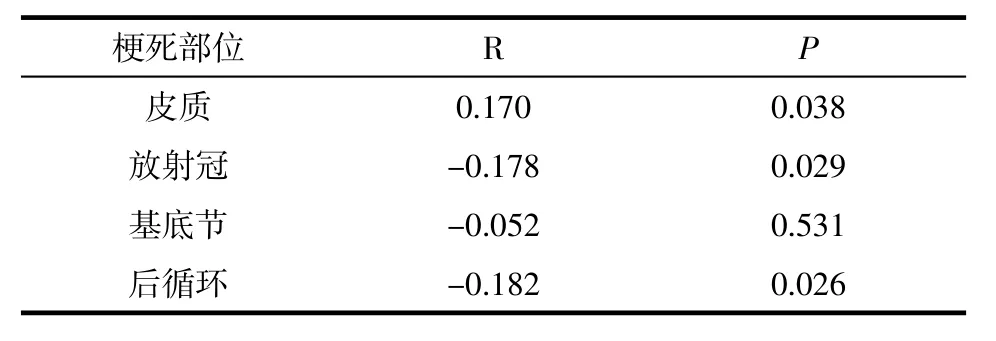
表2 进展性脑梗死与影像学分型间的相关性
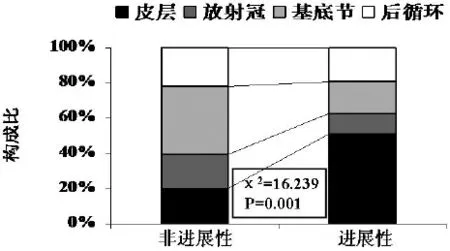
图1 影像学梗死亚型的差异分布比较
关于血糖系进展性脑梗死的危险因素的观点已被广泛的接受。早期血糖增高可引起缺血脑组织无氧酵解增加,乳酸蓄积,导致细胞内酸中毒,能量代谢受损从而加重缺血性脑损伤;同时高血糖可增加血液黏度影响侧枝循环,干扰缺血脑组织血流恢复进一步加重病情。关于高血糖加重脑缺血损伤机制较多,均说明高血糖能加重脑梗死患者病情,本研究证实高血糖容易导致脑梗死病情进展。
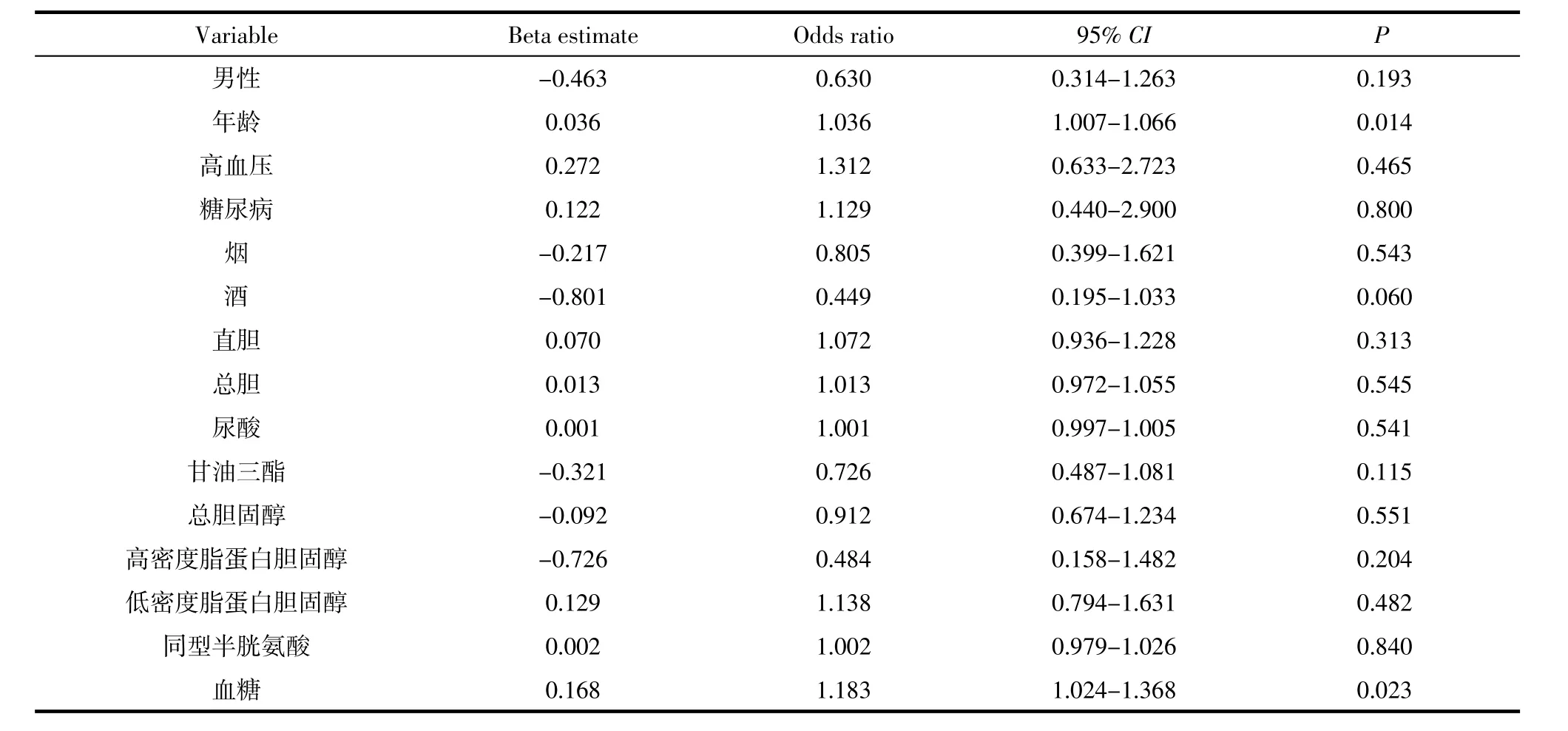
表3 进展性脑梗死的相关危险因素
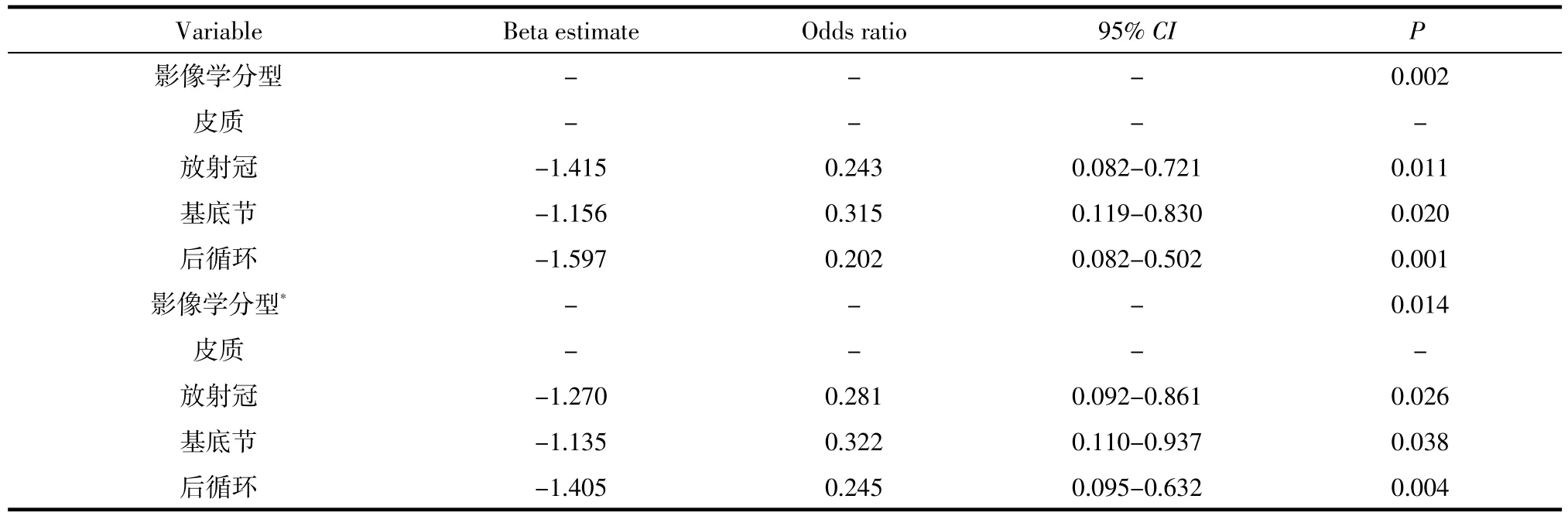
表4 进展性脑梗死与影像学分型间的危险相关度
脑梗死病情进展,是否与首发病灶部位的分布相关,现有临床证据尚未给出最终答案。本研究致力于解决此疑问。结果显示,在影像学亚型中,前循环皮质梗死病情更易进展,其他三种类型较前循环皮质发生进展性脑梗死的可能性大大减小,即使经上述危险因素如年龄、血糖等校正后,亦表现出很强的致病作用,表明前循环皮质部位的梗死是出现病情进展的独立危险因素,具有明显的预测作用。前循环皮质梗死患者,梗死范围常累及皮层及皮层下,影像学上多表现为大面积梗死。因存在脑组织缺血、水肿,梗死面积可能逐渐扩大,所以病情呈现进展性。此外,并发症如感染或水电解质紊乱等,这些都可能使病情逐渐进展。前循环皮质梗死中部分患者为大脑中动脉前、后交界区(分水岭)梗死。影像学研究发现进展性脑梗死主要为分水岭梗死[6]。分水岭血管为终末血管,离心脏最远,侧支循环较差,尤其是合并大血管狭窄时,其血流灌注极低,血压略有下降即引起脑梗死症状加重[7-8]。
综上所述,脑梗死的进展受多重因素影响,对于其病灶部位的影响作用,我们认为,前循环皮质梗死病情更容易进一步加重、恶化,病情容易进展。因此,在临床诊疗中,由于在梗死进展前已经明确病灶部位,早期影像学表现为前循环皮质的梗死,应更加注意脑梗死进展的出现。
[1]陈清棠.临床神经病学[M].北京科学技术出版社,2004.198-212.
[2]Kalowska E,Rostrup E,Rosenbaum S,et al.Acute MRI Changes in Progressive Ischemic Stroke[J].Eur Neurol,2008,59 (5):229-236.
[3]Ginsberg MD,Bogousslavsky J.Cerebrovascular disease:patho⁃ physiology,diagnosis,and management.//Bogousslavsky J,ed. Ischemic stroke topographic subtypes[M].Malden:Blackwell Sci,1998,921-930.
[4]Katsogridakis E,Dineen NE,Brodie FG,et al.Signal-to-noise ratio of bilateral nonimaging transcranial Doppler recordings of the middle cerebral artery is notaffected by age and sex[J].Ul⁃trasound Med Biol,2011,37:530-538.
[5]刘丽霞,周盛年等.年龄老化对缺血性脑卒中发生发展和恢复的影响[J].中国老年学杂志,2012,32(2):417-420.
[6]贺维亚,黄晓哲,蒋建华.进展性卒中相关因素临床分析[J].中风与神经疾病杂志,2004,21(5):461-462.
[7]Kalowska E,Rostrup E,Rosenbaum S,et al.Acute MRI Chang⁃es in rogressive Ischemic Stroke[J].Eur Neurol,2008,59: 229-236.
[8]Terasawa Y,Iguchi Y,Kimura K,et al.Neurological deteriora⁃tion in small vessel disease may be associated with increase of infarct volume[J].J Neurol,2008,269(1-2):35-40.
The role of imaging features of cerebral infarction in predicting the progressive cerebral infarction
.ZHANGYingsheng,WANG Kai.Department of Neurology,the First Hospital of An hui Medical University,Hefei 230022,China. Tel:0551-62922328.
ObjectiveTo investigate the role of imaging characteristics of cerebral infarction in different regions in predicting the progressive cerebral infarction(PCI).MethodsPatients with cerebral infarction were selected in the De⁃partment of Neurology of Hefei third People’s Hospital from January 2010 to June 2014.Brain MRI were examined the location of cerebral infarction.Patients were then classified into four groups accordingly:cortical infarction,basal gangli⁃on infarction,coronaradiata infarction and posterior infarction.Patients were further divided into PCI group and non-PCI group according to their clinical manifestations.MRI imaging features and risk factors were analyzed and compared be⁃tween PCI group and non-PCI group.ResultsA total of 150 patients with cerebral infarction were enrolled,including 99 cases of non-PCI and 51 cases of PCI.According to the Brain imaging classification,there were 46 cases of cortical in⁃farction,25 cases of coronaradiata infarction,47 cases of basal ganglion infarction and 32 cases of posterior infarction. There were significant differences in subtype cerebral infarction between PCI group and non-PCI group(χ2=19.239,P=0.001).The percent of cortical infarction were significantly higher in PCI group compared to the non-PCI group.Cortical infarction was correlated to PCI and the value ofRandPwas 0.170 and 0.026,respectively.Logistic regression revealed that Imaging of subtypes of cerebral infarction was correlative with PCI(P=0.002).The frequency of progression was sig⁃nificantly increased in cortical infarction than in other subtypes of cerebral infarction(P=0.002).The trend was still sig⁃nificant even after adjustment for age and blood glucose,(P=0.014).ConclusionThe location of cerebral infarction is closely correlated to PCI in which cortical infarction is more likely to develop PCI.
Progressive cerebral infarction Imaging Predicting
R743
A
2014-12-12)
(责任编辑:李立)
10.3936/j.issn.1002-0152.2015.06.002
☆ 国家自然科学基金(编号:91232717)
* 安徽医科大学第一附属医院神经内科(合肥230022)△ 合肥市第三人民医院神经内科
