RWD结构小泛素化增强子与缺氧诱导因子-1α在AtT-20细胞的表达☆
2015-02-01何伟杨炎林沈晓黎李敏张焱涂伟祝新根
何伟杨炎林沈晓黎李敏张焱涂伟祝新根
·论 著·
RWD结构小泛素化增强子与缺氧诱导因子-1α在AtT-20细胞的表达☆
何伟*杨炎林*沈晓黎*李敏*张焱*涂伟*祝新根*
目的研究RWD结构小泛素化增强子(RWD containing sumoylation enhancer,RSUME)调控缺氧诱导因子(hypoxia-inducible factor 1-alpha,HIF-1α)对AtT-20细胞侵袭的影响。方法通过氯化钴模拟小鼠垂体腺瘤AtT-20细胞的缺氧环境,并应用实时荧光定量PCR及蛋白质印迹法检测RSUME、HIF-1α的mRNA和蛋白水平的改变;然后运用HIF-1α小干扰RNA(small interfering RNA,siRNA)及阴性对照序列转染小鼠垂体腺瘤AtT-20细胞,实时荧光定量PCR及蛋白质印迹法检测RSUME的mRNA和蛋白水平的改变;运用RSUME siRNA及阴性对照序列转染小鼠垂体腺瘤AtT-20细胞后,实时荧光定量PCR及蛋白质印迹法检测HIF-1α的mRNA和蛋白水平的改变;并用Transwell及MTT法检测AtT-20细胞侵袭的改变。结果氯化钴作用AtT-20细胞后,细胞中RSUME的蛋白(P=0.003)和HIF-1α的蛋白(P=0.002)水平明显升高;HIF-1α siRNA转染的AtT-20细胞中RSUME mRNA(P=0.162)及蛋白(P=0.668)水平表达无明显变化;RSUME siRNA转染的AtT-20细胞中HIF-1α蛋白水平表达明显降低(P<0.001),而mRNA水平未见明显改变(P=0.136);RSUME siRNA转染组AtT-20细胞侵袭率较RSUME阴性对照组及空白对照组低(侵袭抑制率=26.2%±8.4%)。结论缺氧可诱导RSUME的表达,RSUME可调控HIF-1α的蛋白水平的作用影响AtT-20细胞的侵袭。
RWD结构小泛素化增强子 缺氧诱导因子1α AtT-20肿瘤侵袭
肿瘤快速生长往往伴随肿瘤血供的不足,易产生缺氧的微环境,而缺氧的微环境会加快肿瘤的生长速度,增加肿瘤的侵袭能力。缺氧诱导因子(hypoxia-inducible factor 1-alpha,HIF-1α)在肿瘤侵袭的过程中扮演着重要角色,HIF-1α可通过促进血管新生增加肿瘤侵袭性,然而HIF-1α在常氧环境下极易被降解。近期研究发现HIF-1α在肿瘤的稳定表达需依赖RWD结构小泛素化增强子(RWD containing sumoylation enhancer,RSUME)的调控[1]。侵袭性垂体腺瘤能对周围组织结构侵袭,其侵袭生长依赖HIF-1α稳定表达,因此RSUME在侵袭性垂体腺瘤中的作用至关重要。但RSUME在垂体腺瘤侵袭过程中扮演什么角色目前尚未报道。本研究通过小鼠垂体腺瘤AtT-20细胞为对象,通过体外建立缺氧模型,并应用HIF-1α、RSUME基因的小干扰RNA(small interfering RNA,siRNA)转染,研究RSUME与HIF-1α在AtT-20细胞的表达,以及对肿瘤侵袭的影响。
1 材料与方法
1.1 研究对象AtT-20细胞购自武汉普诺赛生命科技有限公司。细胞用含10%胎牛血清、5%青霉素-链霉素双抗的RPMI-1640培养基(美国Hy⁃clone公司)置于37℃、5%CO2培养箱中培养;2~3d传代1次,取对数生长期的细胞用于后续实验。试剂与仪器:Lipofectamine 2000购自Life生物有限公司;引物由上海生物工程公司合成;RIPA裂解液、总RNA抽提试剂Trizol、Taq PCR Mix,辣根过氧化物酶标记的山羊抗兔、山羊抗小鼠(二抗)、化学发光试剂盒购自武汉博士德生物工程公司;RSUME、HIF-1α基因序列的特异性小干扰RNA由上海吉玛公司设计合成;SYBR®Premix Ex Taq™Ⅱ购自Takara公司;RWDD3兔抗人、兔抗鼠多克隆抗体购自美国nvous公司,HIF-1α兔抗人、兔抗鼠多克隆抗体购自cell signaling生物有限公司;Transwell小室及Matrigel胶购自北京乐博生物科技有限公司。
1.2 氯化钴模拟肿瘤缺氧环境取生长良好的AtT-20细胞,移至15 mL离心管后充分吹打,置于低速离心机中1000r/min离心5 min,弃置上清液,加入适量培养液悬浮细胞。将悬浮细胞接种于培养瓶中培养,生长至融合度约60%时换液,加入含有100μmol/L氯化钴的培养液。培养过程中用倒置显微镜观察细胞生长状态。
1.3 RSUME siRNA和HIF-1α siRNA转染小鼠垂体腺瘤AtT-20细胞AtT-20细胞接种12孔细胞培养板中,1×105个/孔,细胞转染按照Lipo⁃fectamine 2000说明书进行。RSUME siRNA转染实验分:空白对照组、siRNA negative control(NC)组和RSUME siRNA转染组。HIF-1α siRNA转染实验分:空白对照组、siRNA negative control(NC)组和HIF-1α siRNA转染组。RSUME siRNA序列为5'GGACTTGTGGGTGAGGATG 3',阴性对照序列为5'GGATGGGAC TGGTTGGATG 3';HIF-1α siRNA序 列 为 5’CCAACCTCAGTGTGGGTAT 3’,HIF-1α siRNA阴性对照序列为5’CCAT⁃GTAG-GCGCAGTCTAT 3’由上海吉玛公司纯化合成。转染48h后荧光显微镜下观察含有红色荧光的AtT-20细胞数,若含荧光细胞比例占50%以上,用于行实时荧光定量PCR及蛋白质印迹法检测。
1.4 qRT-PCR检测RSUME、HIF-1α的mRNA表达使用总RNA抽提试剂,提取上述AtT-20细胞总RNA,各组AtT-20细胞取1×106个;配制PCR反应液:2μL cDNA,上下游引物各1μL,SYBR®Premix Ex Taq™Ⅱ10μL,添加去离子水使总体积达到20μL。RSUME上游引物:5'GAGAGCGAG⁃GACTAAATATGTC 3', 下 游 引 物 :5' CATTTTCTCTTTGCATTTCTTTC 3';HIF-1α上游引物:5'TACTGAGTTGATGGGTTATGA 3',下游引物:5'AAGGCAGCTTGTATCCTC 3';β-actin上游引物:5'GTGACGTTGACATCCGTAAAGA 3';下游引物:5'GCCGGACTCATCGTACTCC 3'。进行Re⁃al Time PCR反应:95℃预变性30s;95℃5s,60℃30s循环40次。根据公式ΔCt=Ct目的基因-Ctβ-actin和ΔΔCt=ΔCt处理组-ΔCt对照组统计结果,结果以2-ΔΔCt表示。
1.5 Western blot检测RSUME、HIF-1α蛋白的表达按照RIPA裂解液试剂盒说明书提取AtT-20的总蛋白,利用生物分光光度计比色分析总蛋白含量,取蛋白质40μg/孔进行电泳。80mV,在10%SDS-PAGE电泳2 h,蛋白胶条移至PVDF膜,250mA转膜80min。5%脱脂奶粉封闭液室温下封闭2 h,TBST洗膜3次。分别加入RWDD3、HIF-1α兔抗人多克隆抗体(1:1000稀释)、β-actin鼠抗人多克隆抗体(1∶5000稀释)一抗,4℃过夜孵育;洗膜3次后加入二抗(1∶5000稀释)。依据增强化学发光(Enhanced chemiluminescence,ECL)试剂盒操作说明进行显影、定影。利用凝胶图像分析系统对胶片进行灰度扫描和净光密度值分析。结果以目的蛋白/内参的IOD比值表示。
1.6 Transwell小室进行细胞侵袭试验将Tran⁃swell小室放入24孔板,50mg/L的Matrigel胶用无血清培养基1:8稀释,包被8μm孔径的Transwell上室的底部表面;用无血清的RPMI-1640培养基重悬细胞,调整细胞密度约1×105个/mL,各组取200μL加入上室,下室加10%胎牛血清培养液500μL,常规培养24 h(每组设3个重复小室)。AtT-20为悬浮细胞,直接迁移至下室培养基中。将下室培养基轻轻吹打混匀后行MTT法比较存活细胞数量。
1.7 MTT法检测垂体腺瘤AtT-20侵袭细胞数量将进行了Transwell侵袭试验的24孔板中加入500µL含0.5mg/mLMTT溶液,37℃孵育4h后加入500 µL DMSO,振荡10min,充分吹打混匀后加到96孔板中(每组设5个副孔),酶标仪检测490 nm波长处的吸光度值。结果以侵袭抑制率表示。侵袭抑制率(%)=(OD空白组-OD转染组)/OD空白组。
1.8 统计学方法各项试验重复3次,采用SPSS19.0进行分析,所有计量数据以均数±标准差表示,各组间数据的比较采用单因素方差分析,组间两两比较采用SNK法,检测水准α=0.05。
2 结果
2.1 氯化钴模拟肿瘤缺氧环境能上调RSUME及HIF-1α的表达氯化钴缺氧处理小鼠垂体腺瘤AtT-20细胞后,提取细胞的总mRNA及蛋白,应用实时荧光定量PCR结果显示,RSUME mRNA表达水平明显升高(F=156.251,P<0.001),而HIF-1α mRNA的表达水平无明显改变(F=1.050,P= 0.363);运用蛋白质印迹法检测总蛋白,结果显示,RSUME蛋白的表达水平明显升高(F=44.351,P=0.003),HIF-1α蛋白的表达水平也明显升高(F=46.610,P=0.002)。见表1,图1。
2.2 HIF-1α siRNA转染对RSUME的表达无影响HIF-1α siRNA转染AtT-20细胞后,提取细胞的总mRNA及蛋白,运用实时荧光定量PCR及蛋白质印迹法检测,结果行单因素方差分析及SNK法:与空白对照组及NC组相比,HIF-1α siRNA转染组的mRNA(F=471.476,P<0.001)及蛋白水平明显下降(F=25.403,P<0.001);然而RSUME mRNA(F= 2.502,P=0.162)和蛋白(F=0.379,P=0.668)表达水平在三组之间均无明显变化。见图2,表2。

图1 各组AtT-20细胞中RSUME、HIF-1α的蛋白表达水平,1:空白对照组;2:CoCl2处理组
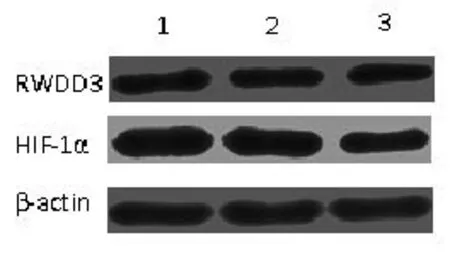
图2 HIF-1α siRNA转染后AtT-20细胞中RSUME、HIF-1α的蛋白表达水平,1:空白对照组;2:阴性对照组;3:siRNA转染组
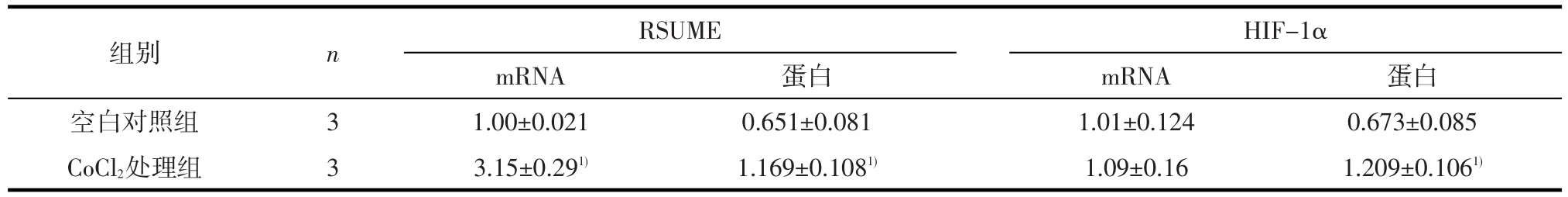
表1 AtT-20细胞中RSUME、HIF-1α的mRNA及蛋白表达水平

表2 HIF-1α siRNA转染后垂体腺瘤AtT-20细胞中RSUME、HIF-1α mRNA和蛋白的表达
2.3 RSUME siRNA转染下调HIF-1α的蛋白表达RSUME siRNA转染AtT-20细胞后,提取细胞总mRNA及蛋白,运用实时荧光定量PCR检测,结果行单因素方差分析及SNK法:与空白对照组及NC组相比,RSUME siRNA转染组的mRNA水平明显下降(F=80.435,P<0.001),HIF-1α mRNA的表达水平三组之间无明显变化(F=2.839,P=0.136);蛋白质印迹法检测结果显示:与未转染对照组及NC组相比,RSUME siRNA转染组的蛋白水平明显下降(F= 63.929,P<0.001),HIF-1α蛋白的表达水平也随着相应下降(F=96.345,P<0.001)。见图3、表3。
2.4 RSUME siRNA转染后抑制垂体腺瘤AtT-20细胞的侵袭 Transwell侵袭实验后收集下室细胞,行MTT法检测侵袭细胞数量,测得OD值分别为:未转染对照组(0.395±0.049),siRNA阴性对照组(0.385±0.058),RSUME siRNA转染组0.293± 0.061。RSUME siRNA转染组对AtT-20细胞侵袭的抑制与空白对照组及NC组不全相等(F=67.023,P<0.001),进一步行SNK法检验示,siRNA转染组的光密度值与空白对照组及NC组相比具有统计学意义,其侵袭抑制率(26.2%±8.4%)。
3 讨论
垂体腺瘤约占颅内肿瘤的10%~15%[2],其侵袭能力是患者预后的主要因素。约有35%垂体腺瘤能对周围组织结构侵袭被定义为侵袭性垂体腺瘤[2],目前垂体腺瘤的生长及侵袭的分子机制尚不清楚。关于垂体腺瘤的研究中,认为HIF-1的高表达为垂体腺瘤侵袭的重要因素。HIF-1是一种主要由分子量120kD的HIF-1α和分子量91~94 kD的HIF-1β两个亚基组成的异源性二聚体,其中HIF-1α是其主要的活性单位[3]。缺氧能诱导HIF-1α的表达,并且HIF-1α能通过调节多种基因的表达,参与肿瘤生成及侵袭的作用。众所周知,缺氧是肿瘤生长的基本特征,肿瘤的快速生长会导致肿瘤内部缺血缺氧,同时HIF-1α的表达也随之升高。本研究通过应用CoCl2模拟缺氧环境进行体外实验,结果显示缺氧可诱导HIF-1α的表达。随着肿瘤侵袭的增加,为保持肿瘤血供,肿瘤血管生存的能力将极大提高,而HIF-1α的靶因子血管内皮生长因子A(vascular endothelial growth factor A,VEGF-A)是该过程主要的调控因子[4]。然而正常氧浓度下HIF-1α很快会被细胞内的氧依赖性泛素蛋白酶结合,通过作用其泛素位点Lys391和Lys477,降解HIF-1α蛋白[5]。

图3 RSUME siRNA转染后AtT-20细胞中RSUME、HIF-1α的蛋白表达水平,1:空白对照组;2:阴性对照组;3:siRNA转染组
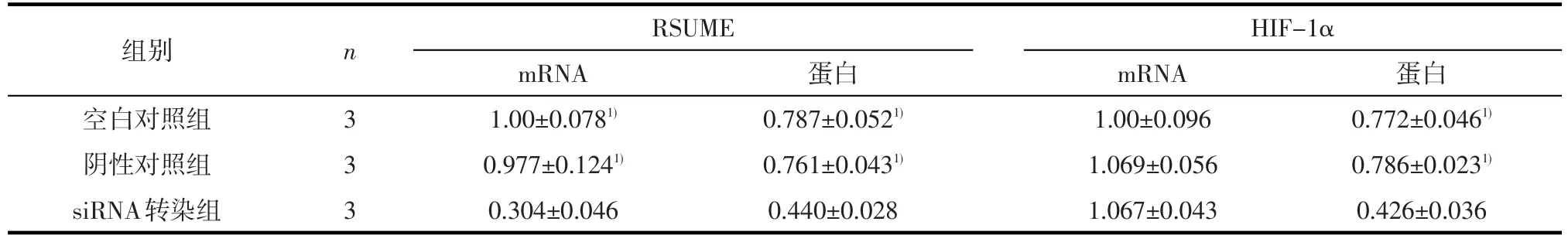
表3 RSUME siRNA转染后垂体腺瘤AtT-20细胞中RSUME、HIF-1α mRNA及蛋白的表达
小泛素化相关因子1(small ubiquitin related modifiers-1,SUMO-1)拥有与泛素分子相似的结构,能竞争性结合HIF-1α泛素化位点,竞争性抑制泛素化阻断蛋白质的泛素化-蛋白酶体降解途径,增加HIF-1α的稳定性[6]。SUMO化及作用首先需被E1激活酶激活,再转至E2结合酶,通过E3连接酶使SUMO羧基末端与HIF-1α的Lys残基通过异肽链连接,从而使HIF-1α SUMO化,稳定HIF-1α的作用[7]。但是SUMO化所需底物大部分都在细胞核内,RSUME可表达与SUMO的E2结合酶结构相似的结构蛋白,帮助SUMO-1与HIF-1α的泛素化位点结合,形成底物的SUMO化[8],而缺氧诱导能进一步诱导SUMO化的作用,由此可见缺氧为垂体腺瘤侵袭的重要因素之一。因此我们在此推测缺氧是否为RSUME的诱导因素?本研究通过模拟体外缺氧环境,结果显示RSUME mRNA及蛋白的表达水平明显升高,证实缺氧为RSUME的诱导因素之一。
同时缺氧调控HIF-1α激活的分子机制中,部分学者认为HIF-1α在转录后进行调控[9],部分学者认为HIF-1α在转录时进行调控[10]。在氯化钴模拟体外缺氧环境的实验中,我们发现:缺氧环境状态下的HIF-1α mRNA表达水平相对稳定,而蛋白水平却明显升高,这个结果与Kuiper学者的实验结果一致,证明缺氧调控HIF-1α发生在转录后。然而RSUME和HIF-1α之间的相互作用机制尚不清楚。
为了阐明垂体腺瘤中RSUME对HIF-1α的调控作用,本研究继续通过运用siRNA下调RSUME和HIF-1α的表达,结果显示通过抑制HIF-1α的表达,RSUME无论在mRNA的表达水平,还是在蛋白的表达水平上均未见明显改变。但当运用siRNA抑制RSUME表达,HIF-1α的mRNA表达水平无明显改变,但HIF-1α蛋白的表达水平明显下降。由此可见,RSUME可调节HIF-1α的表达影响垂体腺瘤的生长及侵袭,同时进一步证明RSUME在垂体腺瘤中对HIF-1α蛋白表达的影响主要发生在转录后。
RSUME最先由Carbia-Nagashima等[11]发现,并在小脑、垂体、心、肾、肝、胃、胰腺、前列腺和脾中检测出有较高的表达。Carbia-Nagashima等[14]曾提出,RSUME可成为肿瘤治疗新的靶点,但未进行相关研究。本研究通过siRNA抑制RSUME的表达,检测垂体腺瘤细胞的侵袭能力,结果显示:RSUME siRNA转染的AtT-20细胞的侵袭能力有所抑制,侵袭抑制率(%)=26.2%±8.4%。
垂体腺瘤的侵袭受多方面因素的影响,缺氧导致新生血管的形成为垂体腺瘤侵袭的主要因素,而HIF-1α在此过程尤其重要。然而HIF-1α仅仅为肿瘤侵袭过程中重要因素之一,因此垂体腺瘤的基因治疗需要进一步了解其作用机制,本研究证明RSUME可通过稳定HIF-1α的表达,进一步促进垂体腺瘤血管新生,影响肿瘤侵袭性。
[1]Shan B,Gerez J,Haedo M,et al.RSUME is implicated in HIF-1-induced VEGF-A production in pituitary tumour cells [J].Endocrine-Related Cancer,2012,19(1):13-27.
[2]张铃铛,霍钢,肖文峰,等.侵袭性垂体腺瘤与非侵袭性垂体腺瘤的基因差异表达谱[J].中国神经精神疾病杂志, 2011,37(7):428-430.
[3]何伟,王大鹏,沈晓黎.RSUME与垂体腺瘤侵袭性的分子机制的研究进展[J].中国肿瘤临床,2014,41(14):942-944.
[4]张广宇,焦保华,梁朝辉,等.基质金属蛋白酶-9和促血管生成素1、2与垂体腺瘤侵袭性的关系[J].中国神经精神疾病杂志,2011,37(6):333-336.
[5]Chan JY,Tsai CY,Wu CH,et al.Sumoylation of hypoxia-induc⁃ible factor-1α ameliorates failure of brain stem cardiovascular regulation in experimental brain death[J].PLoS One,2011,6(3): 173-175.
[6]Capili AD,Lima CD.Structure and analysis of a complex be⁃tween SUMO and Ubc9 illustrates features of a conserved E2-Ubl interaction[J].J Mol Biol,2007,369(3):608-618.
[7]Cubeñas-Potts C,Matunis MJ.SUMO:a multifaceted modifier of chromatin structure and function[J].Dev Cell,2013,24(1): 1-12.
[8]Druker J,Liberman AC,Antunica-Noguerol M,et al.RSUME enhances glucocorticoid receptor SUMOylation and transcrip⁃tional activity[J].Mol Cell Biol,2013,33(11):2116-2127.
[9]Kuiper C,Dachs GU,Currie MJ,et al.Intracellular ascorbate enhances hypoxia-inducible factor(HIF)-hydroxylase activity and preferentially suppresses the HIF-1 transcriptional response [J].Free Radic Biol Med,2014,69:308-317.
[10]Huang H,Benzonana LL,Zhao H,et al.Prostate cancer cell ma⁃lignancy via modulation of HIF-1α pathway with isoflurane and propofol alone and in combination[J].Br J Cancer,2014,111(7): 1338-1349.
[11]Carbia-Nagashima A,Gerez J,Perez-Castro C,et al.RSUME, a small RWD-containing protein,enhances SUMO conjugation and stabilizes HIF-1alpha during hypoxia[J].Cell,2007,131 (2):309-323.
R651
A
2015-01-25)
(责任编辑:甘章平)
10.3936/j.issn.1002-0152.2015.06.009
☆ 江西省自然科学基金(20142BAB205032);江西省教育厅科学基金(编号:GJJ14064);江西省科技厅科技支撑计划(编号:20133BBG70072);国家自然科学基金(编号:30760258)
* 南昌大学第二附属医院神经外科(南昌330006)
