GNP联合化疗治疗难治复发非霍奇金淋巴瘤的疗效分析
2015-01-27王志红周宏伟曹志刚周敏航冯少美古永建彭朝津孙君重杨清明
王志红,周宏伟,刘 默,曹志刚,周敏航,邢 丽,冯少美,古永建,彭朝津,孙君重,杨清明
解放军总医院第一附属医院 老年血液肿瘤科,北京 100048
非霍奇金淋巴瘤(non-hodgkin lymphoma,NHL)是一类异质性较高的恶性肿瘤,在世界卫生组织(World Health Organization,WHO)分类中有70多种。大多数非霍奇金淋巴瘤一线或二线化疗有效率可达到50% ~ 90%,但60% ~ 70%最终会发展成为复发或难治淋巴瘤,自体干细胞移植虽有较好的疗效,但复发患者没有有效的化疗方案,使得患者没有进一步自体干细胞移植的机会[1-2]。我科应用GNP(吉西他滨、奈达铂联合甲泼尼松龙)联合化疗方案治疗难治复发非霍奇金淋巴瘤取得了良好的疗效,现报告如下。
对象和方法
1 对象 选择本科2009年1月- 2013年7月难治复发(诊断标准见[3])的NHL患者30例,自愿接受至少2个疗程的GNP(吉西他滨、奈达铂联合甲泼尼松龙)联合化疗方案。其中难治12例,复发13例,进展5例。男性21例,女性9例,年龄20 ~ 74岁,中位年龄48.5岁。30例中,B细胞淋巴瘤18例,T细胞或NK/T细胞淋巴瘤12例;Ⅲ期9例,Ⅳ期21例;联合美罗华12例,未联合美罗华18例。既往应用的化疗方案为常用的治疗淋巴瘤的一线或二线方案。发病至GNP联合化疗前的病史中位时间为12(2 ~ 72)个月。患者治疗前血常规基线水平(中位数),白细胞为3.95(1.7 ~15.8)×109/L,血红蛋白为104(58 ~ 161)g/L,血小板为192(14 ~ 683)×109/L。患者具体情况见表1。
2 治疗 30例应用GNP联合化疗方案:吉西他滨1 g/m2,静滴,d1、d8;奈达铂 35 mg/m2,静滴,d1 ~ d2;甲泼尼松龙120 ~ 240 mg,静滴,1/d,d1 ~ d4。21 d为1个周期。接受治疗的中位周期数为2(2~7)个疗程。其中2例接受3个周期,2例接受4个周期,1例接受7个周期,余25例均接受2个周期。
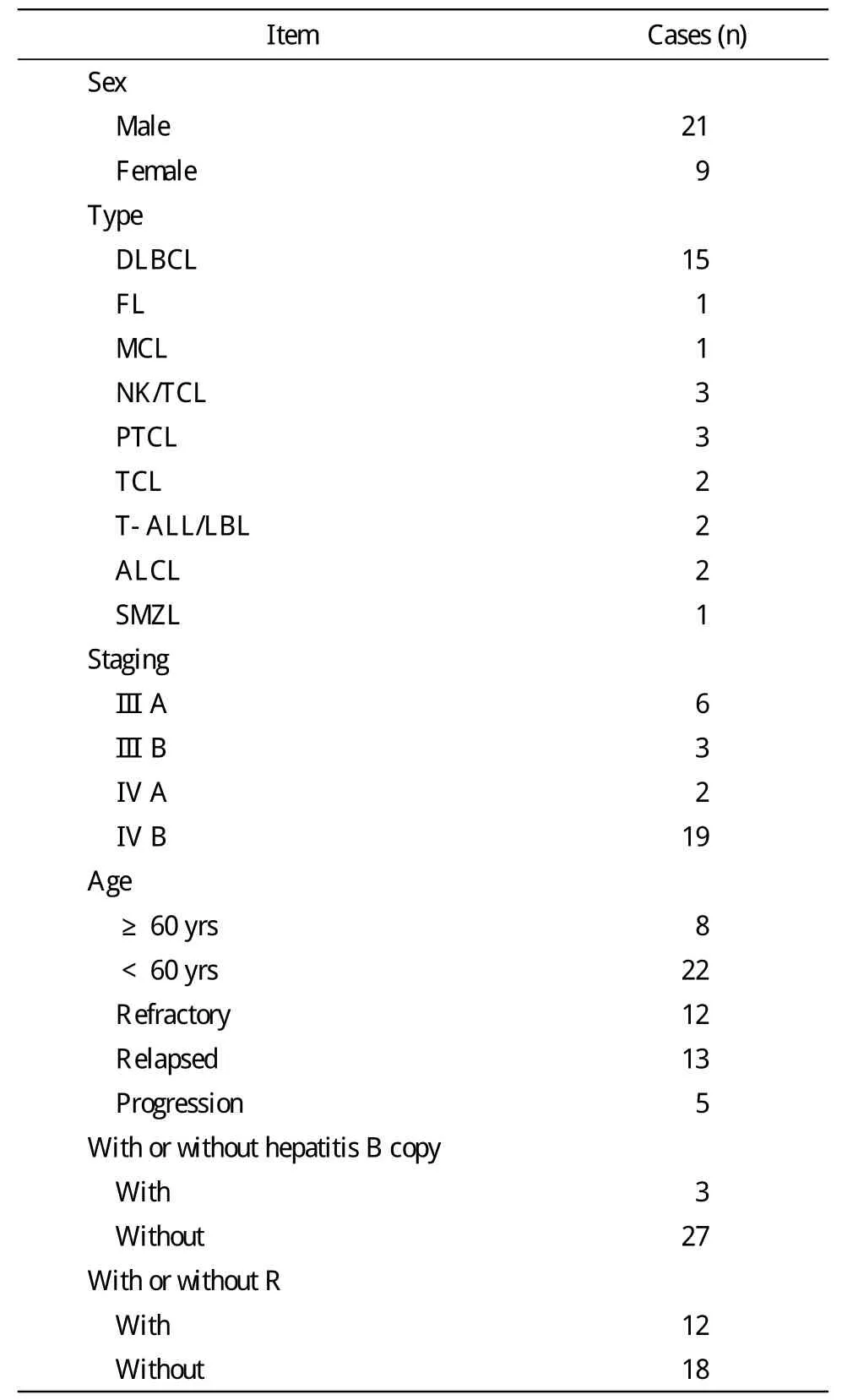
表1 30例难治复发NHL患者一般资料Tab. 1 Clinical data about 30 cases of NHL w ith refractory and relapse
3 疗效及安全性评价 采用1999年IWC的Cheson等的淋巴瘤疗效标准结合实体瘤疗效标准[4]。疗效判断分别为完全缓解(complete remission,CR)、未确定的完全缓解(uncertain complete remission,CRU)、部分缓解 (partial remission,PR)、稳定 (stable disease,SD)、复发 /进展 (relapse/progress disease,R/PD)。观察2个周期后的总反应率(over response rate,ORR)=CR+CRU+PR。观察30例患者的总生存(overall survival,OS)和无进展生存(progression free survival,PFS)。评判方法为CT或PET/CT。观察GNP方案的血液学或非血液学不良反应,评价其耐受性。
4 统计学处理 应用SPSS13.0软件进行统计学分析,采用Kaplan-Meier生存分析软件绘制总生存图及无进展生存图。
结 果
1 GDP方案对难治复发非霍奇金淋巴瘤的疗效 2个周期GNP方案治疗难治复发非霍奇金淋巴瘤的疗效显示CR 3例,PR 20例,SD 7例。ORR为76.7%。
2 生存分析 GNP方案治疗本组30例难治复发非霍奇金淋巴瘤的1年OS为86.7%(图1)。1年的PFS占40%,中位PFS为10个月(95% CI:5.8 ~14.2个月)。见图2。
3 GNP治疗的安全性评估 GNP方案治疗30例难治复发淋巴瘤血液学毒性较轻,Ⅲ~Ⅳ度的白细胞减少占43%,血红蛋白减少占26.7%,血小板减少占20%。非血液学毒性主要为消化道不良反应,未见Ⅲ~Ⅳ度的消化道不良反应,0 ~Ⅱ度的消化道不良反应经过止吐对症处理后均好转,患者耐受良好。1例Ⅰ度皮肤过敏,经过抗过敏治疗后皮疹消失。治疗期间5例体温超过38.0℃,经抗感染处理后好转,且2 ~ 5 d时体温均可控制正常。没有因化疗不良反应停止治疗或化疗相关死亡。不良反应见表2。
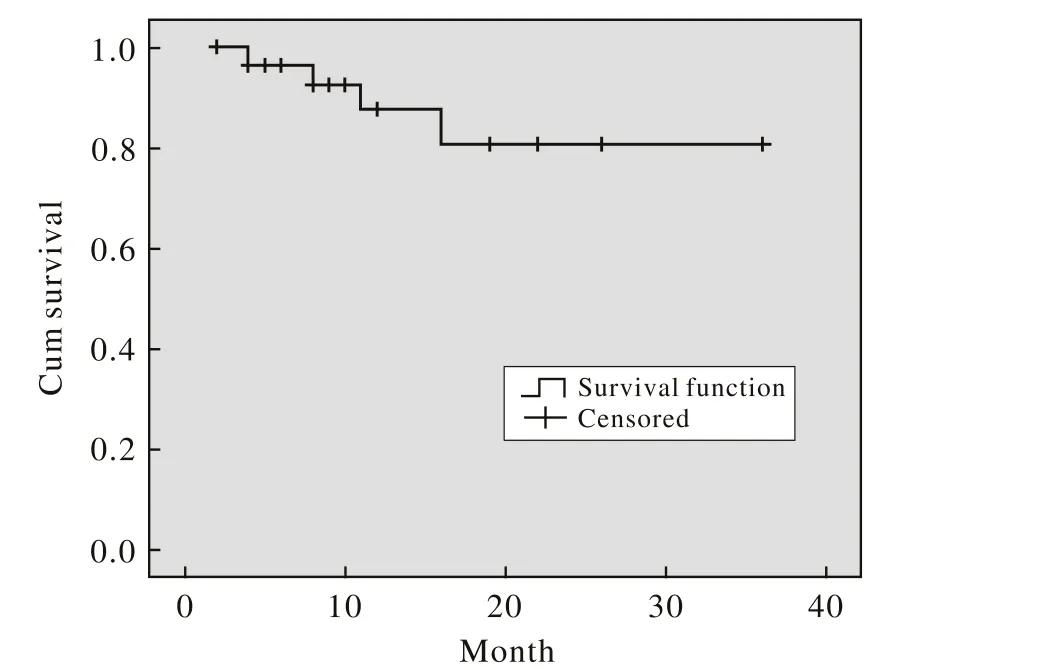
图 1 GNP方案治疗30例难治复发淋巴瘤的生存图Fig. 1 OS survival of GNP for refractory and relapse NHL in 30 cases
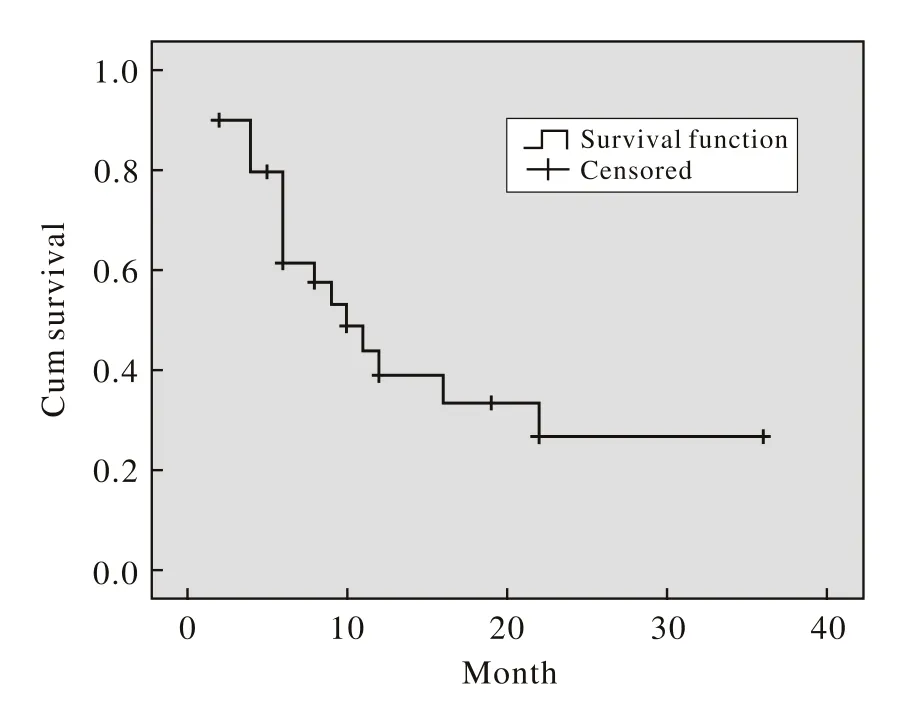
图 2 GNP方案治疗30例难治复发淋巴瘤的PFS图Fig. 2 PFS curve of GNP for refractory and relapse NHL in 30 cases
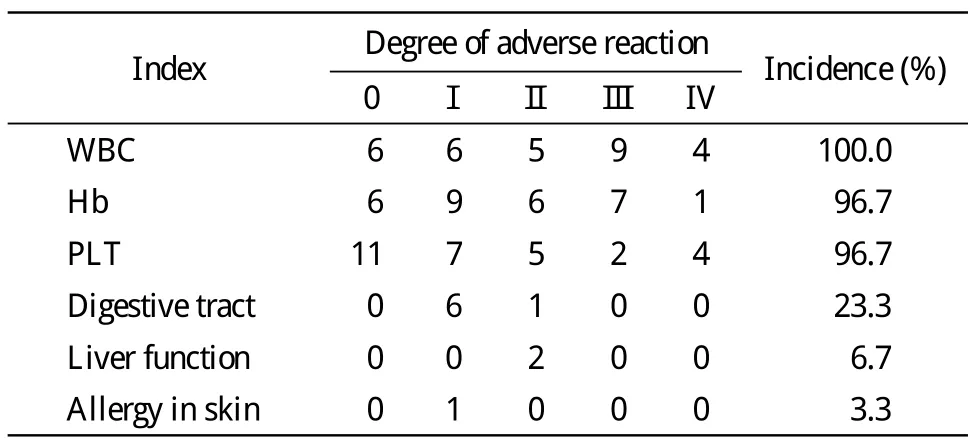
表2 GNP方案治疗难治复发淋巴瘤不良反应Tab. 2 Adverse response of GNP for refractory and relapse lym phoma (n)
4 后续治疗 GNP产生疗效后进一步巩固治疗:放疗1例,化疗1例,化疗联合细胞治疗1例,苯达莫斯丁、克拉曲滨1例,2例自体造血干细胞移植后获得3年以上的无病生存期。
讨 论
NHL是一组恶性程度较高,难以治愈的血液系统恶性肿瘤。60% ~ 70%的NHL会发展成为难治复发的病例[5],再次治疗的缓解率为50% ~70%[6],但持续时间短,生活质量下降,导致生存期缩短,文献报道的无进展生存期为2 ~ 7个月[7]。由于自体干细胞移植或异体干细胞移植可以达到较高的长期生存率[1-2],GNP化疗方案治疗难治复发NHL的良好疗效可以为患者创造下一步移植的机会,达到更好的缓解率及生存期。
铂类(奥沙利铂、顺铂、奈达铂)联合其他药物治疗实体瘤已取得了确切的疗效[8-12]。铂类(奥沙利铂、顺铂)联合吉西他滨治疗难治淋巴瘤也有很多报道[13-18],但顺铂严重的消化道不良反应以及奥沙利铂的神经系统不良反应限制其联合方案的临床应用。本研究应用GNP联合化疗(2个疗程)治疗本组难治复发NHL的近期疗效,ORR达到76.7%,与其常用难治复发的方案如ESHAP、MINE、ICE等方案的ORR 50% ~ 70%[19-21]相似。本研究的1年总生存率达到86.7%,略高于有关吉西他滨联合顺铂或奥沙利铂方案的20% ~ 80%[13-18]。1年PFS 40%,中位PFS达到10个月,略高于同类含顺铂方案的PFS 2 ~ 7个月[7]。
GNP方案的安全性很高。以往难治复发NHL的方案大多血液学毒性较重,而吉西他滨联合铂类的化疗方案血液学毒性相对较轻。本组GNP化疗不良反应的结果也进一步证实这一点。这也成为老年或者难治复发病例更适合的方案[6]。GNP化疗后感染出血的风险明显减少。其非血液学毒性也较常用的难治复发淋巴瘤的化疗方案低,这有利于该方案顺利地进行,患者的依从性均良好。
GNP方案不能完全治愈NHL,但可以使患者更好的缓解,为下一步化疗或自体、异体造血干细胞移植提供机会。本组6例经过其他治疗获得了再次缓解或长期生存。
GNP有局限性,其反应率虽然较高,但PFS时间不长,故在达到CR或PR时应尽快根据患者的具体情况采取下一步治疗。
1 Rodríguez J, Conde E, Gutiérrez A, et al. The ad justed International Prognostic Index and beta-2-microglobulin predict the outcome after autologous stem cell transplantation in relapsing/refractory peripheral T-cell lymphoma[J]. Haematologica, 2007,92(8): 1067-1074.
2 Reimer P, Rüdiger T, Geissinger E, et al. Autologous stem-cell transplantation as first-line therapy in peripheral T-cell lymphomas:results of a prospective multicenter study[J]. J Clin Oncol, 2009,27(1):106-113.
3 张之南,沈悌.血液病诊断及疗效标准及疗效标准[M].北京:科学出版社,2007:133,225.
4 克晓燕,高子芬.淋巴瘤[M].北京:科学技术文献出版社,2009:110-111.
5 Baetz T, Belch A, Couban S, et al. Gemcitabine, dexamethasone and cisplatin is an active and non-toxic chemotherapy regimen in relapsed or refractory Hodgkin’s disease: a phase II study by the National Cancer Institute of Canada Clinical Trials Group[J]. Ann Oncol,2003, 14(12): 1762-1767.
6 Crump M, Baetz T, Couban S, et al. Gemcitabine, dexamethasone,and cisplatin in patients with recurrent or refractory aggressive histology B-cell non-Hodgkin lymphoma: a Phase II study by the National Cancer Institute of Canada Clinical Trials Group (NCICCTG)[J]. Cancer, 2004, 101(8): 1835-1842.
7 Arkenau HT, Chong G, Cunningham D, et al. Gemcitabine, cisplatin and methylprednisolone for the treatment of patients with peripheral T-cell lymphoma : the Royal Marsden Hospital experience[J].Haematologica, 2007, 92(2): 271-272.
8 韩雅琳,陈丽,吴志勇,等.伊立替康联合奥沙利铂三线治疗晚期胃癌的疗效分析[J].解放军医学院学报,2014,35(5):416-419.
9 张淼慈,哈敏文.培美曲塞或雷替曲塞联合顺铂一线治疗恶性胸膜间皮瘤的疗效与安全性观察[J].解放军医学院学报,2014,35(10):1004-1007.
10 Yamashita H, Omori M, Takenaka R, et al. Involved-field irradiation concurrently combined with nedaplatin/5-fluorouracil for inoperable esophageal cancer on basis of (18)FDG-PET scans: a phase II study[J]. Radiother Oncol, 2014, 113(2): 182-187.
11 Fujiwara M, Isohashi F, Mabuchi S, et al. Efficacy and safety of nedaplatin-based concurrent chemoradiotherapy for FIGO Stage IB2-IVA cervical cancer and its clinical prognostic factors[J]. J Radiat Res, 2015, 56(2):305-314.
12 Hoshikawa H, Kishino T, Mori T, et al. Clinical outcomes of nedaplatin and S-1 treatment with concurrent radiotherapy in advanced head and neck cancer[J]. Acta Otolaryngol, 2015, 135(1): 103-108.
13 Velasquez WS, Mclaughlin P, Tucker S, et al. ESHAP--an effective chemotherapy regimen in refractory and relapsing lymphoma: a 4-year follow-up study[J]. J Clin Oncol, 1994, 12(6): 1169-1176.
14 Elsamany S, Farooq MU, Elsirafy M, et al. Phase II study of lowdose fixed-rate infusion of gemcitabine combined with cisplatin and dexamethasone in resistant non-Hodgkin lymphoma and correlation with Bcl-2 and MDR expression[J]. Med Oncol, 2014, 31(3):872.
15 Wang L, Wang WD, Xia ZJ, et al. Combination of gemcitabine,L-asparaginase, and oxaliplatin (GELOX) is superior to EPOCH or CHOP in the treatment of patients with stage IE/IIE extranodal natural killer/T cell lymphoma: a retrospective study in a cohort of 227 patients with long-term follow-up[J]. Med Oncol, 2014, 31(3):860.
16 Aota Y, Tanaka M, Watanabe N, et al. Outpatient reinduction therapy with gemcitabine, dexamethasone, Cisplatin (GDP) for patients with relapsed and refractory lymphoma[J]. Gan To Kagaku Ryoho, 2015, 42(1): 51-55.
17 Fields PA, Townsend W, Webb A, et al. De novo treatment of diffuse large B-cell lymphoma with rituximab, cyclophosphamide,vincristine, gemcitabine, and prednisolone in patients with cardiac comorbidity: a United Kingdom National Cancer Research Institute trial[J]. J Clin Oncol, 2014, 32(4): 282-287.
18 Gutierrez A, Rodriguez J, Martinez-Serra J, et al. Gemcitabine and oxaliplatinum: an effective regimen in patients with refractory and relapsing Hodgkin lymphoma[J]. Onco Targets Ther, 2014, 7 :2093-2100.
19 Mounier N, El Gnaoui T, Tilly H, et al. Rituximab plus gemcitabine and oxaliplatin in patients with refractory/relapsed diffuse large B-cell lymphoma who are not candidates for high-dose therapy. A phase II Lymphoma Study Association trial[J]. Haematologica, 2013, 98(11):1726-1731.
20 Fan Y, Huang ZY, Luo LH, et al. MINE regimen for patients with relapsed or chemo-resistant invasive non-Hodgkin’s lymphoma[J].Ai Zheng, 2005, 24(12): 1503-1506.
21 Abali H, Urün Y, Oksüzoğlu B, et al. Comparison of ICE(ifosfam ide-carboplatin-etoposide) versus DHAP (cytosine arabinoside-cisplatin-dexamethasone) as salvage chemotherapy in patients with relapsed or refractory lymphoma[J]. Cancer Invest,2008, 26(4):401-406.
