不同亚型急性缺血性卒中动态脑血流自动调节的研究
2015-01-23郭珍妮刘嘉邢英琦闫硕吕存玲靳航杨弋
郭珍妮,刘嘉,邢英琦,闫硕,吕存玲,靳航,杨弋
在急性缺血性卒中中,动态脑血流自动调节功能(dynamic cerebral autoregulation,dCA)易受到影响[1-3]。大动脉粥样硬化性卒中和小动脉闭塞性卒中是急性缺血性卒中最常见的两种类型[4]。然而,由于脑血管疾病对dCA的影响机制不同,导致临床表现及预后各异。因此,了解不同缺血性卒中亚型中dCA的各个参数变化有助于卒中的预防、早期治疗及判断预后。
研究显示颅内大动脉狭窄患者因血管舒缩功能受损,导致同侧脑血流动力学改变,对侧大脑半球由于侧支循环开放或其他原因不会发生明显血流动力学改变[5-6]。然而,小动脉闭塞性卒中(多由高血压、糖尿病等慢性疾病引起[7-8]),由于小血管受累广泛,血管调节能力受损更弥散,多为双侧受累。
因此,假设大动脉粥样硬化性卒中病变侧的dCA较对侧更易受损;小动脉闭塞性卒中dCA为双侧受损。本研究将通过传递函数(transfer function analysis,TFA)分析dCA的各参数来验证以上假设。
1 对象和方法
1.1 对象和分组 本研究为前瞻性研究,连续收集2013年4月~2013年10月在吉林大学白求恩第一医院神经内科的住院患者。所有受试者均签署知情同意书,该研究获得吉林大学白求恩第一医院伦理委员会的批准。
1.1.1 入组条件 ①首次发病的急性缺血性卒中患者;②单侧大脑中动脉(middle cerebral artery,MCA)供血区的卒中,无其他颅内或颅外主要血管的狭窄或闭塞;③未经溶栓、介入及外科手术治疗;④双侧颞窗穿透良好。排除标准:意识障碍或其他原因不能配合dCA监测;既往有心房颤动、心肌梗死、不稳定心绞痛、糖尿病、头部磁共振成像(magnetic resonance imaging,MRI)显示明显的脑白质病和脑萎缩、肾功能不全、自主神经疾病、近期服影响自主神经功能的药物;经颅多普勒超声(TCD,MultiDop X2,DWL,Sipplingen,德国)和头部磁共振血管成像(magnetic resonance angiography,MRA)明确存在颅内或颅外动脉狭窄或闭塞。TCD诊断MCA狭窄标准为:狭窄≥50%,平均流速>100 cm/s;≥70%狭窄,平均流速>120 cm/s[9]。MRA结果作为进一步辅助检查。经心内科医生检查排除心房颤动、心肌梗死和不稳定心绞痛。根据急性卒中治疗低分子肝素试验病因分型法(Trial of Org 10172 in Acute Stroke Treatment,TOAST)将卒中患者分为大动脉粥样硬化性和小动脉闭塞性。MRI显示梗死灶直径<1.5 cm为腔隙性梗死;梗死灶直径>1.5 cm,同时同侧大脑中动脉狭窄>50%为大动脉粥样硬化性卒中。排除其他类型缺血性卒中患者。每位患者均由2名神经内科专家根据临床症状、颅脑MRI、MRA和TCD结果分类。随机选取20位健康受试者作为对照组。
1.1.2 研究方案 发病5~10 d完成dCA监测。受试者12 h内禁咖啡、酒、吸烟等,研究室温度控制在20~24℃,保持相对的安静,尽量减少外界干扰。让受试者头略高平卧10 min后,通过TCD持续监测双侧MCA流速、指尖血压监测法(Finometer Pro,Netherlands)持续监测血压,监测时间为10 min。通过鼻导管连接面罩(MultiDop X2,DWL,Sipplingen,Germany)监测呼气末二氧化碳(EtCO2)浓度。
1.1.3 数据分析 所得数据通过电脑软件MATLAB进行分析,应用TFA来计算dCA。血压和脑血流量间的TFA通过两个信号的交叉频谱及动脉血压的频谱图来计算。由TFA推导出脉冲和频率响应。在时间域内,阶跃响应通过脉冲响应和脑血流量对变化的动脉血压的反应来计算。用4 s内的线性回归来反映阶跃响应,其意义在于研究当血压变化时,脑血流量最快恢复到起始水平的时间,斜率越陡峭,说明调节越迅速[11]。在0.06~0.12 Hz,计算PD、增益和相关函数(coherence function),这些参数与脑血流动力学最相关[12]。我们只采用了coherence function>0.5的数据。
1.2 统计学分析 采用统计软件(SPSS 17.0 IBM,WEST Grove,PA,USA)进行数据分析。计量资料均表示(s),t检验进行数据分析;分类变量采用构成比表示,通过卡方检验和Fisher精确检验进行数据分析,P<0.05表示差异具有显著性。
2 结果
2.1 人口学资料 本研究共收集41例患者[年龄(50.7±12.1)岁,男性33例,女性8例],其中15例大动脉粥样硬化性卒中[(44.7±13.1)岁,男性12例,女性3例],26例小动脉闭塞性卒中[(54.1±9.7)岁,男性21例,女性5例]。大动脉粥样硬化组:7例(46.7%)仅表现为运动功能障碍,2例(13.3%)仅表现为语言功能障碍,6例(40%)同时存在运动功能和语言功能障碍;10例MCA狭窄≥50%、5例MCA狭窄≥70%。小动脉闭塞组:14例(53.8%)为纯运动性卒中,2例(7.7%)为纯感觉性卒中,10例(38.5%)为运动感觉性卒中。20例健康志愿者作为对照组[(42.2±13.7)岁,男性16例,女性4例]。3组患者的性别、心率、EtCO2差异无显著性。小动脉闭塞组平均年龄较其他两组大近10岁(与对照组比较t=3.4,P=0.001;与大动脉粥样硬化组比较t=-2.6,P=0.012);小动脉组平均动脉压高于对照组(t=2.2,P=0.031)(表1)。
2.2 动态脑血流自动调节 通过TFA研究dCA的3个参数:增益、PD、阶跃响应,有效的频率范围为0.06~0.12 Hz,阶跃响应的前4 s用来计算斜率。数据结果见图1,统计分析结果见表2和图2。
2.2.1 相位差 对照组:左侧大脑半球65.8°±24.1°,右侧半球67.4°±24.2°,两侧差异无显著性(t=0.4,P>0.1)(表2,图1~2)。整体PD(左侧+右侧)为66.6°±23.8°。
大动脉粥样硬化组:病变侧半球明显低于非病变侧半球(42.9°±18.5° vs 72.4°±29.9°,t=-4.2,P<0.01)和对照组(t=-3.4,P<0.01)。非病变侧半球与对照组相似(t=-0.74,P>0.1)(表2,图1~2)。
小动脉闭塞组:双侧大脑半球相近(33.8°±17.9° vs 32.6°±21.1°,t=0.60,P>0.1)均明显低于对照组(P<0.001)(表2,图1~2)。
2.2.2 增益 3组间的双侧大脑半球间的增益差异均无显著性(P>0.05)(表2,图1~2)。
2.2.3 阶跃响应 对照组和小动脉闭塞组的双侧大脑半球间的阶跃响应比较差异无显著性;然而,对照组的整体阶跃响应(-0.23±0.14)较小动脉闭塞组陡峭(病变侧半球:-0.17±0.09,t=2.1,P<0.05;非病变侧半球:-0.15±0.08,t=2.8,P<0.01)(表2,图1~2)。
大动脉粥样硬化组两侧不对称,非病变侧半球较病变侧半球陡峭(-0.24±0.11 vs-0.14±0.15,t=3.1,P<0.01)(表2,图1~2)。且非病变侧半球与对照组比较,差异无显著性(t=-0.17,P>0.1),病变侧半球较对照组平缓(t=2.0,P<0.05)。
3 讨论
本研究发现大动脉粥样硬化性卒中病变半球dCA受损,非病变半球dCA保留;小动脉闭塞性卒中,则双侧大脑半球dCA均受损。该结果不仅支持假设,并揭示不同的卒中亚型脑血流动力学改变不同,影响dCA的机制也不同。

表1 基线资料
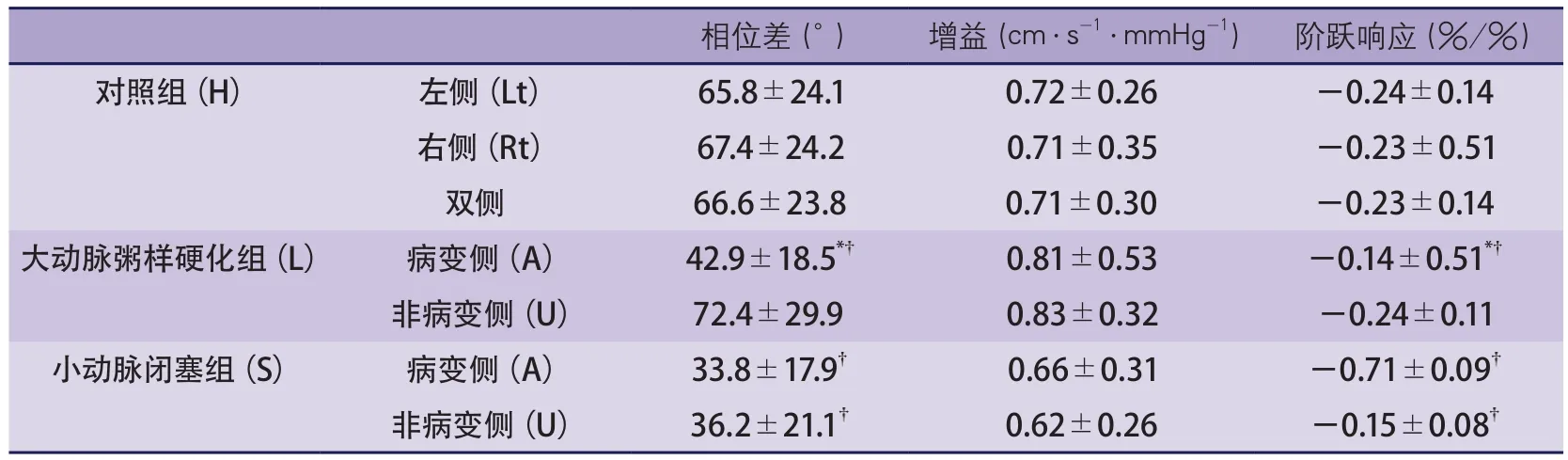
表2 各组动态脑血流自动调节的相关参数——相位差、增益、阶跃响应
研究发现存在严重单侧颈动脉及大脑中动脉狭窄患者,与对侧dCA相比,同侧dCA受损[5,13-14]。Immink等[7]发现MCA供血区大面积缺血性卒中患者梗死灶同侧dCA受损。然而,这些研究并未得出急性缺血性卒中与动脉狭窄的关系。本研究发现急性缺血性卒中同侧的dCA改变主要是由于大动脉狭窄,灌注降低,该侧MCA供血区的其他血管通过舒张来保持血容量的相对稳定。大动脉粥样硬化性卒中侧的PD平均值相对较高(42.9°±18.5°)(表2),可能与侧支循环的建立有关[15]。一些其他研究显示:在急性缺血性卒中发生的5~14 d,受损的dCA可传递到对侧。因此,本研究监测、收集了发病5~10 d的数据,但未得出相似结论。原因可能是由于本研究采用了更严格的排除标准,如排除了腔隙性梗死、心源性栓塞和不明原因的卒中。
在小动脉闭塞组,本研究发现双侧dCA受损,该结论与Immink等[7]的研究相似。一些研究者认为这可能与颅内小血管疾病有关(如高血压、糖尿病等慢性疾病)。尽管小血管疾病的真正机制尚不明确,引起该病理变化的主要原因之一有小动脉粥样硬化[8,18],小动脉硬化造成舒缩功能下降,dCA受损,继而脑血管清除栓子能力下降,最终导致脑动脉栓塞[19-20]。必须注意的是脑小血管疾病是弥散的,MCA的dCA受损可能反映了整个半球的颅内小动脉调节能力降低,因此,本研究认为dCA受损是引起急性腔隙性梗死的重要危险因素,而不是急性腔隙性梗死引起的dCA受损,因为引起腔隙性梗死的血管非常小,不足以引起整个半球的调节能力改变。
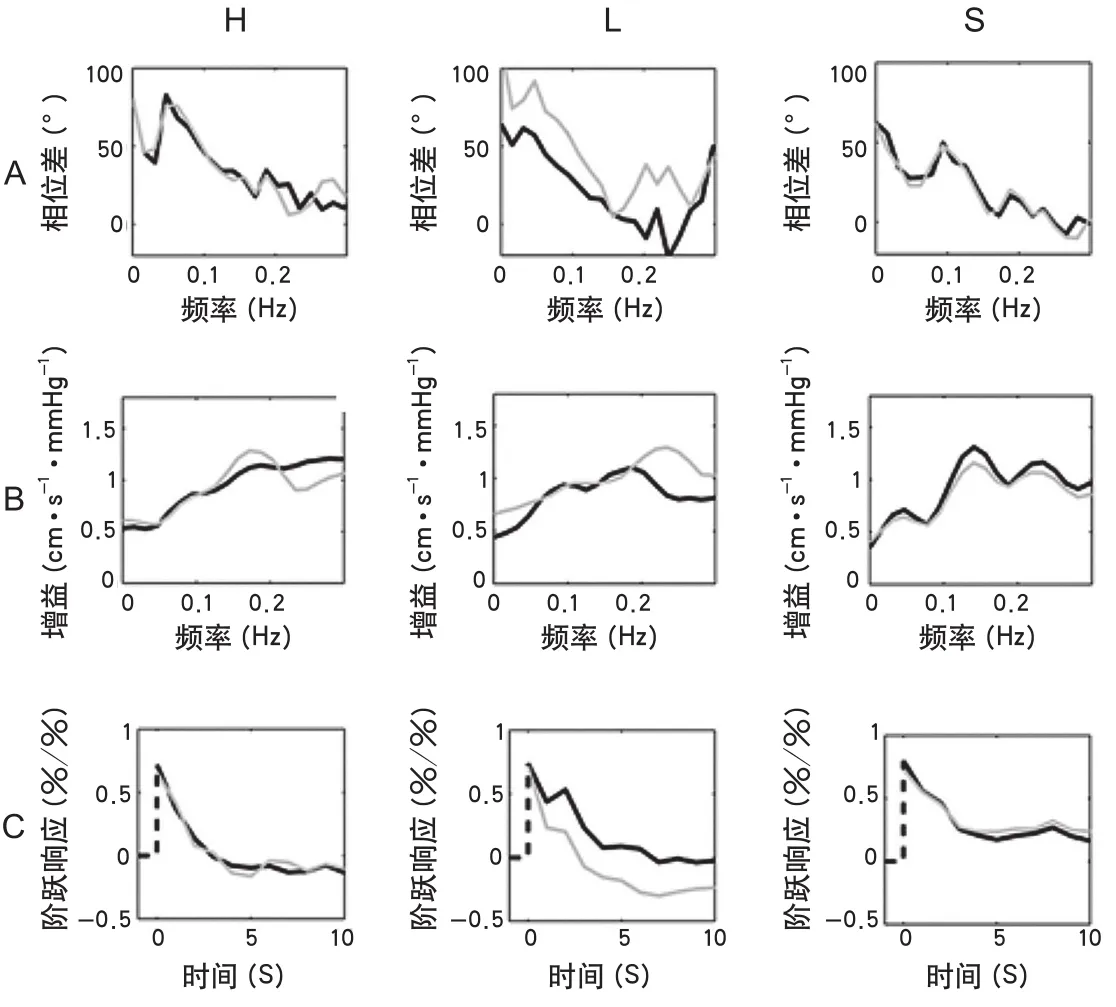
图1 自动调节参数示意图注:图A为相位差,图B为增益;图C为阶跃响应,其中 为右侧, 为左侧; 为病变半球, 为非病变半球;H、L、S分别代表对照组、大动脉粥样硬化组、小动脉闭塞组。H列对照组的所有参数,调节能力完整,阶跃响应迅速,当血压发生变化时,脑血流量可在4 s内回恢复到原始水平。L列描绘出两侧参数改变的不对称性,病变半球的dCA各参数较非病变半球均大幅度减低。在S列描绘出,与健康对照组相比,dCA双侧均受损。dCA:动态脑血流自动调节
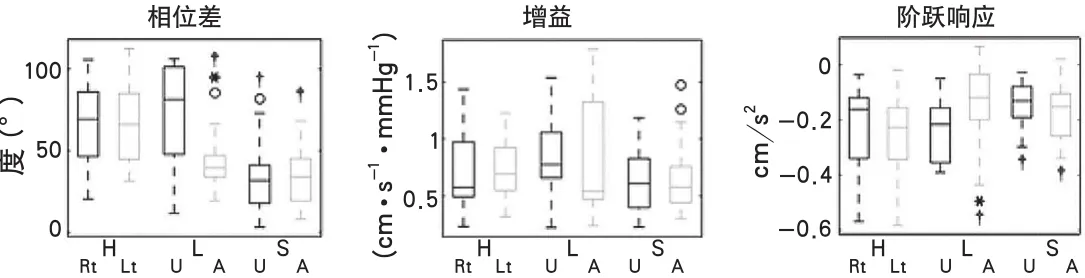
图2 自动调节参数统计图注:图A为在大动脉粥样硬化组,病变侧大脑半球的相位差明显低于非病变侧及对照组;小动脉闭塞组双侧均低于对照组,且双侧半球间差异无显著性。图B显示各组的增益差异无显著性。图C显示阶跃响应所得结论与相位差一致。阶跃响应在大动脉粥样硬化组的病变侧较其他组区趋于平缓,小动脉闭塞组的双侧均较平缓。H、L、S代表意义同图1;Rt为右侧,Lt为左侧,A为病变半球,U为非病变半球。每个箱线图,中间是平均数,边缘分别代表第25、75中位数,“o”代表离群值,“*”代表每组双侧大脑半球的P<0.05,“”代表与健康对照组相比P<0.05
本研究不足之处:在大动脉粥样硬化性卒中中,监测狭窄的MCA相对困难,易出现采集的信号不稳定,不符合纳入的质量标准,所以造成大动脉粥样硬化性卒中的数量较少;入组的男性患者较女性多,这是由于中国卒中男性发病率较女性高[21],同时,女性相对颞窗穿透欠佳所致[22];小动脉闭塞组的患者年龄和血压与其他两组不同,然而,如之前研究所示,小动脉闭塞性卒中多由高血压、糖尿病的慢性疾病引起的病理性改变[7-8],这些危险因素很难控制。此外,因为考虑到患者能够高度配合完成监测,本研究只选取了轻、中度临床症状的患者入组,可能忽略了症状严重患者受损的dCA对数据统计的偏差。
4 结论
本研究显示急性缺血性卒中的不同亚型对dCA的影响是多样的,这可能与脑血管的不同病理改变有关。大动脉粥样硬化性卒中影响单侧dCA,小动脉闭塞性卒中多影响双侧dCA。
[本文由作者译自PLoS One,2014 Mar 26,9(3):e93213]
1 Eames PJ, Blake MJ, Dawson SL, et al. Dynamic cerebral autoregulation and beat to beat blood pressure control are impaired in acute ischaemic stroke[J]. J Neurol Neurosurg Psychiatry, 2002, 72:467-472.
2 Dawson SL, Panerai RB, Potter JF. Serial changes in static and dynamic cerebral autoregulation after acute ischaemic stroke[J]. Cerebrovasc Dis, 2003, 16:69-75.
3 Saeed NP, Panerai RB, Horsfield MA, et al. Does stroke subtype and measurement technique influence estimation of cerebral autoregulation in acute ischaemic stroke?[J]. Cerebrovasc Dis, 2013, 35:257-261.
4 Adams HP, Bendixen BH, Kappelle LJ, et al. Classification of subtype of acute ischemic stroke. Definitions for use in a multicenter clinical trial. TOAST. Trial of Org 10172 in Acute Stroke Treatment[J]. Stroke, 1993, 24:35-41.
5 White RP, Markus HS. Impaired dynamic cerebral autoregulation in carotid artery stenosis[J]. Stroke,1997, 28:1340-1344.
6 Kleiser B, Widder B. Course of carotid artery occlusions with impaired cerebrovascular reactivity[J].Stroke, 1992, 23:171-174.
7 Immink RV, van Montfrans GA, Stam J, et al.Dynamic cerebral autoregulation in acute lacunar and middle cerebral artery territory ischemic stroke[J].Stroke, 2005, 36:2595-2600.
8 Khan U, Porteous L, Hassan A, et al. Risk factor profile of cerebral small vessel disease and its subtypes[J]. J Neurol Neurosurg Psychiatry, 2007,78:702-706.
9 Zhao L, Barlinn K, Sharma VK, et al. Velocity criteria for intracranial stenosis revisited an international multicenter study of transcranial Doppler and digital subtraction angiography[J]. Stroke, 2011, 42:3429-3434.
10 Zhang R, Zuckerman JH, Giller CA, et al. Transfer function analysis of dynamic cerebral autoregulation in humans[J]. Am J Physiol, 1998, 274:H233-H241.
11 Liu Y, Birch AA, Allen R. Dynamic cerebral autoregulation assessment using an ARX model:comparative study using step response and phase shift analysis[J]. Med Eng Phys, 2003, 25:647-653.
12 Haubrich C, Wendt A, Diehl RR, et al. Dynamic autoregulation testing in the posterior cerebral artery[J]. Stroke, 2004, 35:848-852.
13 Reinhard M, Roth M, Müller T, et al. Effect of carotid endarterectomy or stenting on impairment of dynamic cerebral autoregulation[J]. Stroke, 2004, 35:1381-1387.14 Gong XP, Li Y, Jiang WJ, et al. Impaired dynamic cerebral autoregulation in middle cerebral artery stenosis[J]. Neurol Res, 2006, 28:76-81.
15 Henderson RD, Eliasziw M, Fox AJ, et al.Angiographically defined collateral circulation and risk of stroke in patients with severe carotid artery stenosis[J]. Stroke, 2000, 31:128-132.
16 Reinhard M, Rutsch S, Lambeck J, et al. Dynamic cerebral autoregulation associates with infarct size and outcome after ischemic stroke[J]. Acta Neurol Scand, 2012, 125:156-162.
17 Reinhard M, Roth M, Guschlbauer B, et al.Dynamic cerebral autoregulation in acute ischemic stroke assessed from spontaneous blood pressure fluctuations[J]. Stroke, 2005, 36:1684-1689.
18 Pantoni L. Cerebral small vessel disease:from pathogenesis and clinical characteristics to therapeutic challenges[J]. Lancet Neurol, 2010, 9:689-701.
19 Caplan LR, Hennerici M. Impaired clearance of emboli (washout) is an important link between hypoperfusion, embolism, and ischemic stroke[J].Archi Neurol, 1998, 55:1475-1482.
20 Diehl RR. Cerebral autoregulation studies in clinical practice[J]. Eur J Ultrasound, 2002, 16:31-36.
21 Liu M, Wu B, Wang WZ, et al. Stroke in China:epidemiology, prevention, and management strategies[J]. Lancet Neurol, 2007, 6:456-464.
22 Wijnhoud AD, Franckena M, Van Der Lugt A, et al. Inadequate acoustical temporal bone window in patients with a transient ischemic attack or minor stroke:role of skull thickness and bone density[J].Ultrasound Med Biol, 2008, 34:923-929.
