嗜麦芽窄食单胞菌胞内具二硫键还原活性酶蛋白的研究
2015-01-21邹林源张铁鹰齐志国杜家菊王德山
■邹林源 张铁鹰 齐志国 杜家菊 王德山
(1.中国农业科学院北京畜牧兽医研究所动物营养学国家重点实验室,北京 100193;2.北京市畜牧总站,北京 100029)
羽毛粗蛋白含量可达85%,其中胱氨酸含量最高达4.65%,缬氨酸、亮氨酸和异亮氨酸的含量次之,维生素B12以及微量元素的含量也很高[1-2],且成本低廉,是较为廉价的一种蛋白质资源。但羽毛蛋白主要以角蛋白为主,结构稳定,难于被动物消化利用。羽毛等天然角蛋白除肽键外,在分子内和分子间存在二硫键、氢键、离子键(即盐式键)、配位键和范德华力等多种键能,三维构象高度交联、稳定。通常疏水基团暴露在外,亲水集团隐藏在角蛋白内部,疏水作用使角蛋白难溶于水。动物胃蛋白酶和胰蛋白酶很难将其水解、消化[3]。一些观点认为角蛋白酶可独自完成角蛋白的水解,也有一些观点认为角蛋白降解过程是由二硫键还原酶或还原剂启动,协助角蛋白酶来完成。有关角蛋白酶可单独完成角蛋白彻底水解的研究报道较少[4-5],大多角蛋白酶不能单独完成角蛋白的彻底水解过程[6-8]。一些研究表明,加快二硫键的还原可影响角蛋白的降解效率[9-12]。生长在羽毛介质中的弧菌kr2可产生巯基说明了存在二硫键被还原[13]。羽毛上Streptomyces pactum和Bacillus megaterium的生长过程中也均发现存在二硫键还原反应[14-15]。这说明二硫键还原可能是微生物降解角蛋白的关键步骤。研究表明,角蛋白降解菌胞外具有还原二硫键的酶活性低于胞内。谷胱甘肽还原酶属于二硫键还原酶类,具有二硫键还原酶活性。Serrano等(1984)[16]对蓝藻菌中的谷胱甘肽还原酶进行了分离纯化,发现纯化后的酶蛋白对氧化型谷胱甘肽的还原活力为249.2 U/mg,二硫键还原活性较高。本研究拟以具有较高二硫键还原活性的角蛋白降解菌Stenotrophomonas maltophilia为出发菌株,通过对其谷胱甘肽还原酶基因克隆和表达,获得重组谷胱甘肽还原酶,并对其二硫键还原酶活性、酶学性质和促进角蛋白酶水解羽毛角蛋白的效果等进行研究,探讨Stenotrophomonas maltophilia胞内液可明显促进胞外液水解角蛋白的机制。
1 材料与方法
1.1 实验材料
Stenotrophomonas maltophilia 10号菌为本实验室前期筛选保存野生菌株,大肠杆菌DH5α和BL21(DE3)为本实验保存感受态。角蛋白酶K由本实验室从地衣芽孢杆菌CP-16中克隆表达纯化得到[17]。
pMD19-T购自宝生物工程(大连)有限公司,pET-22b为本实验室保存。
DNA聚合酶(PrimeSTAR HS和LA Taq)、T4 DNA连接酶和DNA Marker均购自宝生物工程(大连)有限公司;不同酶切位点的限制性内切酶均购自NEB公司;细菌基因组提取试剂盒、质粒提取试剂盒和琼脂糖凝胶回收试剂盒均购自北京博迈德科技发展有限公司;镍柱纯化蛋白试剂盒以及Bradford蛋白浓度测定试剂盒均购自北京康为世纪公司。
1.2 实验方法
1.2.1 LB液体培养基及固体培养基参考王德山(2014)[17]的配制方法。
1.2.2 目的基因克隆
使用购自北京博迈德公司的细菌基因组提取试剂盒提取Stenotrophomonas maltophilia的基因组。
在 Uniprot(http://www.uniprot.org/)中搜集 Stenotrophomonas maltophilia中谷胱甘肽还原酶蛋白质序列,根据所得序列设计引物扩增全长基因,正反向引物分别引入NcoI、XhoI酶切位点,引物如下:
正向引物:CATGCCATGGCAAGCACTGCACC
反向引物:CCGCTCGAGGCGCATCAGCAC
PCR反应程序:预变性98℃ 1 min,变性94℃10 s,退火55 ℃ 15 s,延伸72℃ 2 min,共30个循环;总延伸72℃5 min。其中退火温度可根据不同引物的特点进行调整。扩增完成后用1%琼脂糖凝胶电泳检测扩增结果。
DNA酶切、连接和转化等分子操作技术参照王德山(2014)及购买试剂盒说明书。
将电泳验证后的PCR产物与载体pMD19-T连接,转化到大肠杆菌DH5α感受态细胞,蓝白斑筛选和菌落PCR验证后将阳性克隆测序。重组基因序列测定由北京博迈德公司完成。将测序结果进行BLAST比对分析并与目的基因MEGA比对检测是否有突变基因。
1.2.3 重组质粒的构建及转化
分别用NcoI、XhoI双酶切pMD19-T-Glr及表达载体pET-22b,纯化后于16℃连接过夜。将连接的重组质粒pET-22b-Glr转化BL21(DE3)感受态细胞。将筛选的阳性转化子经IPTG(0.2 M,30℃,4 h)诱导后,收集菌体,超声破碎(0.4 V电压)过Ni2+柱纯化。
1.2.4 重组蛋白SDS-PAGE分析
SDS-PAGE参照北京康为世纪公司试剂盒说明书,分离胶浓度10%,浓缩胶浓度5%。
1.2.5 二硫键还原酶活性和角蛋白酶活性测定
参照王德山(2014)的方法进行检测。蛋白浓度测定采用Bradford法。
1.2.6 重组谷胱甘肽还原酶酶学性质研究
1.2.6.1 最适酶促反应pH值的测定
分别以不同pH值缓冲液作为二硫键还原酶活性测定中的缓冲体系,检测酶的二硫键还原酶活性,将其中的最高酶活定义为100%,其他条件下的酶活以相对酶活表示,得到重组酶的最适反应pH值。不同pH值缓冲液采用:柠檬酸-Na2HPO4缓冲液(pH值3.0~8.0),甘氨酸-氢氧化钠缓冲液(0.2 M,pH值9~11.0)。
1.2.6.2 最适酶促反应温度测定
在不同温度条件下(30~70℃,温度间隔为5℃)检测酶的二硫键还原酶活性,将其中的最高酶活定义为100%,其他条件下酶活以相对酶活表示,得到重组酶的最适反应温度。
1.2.7 重组酶对角蛋白酶K降解羽毛角蛋白的研究
将重组酶稀释为pH值8.0二硫键还原酶酶活为0.04 U/ml,测定在pH值8.0,55℃条件下不同组合时的角蛋白酶活性。各酶间组合见表1。

表1 酶组合中不同酶添加体积比例
2 结果与分析
2.1 目的基因克隆
以Stenotrophomonas maltophilia基因组DNA为模板,扩增获得全长为1 359 bp的基因序列。将测序结果与GenBanK已知序列进行比对,结果表明所得序列为目的基因全长序列,该酶为。序列如下:


2.2 重组质粒的构建
将目的基因与质粒分别经NcoI、XhoI限制性内切酶双酶切后,连接并转化到大肠杆菌DH5α,将酶切鉴定正确的重组质粒转化到BL21(DE3),PCR鉴定得到连接正确的转化子。
2.3 目的基因在大肠杆菌中表达与鉴定
将鉴定正确的BL21(DE3)经IPTG诱导后,收集菌体,超声破碎过Ni2+柱纯化,检测二硫键还原酶活性为1.85 U/mg。SDS-PAGE分析发现,该重组酶分子量为48.8 kDa。

图1 重组酶SDS-PAGE分析
2.4 重组酶酶学性质研究
2.4.1 重组酶最适酶促反应pH值
分别以不同pH缓冲液为测定酶活性中的缓冲体系,检测二硫键还原酶活性,获得酶促反应最适pH值(见图2)。由图2可见,该重组酶最适反应pH值为6.0。该酶除了pH值5~8间,其他pH值下均保留不足20%的活性,该酶适宜pH值范围较窄,属于偏中性的还原酶。

图2 酶促反应最适pH值
2.4.2 重组酶最适酶促反应温度
重组酶最适反应温度测定结果如图3所示。由图3可以看出,该重组酶最适反应温度为40℃,在30~60℃之间该酶活性均能保持在50%以上,说明该酶的温度适应范围较宽,具有一定的耐温性。
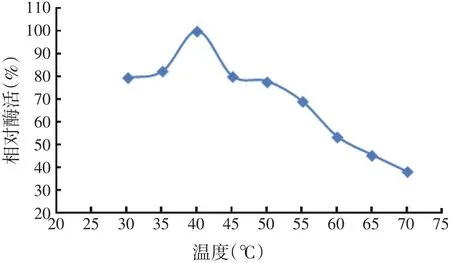
图3 最适酶促反应温度
2.5 重组酶对角蛋白酶K降解羽毛角蛋白的研究

表2 羽毛角蛋白降解结果
由表2可知,单独添加角蛋白酶K的羽毛角蛋白酶水解活性为65.6 U/ml,而单独添加重组谷胱甘肽还原酶的羽毛角蛋白酶水解活性为36.5 U/ml。同时添加2种酶后羽毛角蛋白酶活性升至117.8 U/ml。这表明该酶可以明显提高角蛋白酶降解羽毛角蛋白的活性,羽毛角蛋白活性比单独添加2种酶提高了15%。由此可见,角蛋白降解菌Stenotrophomonas maltophilia胞内液具有促进胞外液水解角蛋白活性可能是其胞内存在具有二硫键还原活性的酶蛋白。
3 讨论
羽毛主要由角蛋白(91%)组成,其表面角质层主要由高级脂肪酸和高级脂肪醇等脂类物质形成的动物蜡组成(1%)[18-19]。这些脂质与底层蛋白分子共价结合,疏水基外露,呈现出极强的疏水性。而与其他蛋白纤维相比,角蛋白半胱氨酸、谷氨酰胺、脯氨酸和丝氨酸含量高,其中约22%为疏水性,8.85%的半胱氨酸。角蛋白中半胱氨酸之间形成二硫键,从而使角蛋白的结构更稳定[20],常见蛋白酶并不能将其彻底水解,如胰蛋白酶、胃蛋白酶和木瓜蛋白酶等。然而,二硫键还原可显著影响角蛋白的降解,打开二硫键可能是水解角蛋白的关键步骤之一。
Yamamura等(2002)[21]从鹿皮毛中分离出角蛋白降解菌Stenotrophomonas sp.strain D-1可以分泌两种胞外蛋白:水解蛋白和二硫键还原蛋白。其生化特性显示这个蛋白酶属于丝氨酸蛋白酶,二硫键还原蛋白可能属于二硫键还原酶。这些酶的单体无角蛋白降解活性。然而,这两种酶的混合物对角蛋白的降解力比单个蛋白酶提高了50多倍,比蛋白酶K组合提高了2倍。此外,二硫键还原酶可提高Bacillus subtilis蛋白酶水解角蛋白的活性17倍,促进胰蛋白酶和蛋白酶K的水解活性也分别达6倍和2倍。Yamamura等(2002)角蛋白酶的活性也能被添加的β-ME、DTT和GSH等还原剂所激活,其可分别被提高约2.5倍、45倍和1.5倍,这表明还原性物质在角蛋白降解中也具有重要的作用。Rahayu等(2012)分离出的芽孢杆菌(Bacillus sp.MTS)可以有效分解鸡的羽毛。从该菌中纯化了胞外角蛋白降解酶和二硫键还原酶并检测了这些酶的酶学性质以及他们的协同作用。研究发现,无论与单体酶活性、蛋白酶K以及其他纯化后角蛋白酶活性相比,纯化角蛋白酶与纯化二硫键还原酶组合水解角蛋白底物(羽毛和羊毛)的酶活性均有较大提高。利用扫描电子显微镜观察了这2种酶在羽毛上具有相互协同作用。
本实验成功克隆并表达了Stenotrophomonas malto-philia中谷胱甘肽还原酶基因,虽然该酶二硫键还原酶的比活力仅为1.85 U/mg,但其角蛋白酶水解羽毛的效率提高15%。这也进一步证实了齐志国(2012)和Yamamura等(2002)报道的细菌胞内液具有促进胞外液角蛋白水解活性,且可能主要是一些具有二硫键还原活性的酶参与其中。本研究发现,该重组酶在30~60℃之间该酶的活性均能保持在50%以上,说明该酶的温度适应范围较宽,具备较好的工业应用前景。但适宜pH值范围较窄,需要后期通过基因改良等技术进一步改善这一不足。
4 结论
以上研究进一步说明,微生物高效降解角蛋白的过程并非由角蛋白酶独自完成,而是一个角蛋白酶和具有二硫键还原活性的多种酶共同参与的生物反应过程。本研究结果一方面揭示了Stenotrophomonas maltophilia胞内液具有促进胞外液角蛋白水解活性的内在机制,同时也为今后实现角蛋白生物酶解奠定了理论基础。
