红芪总多糖对衰老大鼠体内自由基清除及抗氧化能力的调节作用
2015-01-21雷丰丰岳淑琴孙礼刚张常青桑迎竹
雷丰丰,岳淑琴,孙礼刚,张常青,桑迎竹
(1甘肃省人民医院,兰州730000;2宁夏医科大学)
研究表明,衰老是由于自由基对细胞成分的进攻造成的结果,维持体内适当水平的抗氧化剂和自由基清除剂水平,可以延长寿命和推迟衰老。红芪总多糖(THPS)是从红芪中分离得到的总多糖,含有氨基酸、有机酸、B-谷甾醇红芪多糖、微量元素等多种生物活性物质[1,2],其性温味甘,具有补气固表、利尿解毒、排脓、敛疮生肌等作用,能增强和调节免疫功能[3~8]。2013年6~9月,我们观察了 THPS对衰老大鼠体内自由基清除及抗氧化能力的影响。
1 材料与方法
1.1 实验动物及分组 Wistar大鼠72只,体质量200~230 g,雌雄各半,由兰州大学实验动物中心提供。置于清洁级动物室中,对大鼠进行称重、编号,随机分为 A、B、C、D、E、F 组各12只。
1.2 THPS、试剂与仪器 THPS:为本研究所提取,甘肃武都产红芪,由兰州大学药学院封士兰教授鉴定,经水提、醇析、酶解及Sevag法除蛋白,紫外分光光度计280 nm检测无蛋白吸收峰为止,具体方法参照文献[9]。D-半乳糖;硫代巴比妥酸(TBA)。超氧阴离子)、超氧化物歧化酶(SOD)、羟自由基(OH-·)、谷胱甘肽过氧化物酶(GSH-PX)和丙二醛(MDA)试剂盒;其他均为国产分析纯试剂。752紫外可见分光光度计;TGL-40B离心机;DK-98-Ⅰ型电子恒温水浴箱;Imo-1型电动匀浆器;BL3100型(精确度0.1 g);BP221S 型(精确度0.1 mg)电子天平;超声波清洗器;旋涡混匀器。
1.3 衰老模型制备及THPS干预 D-半乳糖用生理盐水配成浓度为5%的注射液,A、B、C、D、E组大鼠腹部皮下注射D-半乳糖500 mg/(kg·d)制备衰老模型[10],F组大鼠腹部注射相同剂量的生理盐水,连续注射56 d。造模后第2天,A、B、C、D 组分别给予 50、100、200、400 mg/kg THPS,E、F 组给予10 mL/kg生理盐水,自由进食水,连续30 d。最后一次给药5 h后,以3%戊巴比妥钠腹腔注射麻醉,暴露腹部,下腔静脉取血,离心后取上清液作为待测血清。分离肝组织制成组织匀浆,离心后取上清液作为待测肝脏组织匀浆。
1.5 大鼠体内OH-·检测 采用Fenton反应体系。反应体系含0.15 mmol/L、pH 7.4 的 PBS 1.0 mL,40 μg/mL 番红花红 T 1.0 mL,3%H2O21.0 mL,0.954 mmol/L EDTA-Fe2+1.0 mL,再加入1.0 mL 不同质量浓度的供试液,混匀后于37℃保温30 min,然后于520 nm波长处测定A值。空白组以蒸馏水代替供试液,对照组以蒸馏水代替供试液和EDTA-Fe2+,同时设立试剂空白管,计算清除率,清除率=(A样品-A空白)/(A对照-A空白)×100%。
1.6 大鼠血清、肝组织SOD活性检测 采用黄嘌呤氧化酶法。绘制标准曲线后计算抑制率,根据抑制率和标准品的活性建立标准曲线和回归方程。SOD活性的测定按照试剂说明书进行。SOD活性=(试剂对照管吸光度-测定管吸光度)÷试剂对照管吸光度÷50%×反应体系的稀释倍数×样本测试前的稀释倍数。
1.7 大鼠血清、肝组织GSH-PX活性检测 利用GSH-PX可催化过氧化氢(H2O2)与还原型谷胱甘肽(GSH)反应生成水及氧化型谷胱甘肽的作用,因此GSH-PX活性可用其酶促反应的速度来表示。通过测定该酶促反应的还原型谷胱苷肽的消耗量就可求算酶活性。绘制标准曲线,建立回归方程。设立非酶管(试剂对照管)一支、酶管(测试管)的数目等于待测样本数目;按照试剂说明书进行血清及肝脏GSH活性的测定。GSH活性=(非酶管OD值-酶管OD值)÷(标准管OD值-空白管OD值)×标准管浓度(20 μmol/L)×稀释倍数×样本测试前稀释倍数。
1.8 大鼠血清、肝组织MDA含量检测 过氧化脂质降解产物中的MDA可与硫代巴比妥酸(TBA)缩合,形成红色产物,在532 nm波长处有最大吸收峰,从而根据吸光度的不同测定出待测样品中的MDA含量,即TBA法。设立标准管、标准空白管和测定空白管各1支,按照试剂说明书进行血清MDA的测定。MDA含量(nmol/mL)=(测定管吸光度-测定空白管吸光度)/(标准管吸光度-标准空白管吸光度)×10 nmol/mL×样品测试前的稀释倍数。
1.9 统计学方法 采用SPSS10.0统计软件。计量资料以±s表示,组间比较采用方差分析。P≤0.05为差异有统计学意义。
2 结果
2.1 各组大鼠一般情况比较 连续给予D-半乳糖6周后,E组大鼠行动迟缓,进食减少,毛色灰暗乱无光泽,形体瘦弱,体质量增加较慢,活动明显减少,抓取时可感觉到活动力相对较弱,易于抓取,反应迟钝,呈现明显的衰老体征。A、B、C、D组大鼠的食量、活动、毛色、体质量和反应能力明显好转;相比A、B、C组,D组大鼠毛发柔顺有光泽、反应灵敏、体质量增加较快、更喜欢活动。
表1 各组大鼠体内、OH- ·清除率比较(±s)

表1 各组大鼠体内、OH- ·清除率比较(±s)
注:与 E 组比较,*P <0.05。
组别 n O-·2清除率 OH-·清除率A 组 12 9.23%* 5.33%*B 组 12 10.67%* 17.21%*C 组 12 16.35%* 22.54%*D 组 12 21.83%* 26.64%*E组 12 - -F组12 - -
2.3 各组大鼠血清及肝脏MDA含量、SOD活性、GSH-PX活性比较 结果见表2。
3 讨论
自由基是人体正常的代谢产物,其来源于两方面,一是外源性自由基,二是内源性自由基,生理情况下机体通过线粒体呼吸链内氧化磷酸化途径、Ca2+依赖性的磷脂酶A2所激发的花生四烯酸代谢途径、黄嘌呤—黄嘌呤氧化酶途径、精氨酸-NO合成酶途径产生自由基。正常情况下人体内的自由基是处于不断产生与消除的动态平衡中。人体内存在少量的自由基不但对人体不构成威胁,而且还可以促进细胞杀灭细菌、消除炎症、分解毒物。但如果自由基的数量过多,就会破坏细胞结构,引起脂质过氧化,干扰人体的正常代谢活动,加速人体衰老进程[11]。本研究发现,不同剂量的 THPS对、OH-·均有清除作用,并且呈明显的量效关系,D组作用最强,说明大剂量的THPS对自由基抵御能力最强。文献[12~14]报道,自由基是衰老的决定性因素。结合上述报道,本实验间接提示THPS可能有抗衰老作用,THPS浓度越高,抗衰老作用越强。
表2 各组大鼠血清及肝组织MDA含量、SOD活性、GSH-PX活性比较(±s)
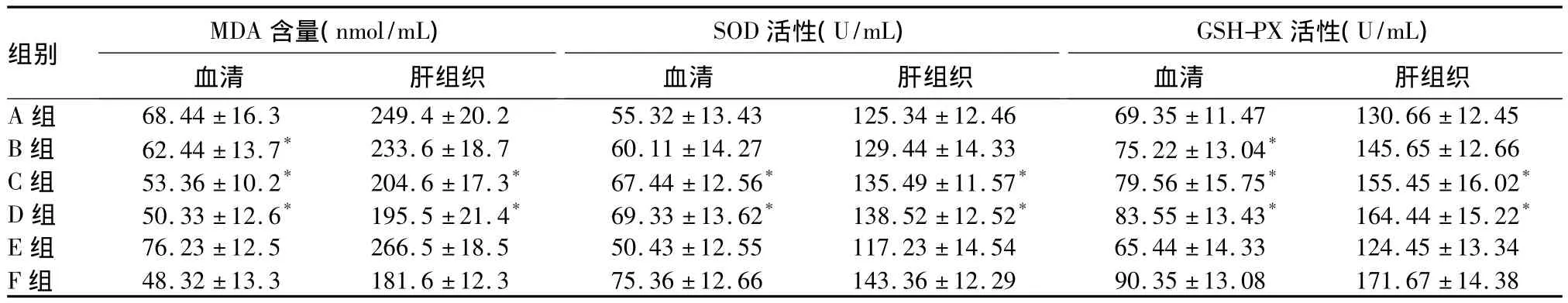
表2 各组大鼠血清及肝组织MDA含量、SOD活性、GSH-PX活性比较(±s)
注:与 E 组比较,*P <0.05。
组别MDA含量(nmol/mL)血清 肝组织SOD活性(U/mL)血清 肝组织GSH-PX活性(U/mL)血清 肝组织A 组 68.44 ±16.3 249.4 ±20.2 55.32 ±13.43 125.34 ±12.46 69.35 ±11.47 130.66 ±12.45 B 组 62.44 ±13.7* 233.6 ±18.7 60.11 ±14.27 129.44 ±14.33 75.22 ±13.04* 145.65 ±12.66 C 组 53.36 ±10.2* 204.6 ±17.3* 67.44 ±12.56* 135.49 ±11.57* 79.56 ±15.75* 155.45 ±16.02*D 组 50.33 ±12.6* 195.5 ±21.4* 69.33 ±13.62* 138.52 ±12.52* 83.55 ±13.43* 164.44 ±15.22*E 组 76.23 ±12.5 266.5 ±18.5 50.43 ±12.55 117.23 ±14.54 65.44 ±14.33 124.45 ±13.34 F 组 48.32 ±13.3 181.6 ±12.3 75.36 ±12.66 143.36 ±12.29 90.35 ±13.08 171.67 ±14.38
在正常情况下,细胞内氧化—抗氧化系统保持着动态平衡,当细胞内受到氧化损伤或氧化应激刺激这种平衡被打破后就会对机体造成损害,引发各种疾病和衰老。细胞膜脂质过氧化被认为是细胞内最主要的氧化损伤,MDA是细胞膜脂质过氧化的终产物之一,氧化损伤引起MDA生成量的增加,而MDA又可进一步激发细胞多方面的损伤。生物体内的抗氧化酶保护系统主要包括SOD、过氧化氢酶、CSH-PX等。抗氧化酶系统是机体内源性的自由基清除剂,SOD和GSH-PX均是重要的抗氧化酶,他们在清除自由基、预防延缓衰老方面有重要的作用。本研究发现,THPS可提高大鼠血清和肝组织SOD、GHS-Px均有升高作用,同时也能降低模型动物血清和肝组织自由基代谢的主要产物MDA的作用,并且以上作用具有剂量依赖性,由此推测THPS具有抗氧化作用,其不但能减轻脂质过氧化物对组织或细胞的损伤,而且还能增加机体对自由基损伤的防御机能,THPS剂量越大,抗氧化能力越强。
[1]潘竞先,刘薇,卫东,等.红芪化学成分的研究[J].北京医学院学报,1984,16(3):248-250.
[2]扬智,刘静明,王伏华,等.中药红芪的化学成分研究[J].中国中药杂志,1992,17(10):615-616.
[3]石玉城,冯晓军,白惠卿,等.红芪及单体对活化巨噬细胞吞噬功能的影响[J].贵阳中医学院学报,1986,8(4):60-61.
[4]兰中芬,张兆林,程国权,等.红芪多糖成分的分析及小鼠免疫功能与移植性肿瘤的作用[J].中国药理学报,1987,8(3):275.
[5]毛小娟,王志军,王凤莲.红芪多糖和黄芪多糖的免疫调节作用[J].中国药理学通报,1989,5(6):367-372.
[6]毛小娟,王志军,王凤莲.红芪多糖和黄芪多糖对小鼠体液免疫功能的影响[J].中国免疫学杂志,1988,4(3):158-161.
[7]孙启祥,郑云霞,苏菊萍,等.红芪多糖对小鼠细胞免疫的影响[J].甘肃中医学院学报,1994,11(2):41-42.
[8]王玮,尤崇革,王裕,等.红芪总皂甙对小鼠免疫功能的增强作用及其与CaM水平相关性[J].兰州大学学报(自然科学版),2000,36(5):109.
[9]雷丰丰,赵健雄,王学习,等.红芪总多糖诱导S180细胞凋亡的实验研究[J].中成药,2008,30(7):961-964.
[10]王少康,孙桂菊,张建新,等.亚急性衰老动物模型的建立及评价[J].东南大学学报(医学版),2002,21(3):217-220.
[11]Marx JL.Oxygen free radicals linked to many diseases[J].Science,1987,235(7):529-531.
[12]陈奇.中药药理研究方法学[M].北京:人民卫生出版社,1993:931-941.
[13]Stadman ER.Protein oxidation and aging[J].Science,1992,257(5074):1220-1224.
[14]Rice-Evans CA,Burdon R.Free radical-lipid interactions and their pathological consequences[J].Prog Lipid Res,1993,32(1):71-110.
