抗菌肽菌丝霉素成膜剂制备及其应用
2015-01-21杨静美刘橼利代珍青逯佩凤周玉岩
■叶 滔 杨静美 闫 凯 刘橼利 代珍青 逯佩凤 周玉岩
(1.广东海纳川生物科技股份有限公司,广东佛山 528515;2.仲恺农业工程学院,广东广州 510225)
抗菌肽(antibacterial peptides)又称抗微生物肽(antimicrobial peptides,AMPs),是多种生物产生具有天然免疫反应的生物活性分子,通过入侵病原微生物发挥细胞宿主防御作用[1]。抗菌肽具有广谱抗菌活性、低毒和低耐药性,同时作为高等生物免疫调节剂被认为是一种未来具有前途和潜在的候选药物,属于环保型抗生素[2]。除抗微生物活性功能外,抗菌肽还作为药物传递载体、抗肿瘤剂、促有丝分裂剂、避孕剂、信号转导分子以及饲料添加剂[3]。
菌丝霉素(Plectasin)是Mygind等研究小组于2005年通过筛查腐生子囊菌(Pseudoplectania nigrella)分泌蛋白的cDNA库,从中找出一些与无脊柱动物防御素序列高度相似的片段,并筛选分离出来的首例真菌防御素[4]。目前,抗菌肽类防御素研究进展一直缓慢,其主要障碍就是它们在大规模生产时成本过于高昂。而Plectasin的发现打破了一直局限在高等生物如哺乳动物、昆虫和植物中分离防御素的现状,将防御素的来源拓展到具有广阔开发前景的低等生物真菌中,从真菌中提取防御素获得成功,必将大幅降低防御素类抗菌药物的研究和生产成本,从而加速这类新型抗菌药物的开发和应用具有重要意义[5]。抗菌肽具有广泛的应用前景,但是由于它自身的特点,与其他辅料混合、造粒过程中容易受多种微量元素、酸碱、外源蛋白酶的影响极大,同时造粒过程瞬时高温也会影响其生物活性;另外,抗菌肽易溶于水,大大降低其预防和治疗活性。
为了更好地提高抗菌肽菌丝霉素的稳定性,同时利用现有的多肽制备技术将其制成肠溶包衣制剂、胶囊、微丸、微乳、脂质体、微粒、纳米粒等剂型,但是微乳、复乳制剂在包封率与稳定性方面较差,无法满足抗菌肽的包封需求;而脂质体由于用药量大、包封率低、稳定性差等缺点,不能满足抗菌肽制剂的制备要求;而肠溶包衣制剂、微粒、微囊和纳米粒又存在制备工艺复杂,成本较高,难以实现大规模化生产已及不适合抗菌肽制剂的制备[6]。因此,本研究旨在研制一种抗菌肽菌丝霉素成膜剂,以及对该成膜剂膜性能进行研究,解决现有抗菌肽制剂制备方法包封率低、稳定性差及成本高的问题,为此类兽药制剂的研究提供依据。
1 材料与方法
1.1 试验材料
BMGY培养基:酵母提取物10 g、蛋白胨20 g,定容至700 ml,121℃高压蒸汽灭菌20 min后,添加灭菌的10%甘油100 ml,13.4%无氨基酸酵母氮源(YNB)100 ml,0.02%生物素2 ml,1 mol/l磷酸缓冲液(pH值6.0)100 ml。
BMMY培养基:酵母提取物10 g、蛋白胨20 g,定容至700 ml,121℃高压蒸汽灭菌20 min后,添加灭菌的5%甲醇100 ml,13.4%无氨基酸酵母氮源(YNB)100 ml,0.02%生物素 2 ml、1 mol/l、磷酸缓冲液(pH值6.0)100 ml。
羧甲基纤维素钠(CMC-Na)、95%乙醇购自国药集团化学试剂有限公司;Tween-80购自上海圆创生物科技有限公司;荧光素钠、氮酮(Azone)、聚乙烯醇(PVA)均购自国药集团化学试剂有限公司;无水氯化钙(CaCl2)、NaNO2购自天津市永大化学试剂有限公司;甘油购自国药集团化学试剂有限公司。
1.2 方法
1.2.1 重组抗菌肽Plectasin的酵母表达[7]
将重组抗菌肽Plectasin酵母阳性转化子接种于含 BMGY(含 Zeocin 500 μg/ml)培养基的试管中,30℃、220 r/min摇床培养24 h。将部分菌液转移至BMMY诱导培养基中,30℃、220 r/min继续培养,每24 h补加1%的含量100%甲醇。共培养120 h。
1.2.2 成膜剂组方的优化
PVA剂量筛选:称取PVA重量为0、1、2、3、4、5 g共6组,分别加入100 ml菌丝霉素溶液充分搅拌,使其充分溶胀48 h,然后95℃恒温水浴使其充分溶解,将溶液用40目钢筛过滤。每组取3次,每次取2 ml溶液,均匀涂抹在3×4 cm2兔腹部,记录每组成膜时间与外观质量进行评估。设PVA的最适浓度为A。
Tween-80剂量选择:选取PVA最适浓度A,按照成膜剂配方方法,采用单因素方法对成膜时间及外观质量影响进行检测。选取Tween-80不同用量范围,取最适范围。量取含PVA浓度为A的菌丝霉素溶液3组(每组50ml),依次加入0.5、0.75、1.0 ml的Tween-80,40℃水浴搅匀,静置常温,然后加入4.33 ml Azone,搅匀即可。取2 ml混合液均匀涂抹于3×4 cm2兔腹部,评估每组成膜时间与外观质量。选取Tween-80用量为B ml,再量取含PVA菌丝霉素溶液分为四组,每组50 ml,依次加入Tween-80(B-0.10)ml、(B-0.05)ml、(B+0.05)ml和(B+0.10)ml,处理方法同上,评估每组成膜时间与外观质量,选最好组Tween-80用量为C ml。
甘油剂量选择:选取PVA最适浓度A的菌丝霉素溶液5组(每组100 ml),依次加入Tween-80 C ml,40 ℃水浴搅匀,再依次加入0、2.5、5、7.5、10 ml的甘油,然后放入40℃水浴搅匀,静置至常温,加入4.33 ml Azone,搅匀即可。取2 ml混合溶液,均匀涂抹于3×4 cm2兔腹部,评估每组成膜时间与外观质量。选取甘油的用量为D ml,取含PVA的菌丝霉素溶液分为4组(每组50 ml),将其依次加入Tween-80 C ml,放置40 ℃水浴搅匀,再依次加入甘油(D-1.0)、(D-2.0)、(D-3.0)ml和(D-4.0)ml,处理同上,评估每组成膜时间与外观质量。选最好组甘油用量为E ml。
CMC-Na剂量筛选:一般CMC-Na的浓度在1%~2%之间时作为凝胶剂。由上述PVP、Tween-80、甘油剂量选择试验得出的试验结果配制5组溶液(每组50 ml),将其放入55℃水浴锅中预热,分别加入1.0%、1.1%、1.2%、1.3%、1.4%、1.5%、1.6%、1.7%、1.8%、1.9%和2.0%的CMC-Na并用无水乙醇浸润,搅拌至充分溶解。取2 ml溶液,均匀涂抹于3×4 cm2兔腹部,评估每组成膜时间与外观质量。选最好组CMC-Na剂量Fml。
正交试验选择最佳配方:选取L9(34)正交试验,将成膜时间与外观质量作为评价。对Tween-80、甘油和CMC-Na三个因素进行正交试验因素与水平筛选(见表1),按正交试验选取最佳剂量。
1.2.3 膜剂性能研究
膜剂黏附力试验:黏附力的大小决定了药物的吸收,以及药物的作用时间[8]。根据正交试验筛选的最佳组合,配制3组菌丝霉素成膜剂,每组试验重复3次,分别将9组药液均匀涂在3×4 cm2兔腹部。其中待成膜完全后,将靠近兔腹内侧一端膜掀起大约0.5 cm,用夹子夹住下方,夹子上系一塑料袋,用橡胶导管向塑料袋中匀速滴加水,直到膜破裂为止,记录水的重量。

表1 正交试验因素与水平筛选
膜剂透气性试验:将菌丝霉素成膜剂均匀涂抹在6×6 cm2兔腹部,待成膜完全后,整张取下,选取膜(厚度为0.1~0.2 μm)进行试验。将5 g无水CaCl2放入透气装置中,用药膜将瓶口密封(瓶内含饱和NaNO2溶液),放入RH≥65%,37℃的恒温箱中。每小时记录1次称量。其中透气装置的重量(g)将随时间变化,反映出水蒸气在药膜表面的透过率。以质量变化与时间的关系求出斜率,并根据Q公式求出薄膜的透气量:Q=(S/A)[g/(h·m2)]。式中:S为直线的斜率,A为试样的测试面积。
线性关系的考察:将蛋白标准品用蒸馏水稀释,分别配制浓度为0、1.67、3.34、5.01、6.68、10.02、13.36 μg/ml和 16.7 μg/ml溶液。测定吸收值 A595nm,以吸收值为纵坐标,蛋白标准品浓度(μg/ml)为横坐标绘制标准曲线。
膜剂释药性试验:用生理盐水填充皮下内环境,将释药装置放入37℃水浴锅中,在兔皮表面3×4 cm2面积上均匀涂2 ml药液,每隔0.5 h在取药口吸取5 ml液体,再用5 ml生理盐水补充。将吸出溶液注入比色皿中,于λ=595 nm处进行紫外扫描,根据试验线性方程计算释药浓度。
1.2.4 药物的皮肤、黏膜刺激性试验
1.2.4.1 皮肤刺激性试验
选取月龄3~4个月的健康兔子12只,雌、雄各半,用脱毛器将兔子背腹部进行脱毛。然后将兔子随机分为2组,每组6只。其中,完整性皮肤刺激试验:将兔子背部两侧脱毛;损伤性皮肤刺激试验:将兔子背部两侧脱毛,进行皮肤消毒后,用无菌注射器针头呈“#”字形划破左右两侧皮肤,使皮肤出现渗血,破损区面积3×3 cm2,划痕间距0.5 cm。在家兔右侧脱毛区每隔12 h给药一次,每次1 ml,每次给药均匀覆盖。左侧喷生理盐水1 ml为阴性对照。
①单次给药试验:首次给药12 h后去除药物,肉眼观察30~60 min、24 h、48 h和72 h涂敷部位有无红斑和水肿等情况。
②多次给药试验:每次去除药物后1 h及再次贴敷前观察涂敷部位是否有红斑、水肿、色素沉着、出血点、皮肤粗糙或皮肤菲薄情况及其发生和消退时间。连续用药7 d,末次贴敷后,在去除药物后30~60 min、24 h、48 h和72 h肉眼观察涂敷部位有无红斑和水肿等情况。
1.2.4.2 黏膜刺激性试验
首选家兔6只,随机分为2组,每组3只。试验前24 h内对每只动物的双眼进行检查(使用荧光素钠检查)。有眼睛刺激症状、角膜缺陷和结膜损伤的动物不能用于试验。试验采用同体左右侧自身对比法。试验组每只眼睛上100 mg的防止奶牛乳房炎菌丝霉素成膜剂,然后轻合眼睑约10 s,不需冲洗眼睛;对照组每只眼睛滴入同剂量的生理盐水。
单次给药眼刺激试验,在给药后1、2、4、24、48 h和72 h对眼部进行检查,也可根据受试物的特点适当调整观察时间。
1.2.5 临床应用试验
试验动物与分组:选取年龄4~6岁、产后3~5个月的奶牛,采用CMT法筛选20头健康奶牛和20头隐性乳房炎奶牛进行试验。治疗组:隐形性奶牛乳房炎20头,分为两组,试验组10头用试验药物,对照组10头用乳宝Ⅰ号;预防组:健康奶牛20头,分为两组,试验组10头用试验药物,对照组10头用乳宝Ⅰ号。
试验药物:防治奶牛乳房炎菌丝霉素成膜剂;乳宝Ⅰ号,西安汉隆化工科技有限公司(批号120415),5 L/桶。
治疗方案:治疗组和预防组在用药前先用温水清洗病牛乳区,用干毛巾擦干后,每个乳区涂抹防治奶牛乳房炎成膜剂5 g左右,2次/d,7 d为一个疗程。对照组用乳宝一号药浴,2次/d,7 d为一个疗程。分别在0、3、5、7 d采乳样,对乳样进行全乳分析。最后根据体细胞数计算奶牛隐性乳房炎治愈率及奶牛乳房炎的预防率。
1.2.6 数据分析
试验数据利用SPSS17.0软件进行分析。
2 结果
2.1 成膜剂组方的优化
PVA剂量筛选:当PVA浓度为5%时,成膜性好。
Tween-80剂量选择:当Tween-80用量为0.7 ml,评价最高,Tween-80的最适用量范围为0.6~0.8 ml(按体积分数为1.4%~1.6%)。
甘油剂量选择:甘油用量为7.0 ml,评价最高,甘油的最适用量范围为6.0~8.0 ml(按体积分数为6%~8%)。
CMC-Na剂量筛选:CMC-Na的用量为2%,评价最高。即CMC-Na的最适用量范围按质量分数为1.9%~2.1%。
正交试验选择最佳配方:按照表1的方案选取L9(34)正交试验,将成膜时间与外观质量作为评价。对Tween-80、甘油和CMC-Na三个因素进行正交试验因素与水平筛选(见表2),按正交试验选取最佳剂量。
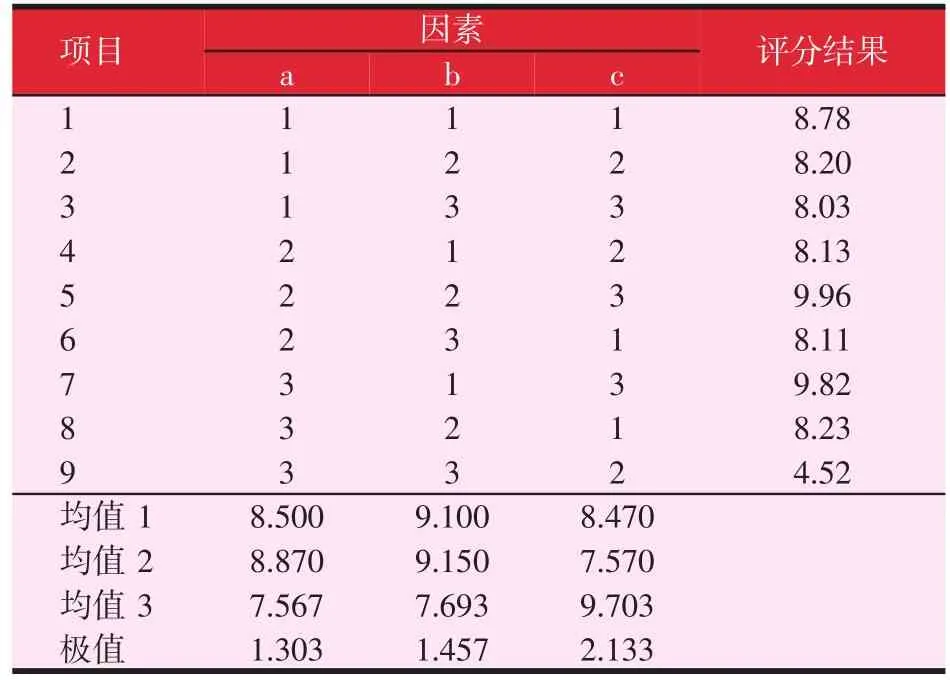
表2 正交试验结果
由表2结果显示:因素c的影响较大,因素b次之,各因素的最优组合初步确定为a2b2c3,即按体积分数比为甘油占7%、Tween-80占1.5%及CMC-Na占2.1%。
2.2 膜剂性能研究
膜剂黏附力试验:根据正交试验筛选的最佳组合,选取3组菌丝霉素成膜剂,分别将9组药液均匀涂布在3×4 cm2兔的腹部成膜,然后将靠近兔腹内侧一端膜折叠0.5 cm,用夹子夹一塑料袋并用橡胶管向塑料袋中匀速滴水,直至膜破裂为止,试验重复3次,记录重量。结果显示:该菌丝霉素成膜剂膜黏附力范围为153.41~230.36 g,即该药的吸收和作用时间都较长。
膜剂透气性试验:将菌丝霉素成膜剂均匀涂布于6×6 cm2兔腹部成膜,然后选取厚度0.1~0.2 μm的膜进行试验。将6 g无水CaCl2放入透气装置中,用药膜将瓶口密封置于(RH≥75%、37℃)恒温箱中,每小时称量1次。以质量变化与时间之间的关系求出斜率,并根据Q公式求出薄膜的透气量Q=(S/A)[g/(h·m2)],式中:S为直线的斜率;A为试样的测试面积。结果显示(见表3):以时间为横坐标,质量变化为纵坐标,所得标准曲线y=0.004 9x+0.000 1,R2=0.999 9,在0~4 h内具有良好的线性关系(见图1)。这说明透气装置随着时间重量发生变化的速率,反映了水蒸气在药物膜中的透过速率。
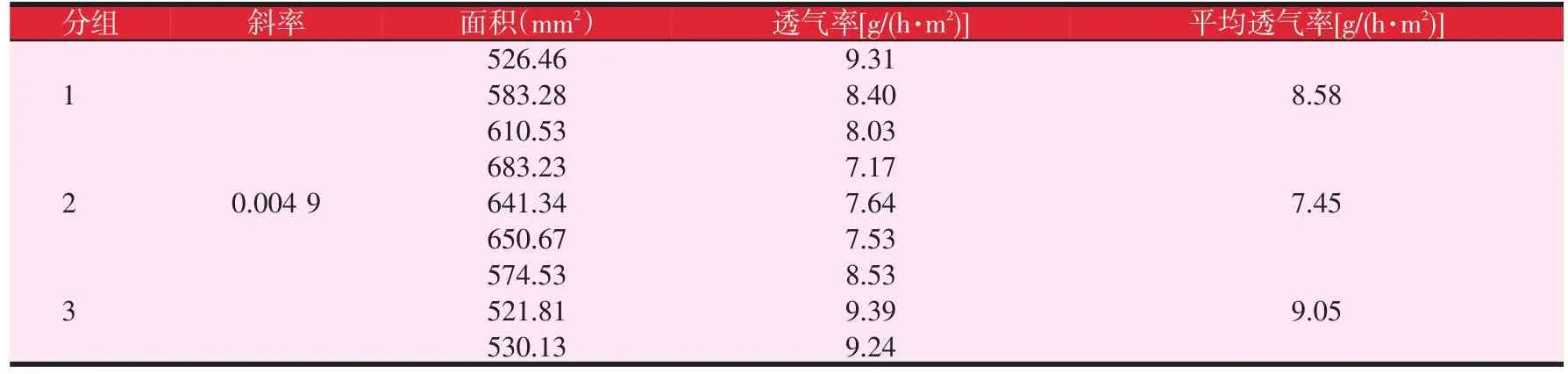
表3 透气性试验结果
根据线性回归方程得到直线斜率为0.004 9。由斜率与透气量的计算公式得出膜的透气率,由表3可知,膜剂的平均透气率范围7.45~9.05 g/(h·m2)。

图1 透气性试验质量变化与时间的关系
线性关系的考察:将牛血清蛋白标准品用蒸馏水稀释成浓度为10、20、30、40、60、80 μg/ml和100 μg/ml溶液。测定吸收值A595nm,以吸收值为纵坐标,蛋白标准品浓度为横坐标绘制标准曲线。试验结果显示:以蛋白浓度为横坐标,吸光值变化为纵坐标,所得标准曲线y=0.006 9x+0.041 9,R2=0.998 3,在10~100 μg/ml内具有良好的线性关系(见图2)。
膜剂释药试验:用生理盐水填充兔皮下内环境,然后将释药装置放置37℃水浴锅中,将2 ml药液均匀涂在兔皮3×4 cm2表面上,每隔1/2 h从取药口吸取5 ml液体,再用5 ml生理盐水补充。将吸出的液体注入石英比色皿中,测定吸光度A595nm,由试验(3)中线性方程计算膜剂的释药浓度。结果表明:膜剂释药量随时间逐渐递增,在300 min之后该膜剂释药量达到平衡(见图3)。

图2 吸光值与蛋白标准品浓度的标准曲线

图3 菌丝霉素成膜剂的释药曲线
2.3 药物皮肤、黏膜刺激试验
皮肤刺激试验(单次、多次给药试验),黏膜刺激性试验结果表明:通过单次和多次给药试验显示本药物对皮肤无刺激性。对黏膜无刺激,对眼有轻微的刺激。
2.4 膜剂临床应用试验
根据临床试验治疗方案,由CMT法筛选出治疗组隐性乳房炎阳性奶区共21个,用药7 d后共治愈11个乳区(据体细胞数的变化观察)。结果表明:其菌丝霉素成膜剂对奶牛隐性乳房炎初步治疗率达52.38%,对照组隐性乳房炎阳性奶区共25个,7 d后有35个乳区呈阳性;其中预防组在经过7 d的预防后,有2个乳区被感染,预防率可达到95%,而对照组在7 d之后有15个乳区被感染呈阳性。同时菌丝霉素成膜剂对单次产奶量、乳蛋白、乳糖、乳脂率及非脂固形物的影响均无显著性差异(见图4)。由此该成膜剂应用于奶牛隐性乳房炎有明显的预防效果。

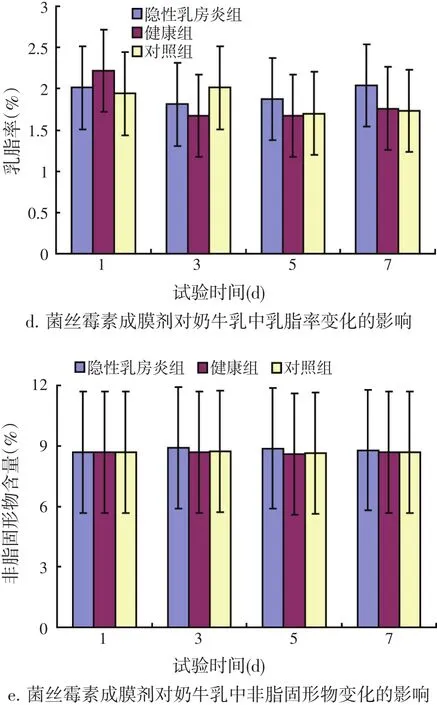
图4 菌丝霉素成膜剂对单次产奶量、乳蛋白、乳糖、乳脂率及非脂固形物变化的影响
3 讨论
自20世纪40年代以来,膜剂作为一种新的剂型已经迅速地发展起来,如工业、医药及食品等等[9]。目前,成膜剂的组方、工艺的选择及优化技术已发展很成熟,但在兽医药领域相关的膜剂研究比较少,对膜剂的质量标准定位还是模糊不清。其中,据2010年中国药典[10]对膜剂质量要求记载基本都是立足于药物自身,而无关于膜剂性能的研究质量标准,并且膜剂的性能不但影响药物的疗效,而且影响皮肤正常功能的发挥[11]。
抗菌肽是一种具有生物活性的小分子多肽,具有强碱、热稳定性及抗菌谱广等特点。目前,研究人员已从细菌、真菌、两栖类、昆虫、植物、哺乳动物乃至人体中发现并分离获得具有抗菌活性的多肽物质。由于这些多肽对细菌具有高效杀菌活性,因此被命名为“antibacterial peptides,ABP”。随着研究的进一步深入,人们发现某些抗菌肽对部分真菌、原虫、病毒及癌细胞等均具有杀伤作用。Plectasin也称为菌丝霉素,是由Hans-Henrik Kristensen课题组于2005年首次从Pseudoplectania nigrella的一种真菌中分离得到的。其中体外试验表明:Plectasin对于多种细菌具有很强的杀菌活性;而体内试验表明,在肺炎链球菌感染小鼠引起的腹膜炎和肺炎模型中,Plectasin的疗效分别与万古霉素和青霉素相当。此外,Plectasin具有选择性杀灭作用,安全性高。Plectasin与细菌细胞壁形成的前体物质LipidⅡ具有很强的亲和性,可以通过与LipidⅡ结合阻止病菌细胞壁的形成,从而阻止病菌繁殖。同时Plecta⁃sin独特的作用机制不易诱导产生耐药性菌株[12]。
奶牛乳房炎主要致病菌为金黄色葡萄球菌、链球菌和大肠杆菌,其发病率很高。目前治疗奶牛乳房炎已从最初采用抗生素治疗,转变为中药疗法,但是中药治疗奶牛乳房炎用量大、疗效慢,已不是最理想治疗方法。因此,寻找一种高效、安全的新药代替目前普遍使用的抗生素和中药是目前防治奶牛乳腺炎的重要手段,也是畜牧业研究与生产的热点问题。目前治疗奶牛乳腺炎的方法主要有:①中药提取物,如蒲公英、金银花、紫花地丁、连翘、没药等,但效果均不是非常理想;②疫苗,如奶牛乳房炎多联疫苗,对链球菌有一定的作用,大肠埃希菌J5苗,在控制杆菌性乳房炎有良好应用前景,但由于乳房炎病原菌的多样性,目前还没有非常合适的疫苗。
本试验以绿色环保药物抗菌肽菌丝霉素为研究对象,旨在解决现有抗菌肽制剂制备方法包封率低、稳定性差及成本高的问题,为抗菌肽新制剂的临床应用研究提供依据。其中在制备成膜剂的过程中,成膜材料首选聚乙烯醇(PVA),其性能具有很好的抗拉强度、柔软性、吸湿性和溶水性,并且无毒、无副作用,被广泛用于生物医用材料[13]。为了保证成膜剂膜的质量、稳定性及舒适性,还需向成膜材料中加入增塑剂(甘油)、表面活性剂(Tween-80)及抗氧化剂等添加剂。Schroeder等[14]通过试验证明溶液的抗拉强度、断裂伸长率等机械性能指标与皮肤的亲和力之间的相关性和水蒸汽透过性与体内外相关性都不好,由此本试验对膜剂性能研究以活体皮肤进行考察标准。该试验研究表明,其成膜剂不仅工艺简单,包封率高,稳定性好,成本低廉,可进行大规模化生产,而且还可以直接起到保护作用,迅速杀死细菌,防止炎症进一步感染,对感染有很好的治疗效果,并且该成膜剂中含有保湿剂成分,可吸收患处渗出液及水分,起到较好的保湿作用,对皮肤具有良好的亲和性和透气性。
