高产纤维素酶菌的筛选及鉴定
2015-01-21吴珊珊陈建军
■吴珊珊 赵 静 陈建军
(河南师范大学生命科学学院,河南新乡 453000)
纤维素是地球上最古老、最丰富的天然高分子,是人类最宝贵的天然可再生资源,已广泛应用于食品、动物饲料、洗涤等工业生产中。
纤维素是由葡萄糖组成的大分子多糖。不溶于水及一般有机溶剂,是植物细胞壁的主要成分。纤维素是自然界中分布最广、含量最多的一种多糖,占植物界碳含量的50%以上。棉花的纤维素含量接近100%,为天然的最纯纤维素来源。一般木材中,纤维素占40%~50%,还有10%~30%的半纤维素和20%~30%的木质素。对β-内切葡聚糖酶的克隆始于20世纪70年代。纤维素酶是水解纤维素生成纤维二糖及葡萄糖的一类酶的总称。纤维素酶并不是一种单一组分的酶,而是由许多高协同作用的水解酶组成的复合酶体系,根据其催化反应功能的不同可分为:内切葡聚糖酶、外切葡聚糖酶、β-葡萄糖苷酶。纤维素的完全水解,是这3种酶的协同作用,内切葡聚糖酶随机切割纤维素多糖链内部的无定型区,产生不同长度的寡糖和新链的末端。我国拥有丰富的纤维素资源,但因大量农业废弃物不能及时有效利用,造成了资源的浪费,同时也污染了环境。利用纤维素酶将其分解转化,可解决环境污染问题,有效实现农业废弃物的资源化利用。此外,合理利用纤维素资源,对开发饲料资源,生产生物能源,减轻人类对化石能源的消耗具有重大意义。
目前,农村中大量的纤维素利用率很低,如畜禽饲料中含有大量的纤维素,除某些反刍动物具有分解纤维素能力外,大部分畜禽不具备此能力。在青贮饲料中添加纤维素酶可使纤维素分解促进乳酸发酵。另外,添加纤维素酶后,由于纤维素被消化,乳酸发酵能力提高,贮存性能也提高。在饲料中添加纤维素酶后,饲喂幼鸡、仔猪及一般虚弱动物时,喂养效果明显;饲喂蛋鸡可提高产卵量;饲喂乳牛不仅可以使体重增加,而且提高产乳量。因此,在当地自然条件下筛选出纤维素酶高产菌株可以用于农村小规模形式的青贮饲料、畜粪处理,这样既可以提高纤维素的利用率以促进家畜养殖,也可以减轻农村中废弃植物体焚烧导致对大气的污染。从自然界中分离纯化纤维素酶高产菌株并测定各菌株的最适发酵时间可以提高纤维素酶的酶活力,进而提高纤维素的利用率,促进工农业的发展。
1 材料与方法
1.1 材料
1.1.1 原料
样品采自新乡市周边的稻秆堆积土壤、腐木堆积土壤,共12份,去除3 cm表层土后,取样于无菌三角瓶中。
1.1.2 培养基及培养条件
牛肉膏蛋白胨培养基:牛肉膏3.0 g、蛋白胨10.0 g、NaCl 5.0 g、琼脂20.0 g、蒸馏水1 000 ml,pH值7.0。
马铃薯固体培养基:马铃薯(去皮)200 g、葡萄糖20 g、琼脂15~20 g、蒸馏水1 000 ml,pH值自然。
马铃薯去皮,切成小块儿,煮沸30 min,然后用纱布过滤,再加糖及琼脂,用玻璃棒搅拌到全部溶解,再定容至1 000 ml。
平板分离培养基:羧甲基纤维素钠10.0 g、蛋白胨10.0 g、酵母粉 5.0 g、磷酸二氢钾1.0 g、MgSO4·7H2O 0.2 g、氯化钠 10.0 g、琼脂 20.0 g、蒸馏水 1 000 ml,115℃灭菌30 min,pH值自然。
改良细菌刚果红纤维素琼脂培养基:磷酸氢二钾0.5 g/l、(NH4)2SO42 g/l、MgSO4·7H2O 0.25 g/l、微晶纤维素粉1.88 g/l、刚果红0.2 g/l、琼脂18 g,pH值自然,121℃灭菌20 min。
1.1.3 样品材料的处理
首先经过加热干燥后,取5.0 g样品放入盛有95 ml无菌水的锥形瓶中,在27℃、200 r/min条件下充分振荡 30 min,摇匀,静置。
1.2 试验方法
1.2.1 产纤维素酶菌株的初筛
把土壤样品取5 g放入三角瓶中,加95 ml蒸馏水,加玻璃珠摇匀,取其上清液l ml加入到9 ml无菌水中,稀释成10-1、10-2、10-3、10-4、10-5、10-6的浓度梯度,然后通过常规的稀释法或划线法接种涂布于纤维素平板分离培养基之上,30℃恒温培养1 d,菌落计数,然后挑选菌落形态差异比较明显的菌落,重复划线接种于相应的琼脂平板上,直至纯化得到单菌落,然后转接于相应的琼脂斜面上,以备后用。
把培养出来的菌株,分别接种到刚果红培养基上,保持对应关系,进行培养。若菌株产纤维素酶,则会在菌落周围出现清晰的透明圈,依据透明圈直径的大小选择产酶菌株。用游标卡尺测量菌落周围水解透明圈的直径和菌落直径,并以两者的比值大小作为初步判断分解能力的指标,将比值较大的菌落挑取到选择培养基上培养,作进一步产酶水平的测定和纤维素酶高产菌株的筛选。
1.2.2 菌株的纯化
对上一步初选出的能产纤维素酶的菌在牛肉膏蛋白胨平板上进行划线分离,得到纯化的菌株。
1.2.3 菌株的复筛
对纯化好的菌株在各平板培养基上点种,同初筛的方法进行复筛菌株,选择生长速度快、比值较大并且相对稳定的菌株。
1.2.4 刚果红纤维素琼脂培养基观察水解圈大小
用点接的方法把各个菌株接于刚果红纤维素琼脂培养基中,30℃培养48 h,观察水解圈大小。
1.2.5 显微镜形态学观察
先在载玻片上滴加一滴生理盐水,把菌落用接种环挑起后,涂于生理盐水中央直径1 cm左右,混匀,把载玻片放在酒精灯上来回加热烘干固片,然后滴加草酸铵结晶紫染色60 s,水洗,再加革兰氏碘液覆盖60 s,用95%酒精脱色30 s,水洗,最后用番红复染2 min,干燥,镜检。
1.2.6 菌株的鉴定
形态鉴定:在平板上挑菌体少许,涂于载玻片上,置于显微镜下观察。16SrRNA鉴定:用细菌通用引物进行16SrDNA PCR扩增。PCR反应体系(25μl)为Ex Taq 0.25 μl,10×buffer 2.5 μl,dNTPs 2 μl,引物(上游引物:AGAGTTTGATCCTGGCTCAG;下游引物:GGTTACCTTGTTACGACTT)各0.3 μl,DNA 模板0.5 μl,ddH2O 19μl。PCR反应条件:94℃ 3 min;94℃ 30 s,55℃ 30 s,72℃ 30 s,35个循环;72℃ 5 min。真菌扩增通用引物(上游引物ATTGGAGGGCAAGTCTGGTG,下游引物 CCGATCCCTAGTCGGCATAG)进行PCR扩增,扩增产物经纯化后测序,测得的序列在NCBI中用BLAST进行序列比对。
1.2.7 CMC酶活力测定
酶活力测定方法:①绘制葡萄糖标准曲线。按照张龙翔的方法测定并绘制标准曲线。②粗酶液的制备:取发酵液于4℃ 、5 000 r/min离心10 min,得上清液。③DNS法测酶活力:取4支带有20 ml刻度的试管,1支做空白对照,3支做平行样品管,每支试管中加1 ml酶溶液,样品管置于50℃水浴锅中预热2 min,对照管置于沸水浴10 min,然后在4支试管中加入4 ml已预热至50℃的1%羧甲基纤维素钠为底物的溶液,样品管置于50℃水浴准确计时5 min取出。每管立即加入1 ml 2 mol/l氢氧化钠溶液和2 ml DNS显色液,摇匀后样品管与对照管都置于沸水浴准确计时3 min取出,流水迅速冷却,并用蒸馏水定容20 ml,摇匀后用分光光度计于485 nm处测定吸光度值。在上述条件下定义为1 min产生1μg葡萄糖为1个酶活单位。
1.2.8 革兰氏染色
①涂片固定;②草酸铵结晶紫染1 min;③自来水冲洗;④加碘液覆盖涂面染约1 min;⑤水洗,用吸水纸吸去水分;⑥加95%酒精数滴,并轻轻摇动进行脱色,20 s后水洗,吸去水分;⑦蕃红染色液(稀)染色1 min后,自来水冲洗。干燥,镜检。
1.2.9 代谢指纹分析
将筛选出来的6株菌株做一系列生理生化指标的测定。如:淀粉水解试验,甲基红试验,过氧化氢酶试验,V-P试验,乳糖、葡萄糖、蔗糖的利用试验。以上鉴定方法均参照文献陈金春微生物试验教程。
1.2.10 发酵条件的研究
以筛选出来的最大酶活力的菌株作为研究对象,用麸皮作为固态发酵的原料,在固态发酵培养条件的基础上分别单独改变上述3个参数其中之一,其他参数不变。发酵温度设26、28、30、32、34、36 ℃ 6个水平,发酵时间设12、24、36、48、60、72、84 h 7个水平,含水量设20.0%、30.0%、40.0%、50.0%、60.0%5个水平,每个水平设3组平行,研究上述3种参数变化对酶活力的影响。
2 结果与分析
2.1 产纤维素酶菌株的初筛
对纯化后获得的12株候选菌株利用刚果红水解圈试验进行了初步鉴定,结果如图1所示,其中6株菌水解圈要明显大于其他菌,通过测量水解圈直径,可以看到2、4、5、6、7、9、10、11、12号水解圈比较大,1、3、8号基本没有水解圈,其中2、5、9、10、11、12水解圈最大(见表1),这6株菌作为初筛候选菌株进行进一步的鉴定。
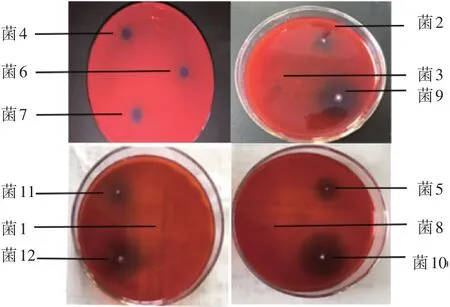
图1 刚果红染色水解圈大小的比较

表1 水解圈直径大小
2.2 候选菌株的形态学鉴定(见图2)
如图2所示,2号菌株菌体细胞呈杆状,无荚膜,菌落大,表面粗糙,扁平,不规则;5号菌株也是杆状,无荚膜,周生鞭毛,革兰氏阳性;9号菌株革兰氏染色呈阳性;10号菌株细胞形态和排列呈杆状,革兰氏阳性;11号菌株菌体微小,革兰氏阳性,呈杆状;12号菌株呈不定型棉絮状或致密丛束状,其菌落表面的颜色呈绿色。
2.3 指纹代谢分析(见表2)
从表2可以看出,候选菌株中,2、5、9、10、11、12号菌株淀粉水解试验为阳性,说明其可以分泌淀粉酶;6株菌过氧化氢酶试验均为阳性,说明它们都是具有过氧化氢酶的细菌,能催化过氧化氢生成水和新生态氧,继而形成分子氧出现气泡;甲基红试验中,5、10、11号菌株呈阳性,可以产酸;V-P试验中,2、5、9、10、11号菌株呈阳性,说明菌株中含有丙酮酸脱羧酶;6株菌株都能利用葡萄糖,说明葡萄糖可以作为其生长的碳源;除了2、5号菌株不能利用乳糖,12号菌株不能利用蔗糖,其他菌株均可以利用乳糖和蔗糖,那么,乳糖和蔗糖也可以作为它们生长的基质;除12号菌株外,其余菌株革兰氏染色均为阳性。
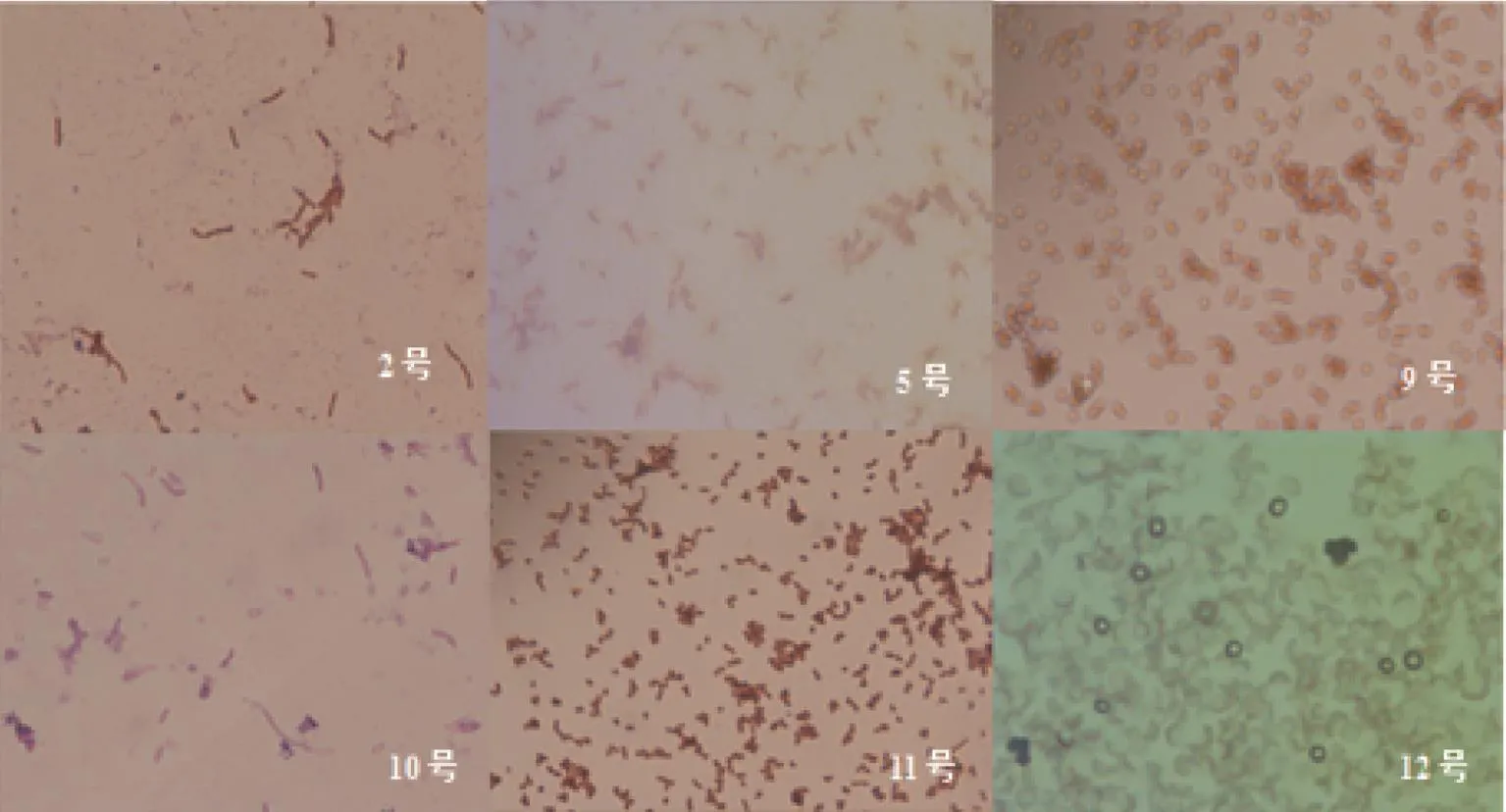
图2 各种菌株的油镜形态观察

表2 指纹代谢分析
2.4 电泳检测结果(见图3)

图3 电泳检测图
由图3可知,6种候选菌株片段大小均为1 500 bp左右,经回收后测序,测序结果经NCBI比对发现2号为蜡状芽孢杆菌(同源性达99%),5号为枯草芽孢杆菌(同源性达100%),9号为巨大芽孢杆菌(同源性达99%),10号为地衣芽孢杆菌(同源性达99%),11号均为微小杆菌(同源性达98%),12号为绿色木霉(同源性达98%)。
2.5 固态发酵后的酶活力
把2、5、9、10、11、12号这6株菌分别用于固态发酵,我们选择米糠和麦麸作为原料,结果如表3所示,6株菌发酵后的酶活力均极显著高于对照组。不管是用麸皮还是米糠,所有产酶菌株中地衣芽孢杆菌的酶活力均是最强的,故本研究将地衣芽孢杆菌作为产酶的候选菌株。

表3 不同菌株发酵后酶活力的大小
2.6 地衣芽孢杆菌发酵麸皮条件的优化
为了摸索候选菌株产酶的最优条件,我们以麸皮作为发酵原料,比较了温度、时间及含水量的变化对产酶的影响,结果如图4所示,当其他条件不变,发酵温度为30℃ 时(图4a),酶活力达到最大值,随着温度的增加,酶活力开始降低;而酶活力随发酵时间延长不断提高,但当发酵时间达到60 h后,酶活力达到最大值,此后随时间的延长酶活力逐渐降低(图4b);图4c则显示当其他条件不变,水分含量为40%时,酶活力处于最大值。因此,确定最适发酵条件为:温度30℃,初始水分含量40%,发酵时间60 h。

图4 不同培养条件对酶活力的影响
3 讨论与结论
徐昶等在高产纤维素酶菌株的筛选及产酶条件研究中报道了一株灰绿曲霉,其产纤维素酶的能力很高。此后,又有许多研究证实了这一结果。很多真菌都可以分解出产纤维素的酶,不过,真菌产生活性代谢产物的含量极低,同时真菌在多次传代后,生物特性退化,其代谢产物不稳定。本试验筛选分离出的目的菌是细菌,细菌易培养、易控制、生产成本低、生长快、不受原料的限制、发酵产物较单一、有效成分易分离,对工业化的生产有一定的推动作用,为用细菌产纤维素酶提供了新的思路。在以前的诸多报道中,筛选出来产纤维素酶的菌后,关于工业化生产的研究相对较少,而本研究中,用了麸皮和米糠两种纤维素含量丰富的原料,进行了产酶能力的比较,并最终选择麸皮作为基质,优化了培养条件,为以后试验菌株真正用于生产实践奠定了基础。
在本研究中,用刚果红染色观察水解圈的大小初步筛选出6株产酶能力强的菌株,对它们进一步进行形态学的鉴定、16SrDNA的测定以及产酶能力的测定,筛选出一株最优的目的菌,通过对试验菌发酵温度、时间及含水量的初步优化,获得其固态发酵的最优化条件为:培养温度30℃、培养时间60 h、水分含量40%。该结果与他人的报道相一致,如封晔等报道的米曲霉和黑曲霉的最优发酵温度是35℃,最优发酵时间是48 h,随着温度的增加,酶逐渐失活,酶活力也随之下降:随着时间的增加,次级代谢产物积累,酶活力也会降低;而本研究中,最优含水量是40%,如果水分过多,会影响培养基内部的透气性,使培养基内部散热难,也可能造成杂菌污染,导致酶活力降低。
本文筛选出一株酶活力高的地衣芽孢杆菌。据报道,地衣芽孢杆菌细胞形态和排列呈杆状、单生,可调整菌群失调达到治疗目的,可促使机体产生抗菌活性物质、杀灭致病菌。能产生抗活性物质,并具有独特的生物夺氧作用机制,能抑制致病菌的生长繁殖。地衣芽孢杆菌的良好特性正在被人们所广泛认识。在人们越来越关注食品安全的今天,地衣芽孢杆菌制剂作为新一代新饲料添加剂必将具有广阔的前景。
(参考文献17篇,刊略,需者可函索)
