用于海参饵料的一株海洋酵母鉴定与培养条件优化
2015-01-21周彦品荣芷铭赵长新
■赵 笛 周彦品 荣芷铭 杜 维 赵长新
(大连工业大学生物工程学院,辽宁大连 116034)
海参养殖是大连地区的一大特色产业,海参养殖方式多种多样,随着养殖规模不断扩大,其对饲料的要求越来越高,海参饲料研究越来越受到业内人士的关注[1]。然而,目前海参养殖存在饵料单一、营养不足、海参体质下降等问题[2],若过度投喂人工饲料又会带来水质恶化、海参生长环境遭到破坏的负面影响。而海洋红酵母具有繁殖速度快、色素积累快的特点,同时,菌体内由番茄红素为前体物质合成的虾青素具有提高幼苗的增重率和存活率的效果,是海参养殖中最佳的天然饵料[3]。近年来,国内已开始工业化试生产海洋红酵母饲料,并将其用于饲料添加剂中[4-6]。薛德林等[7]指出,在养殖水体中添加海洋红酵母能抑制弧菌增殖,降低海参的发病率,提高海参幼体的变态率和成活率,从而提高海参的产量。王岁楼[8]采用传统培养基进行培养条件优化,在一定程度上提高了菌体浓度,但是其虾青素含量没有得到提高,而且培养成本并未降低。鉴于此研究现状,本试验从大连渤海海域筛选出一种高产虾青素海洋红酵母,对其进行菌种纯化及鉴定,并优化其培养条件,旨在提高海洋红酵母菌的产量及质量,并希望借此推动辽宁省海参养殖业的快速发展。
1 材料与方法
1.1 菌种
酵母菌从大连渤海湾提取得到。
1.2 材料与仪器
1.2.1 材料
番茄红素(食品级),大麦(中粮麦芽大连有限公司),磷酸、葡萄糖、酵母粉、KH2PO4(均为分析纯)。
1.2.2 仪器
手提式不锈钢压力蒸汽灭菌器(上海三中医疗器械有限公司);高速冷冻离心机(赛默飞);WFEUV—2000型紫外可见分光光度计[龙尼柯(上海)仪器有限公司];E221型生物显微镜(麦克奥迪实业集团有限公司);HQ45恒温摇床,DYY-Ⅲ33B 型电泳槽,DY-W2型电泳仪,MJRe-search-PTC-200PCR仪。
1.3 试验方法
1.3.1 培养基
采用2Brix的麦汁培养基。
1.3.2 富集培养
培养方法参考杜连祥等(2010)[9]的方法。
1.3.3 菌种26SrDNA鉴定
1.3.3.1 变性
在斜面培养基中挑取菌体于50μl TaKaRa Lysis Buffer for Microorganism to Direct PCR(Code No.9164)中变性后离心取上清作为模板。反应条件为:80 ℃、15 min。
1.3.3.2 PCR扩增
使用TaKaRa Fungi Identification PCR Kit(Code No.9164),进行PCR扩增目的片段,扩增条件见表1。

表1 扩增条件
1.3.3.3 测序
将PCR产物经脱盐纯化后,由宝生物(大连)科技发展有限公司进行测序。
1.3.4 菌数计数
采用血球计数板计数法[6]。
1.3.5 海洋红酵母中虾青素含量的测定
采用杨文(1995)[10]的测定方法。
1.3.6 虾青素含量的计算
虾青素含量(μg/g干菌体)=A×D×V/0.16W。
式中:A——吸光度;
D——稀释倍数;
V——丙酮体积(ml);
W——细胞质量(g);
0.16——胡萝卜素摩尔消光系数。
1.3.7 海洋红酵母菌常规培养
培养基:葡萄糖0.8%、酵母粉0.5%、KH2PO40.05%。培养条件为150 r/min,初始pH值为6,温度为28℃,接种量10%进行摇床培养,在72 h后进行菌浓度和虾青素含量测定。
1.3.8 菌体制备过程中工艺参数优化
①分别在不同温度、接种量、摇瓶转速和初始pH值的条件下进行海洋红酵母的发酵培养,在培养72 h后,进行酵母菌数和虾青素含量的测定。
②经前期培养条件优化后,在不同时间向培养基中投放不同量的虾青素的前体物质番茄红素,并且摇瓶发酵72 h后,进行酵母菌数和虾青素含量的测定。
1.3.9 响应面试验设计
通过单因素试验发现,培养基初始pH值对海洋红酵母菌浓度和虾青素含量具有极大的影响,所以对初始pH值、番茄红素的添加量及添加时间以虾青素含量和菌浓度作为评定标准,采用响应面分析法对海洋红酵母的培养工艺进行优化。
2 结果与讨论
2.1 26SrDNA菌种鉴定结果
2.1.1 琼脂糖凝胶电泳结果见图1,在第一泳道可见预期大小片段,将该片段进行凝胶回收,送测序。
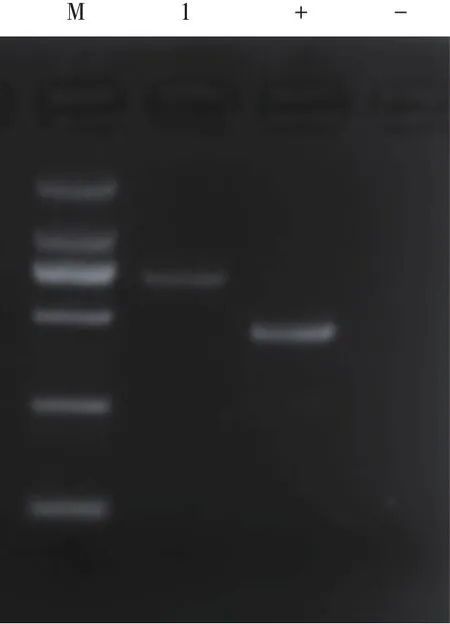
图1 琼脂糖凝胶电泳结果
2.1.2 测序结果
测序结果在NCBI上进行比对,确定该株海洋红酵母为Rhodosporidium diobovatum。
2.2 菌体培养条件优化结果
2.2.1 培养温度的优化(见图2)
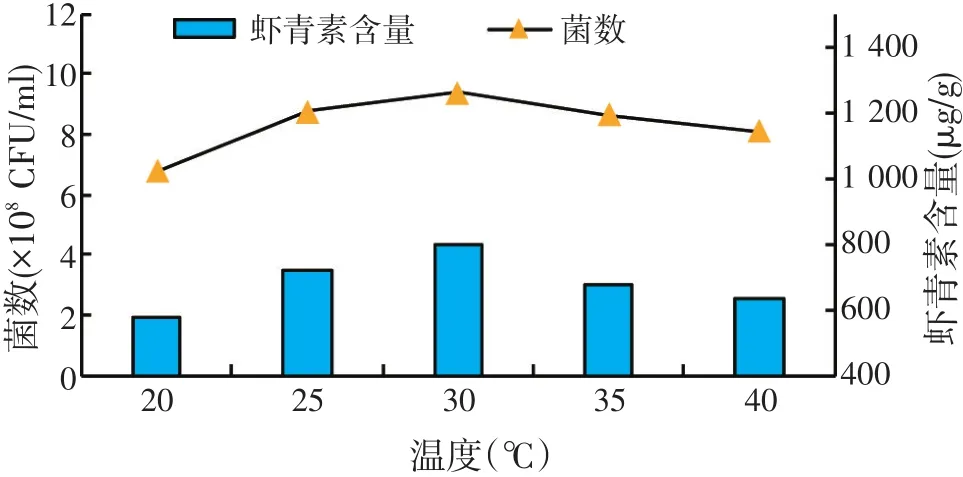
图2 温度对菌种发酵的影响
由图2可知,培养温度对菌浓度和虾青素含量的积累均有影响。菌浓度和虾青素含量先随温度升高而增加;当温度超过30℃后,随温度升高而降低。当温度为30℃时,菌浓度和虾青素含量均达到最大值,分别为9.38×108CFU/ml和798μg/g。因此,可以确定其最佳发酵温度为30℃,接下来试验均在30℃条件下进行发酵培养。
2.2.2 培养转速的优化(见图3)
由图3可知,转速为120~180 r/min时菌数和虾青素含量均不断的提升,当转速超过180 r/min的时候,虾青素含量和菌浓度均呈下降趋势,转速为180 r/min时菌数达到最大值为9.56×108CFU/ml,虾青素的含量也达到最大值,为886μg/g。因此,可以确定其最佳培养转速为180 r/min,后续试验均在180 r/min条件下进行发酵培养。
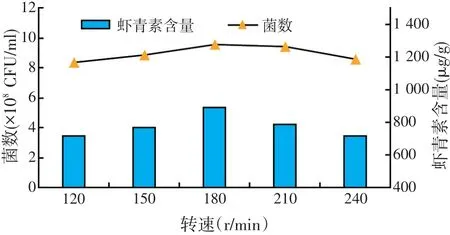
图3 转速对菌种发酵的影响
2.2.3 接种量的优化(见图4)
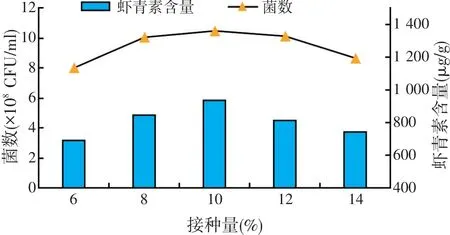
图4 接种量对菌种发酵的影响
结果表明,接种量从6%增加到10%时,菌数从7.98×108CFU/ml增加到 10.34×108CFU/ml,提高了29.6%。当接种量为10%时,其菌数表现出最高水平,为10.43×108CFU/ml。而当接种量超过10%时,其菌数表现出下降趋势,当接种量增加到14%时,其菌数降到8.64×108CFU/ml,较10%的条件时下降17.2%。并且当接种量为10%的时候,其虾青素的含量也达到最高值,为932μg/g,因此,进一步试验选择接种量为10%。
2.2.4 初始pH值的优化
选用磷酸缓冲液对培养基进行初始pH值的校定,不同初始pH值下菌浓度和虾青素含量测定结果如图5所示。开始,菌浓度和虾青素含量随着pH值的升高而逐渐上升,当pH值高于5.0时,随着pH值的上升,菌浓度和虾青素含量反而下降。pH值5.0时,菌数最高,为11.66×108CFU/ml,虾青素含量也达到最高值,为1 053μg/g,因此,进一步试验选择pH值为5.0。
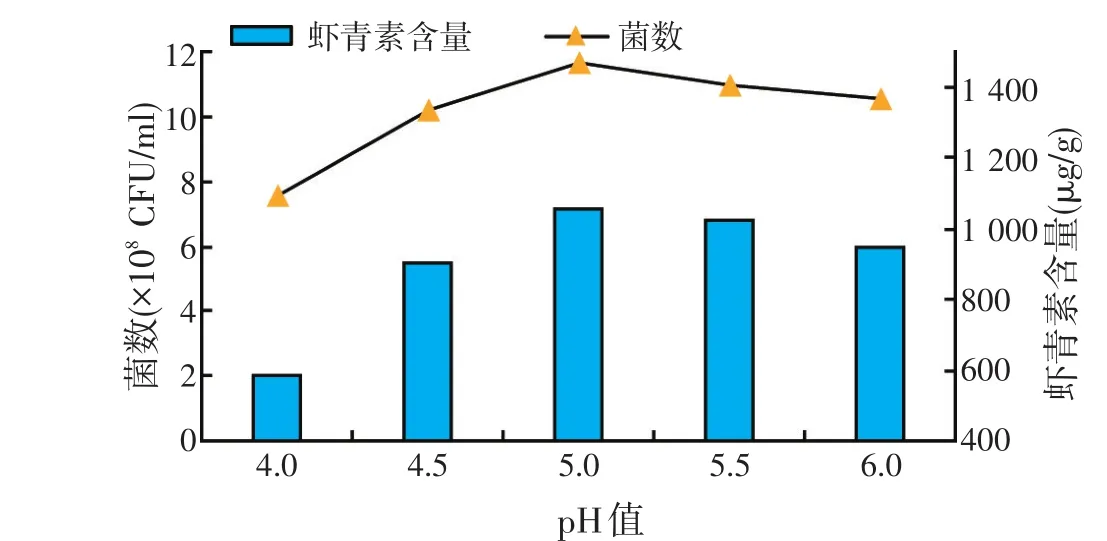
图5 初始pH值对菌种发酵的影响
2.2.5 添加番茄红素时间的优化(见图6)

图6 不同添加时间对菌种发酵的影响
在24 h前投放番茄红素时其菌浓度和虾青素含量均稳步上升,在24 h后投放番茄红素,菌浓度基本趋于平衡而虾青素含量呈下降趋势。在菌体发酵24 h时添加番茄红素,其虾青素的含量最高,达到1 412μg/g,菌浓度也达到最大值,为14.03×108CFU/ml,所以进一步试验选择在菌体发酵24 h时投放番茄红素。
2.2.6 番茄红素添加量的优化(见图7)
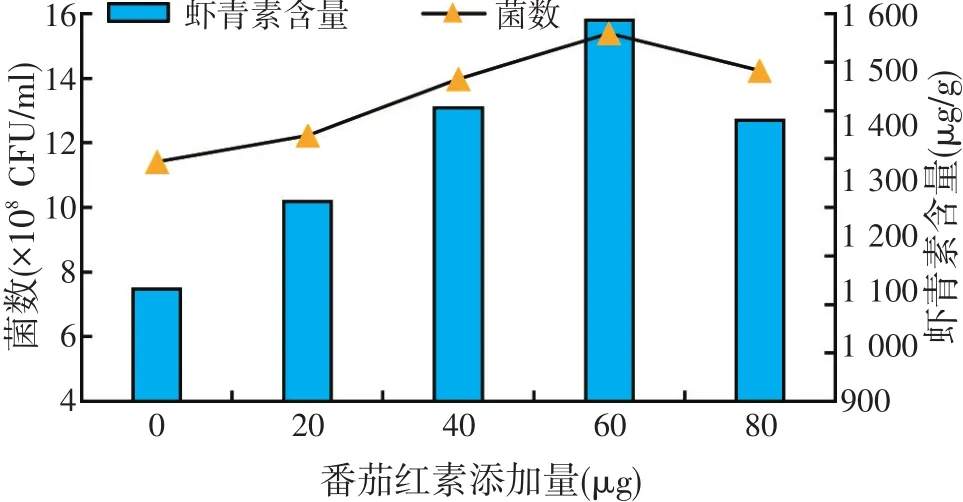
图7 不同添加量对菌种发酵的影响
由图7结果可知,番茄红素的添加量对菌数和虾青素含量的积累均具有很大影响。开始随着番茄红素投放量的增大其菌浓度和虾青素含量均上升,当投放量超过60μg时菌浓度和虾青素含量均呈下降趋势。当投放虾青素的量为60μg时,虾青素含量达到最大,为1 586μg/g,菌浓度也达到最大值,为15.38×108CFU/ml。所以确定番茄红素投放量为60μg。
2.2.7 响应面分析[11]
通过上述单因素试验发现,发酵的初始pH值、投放番茄红素的时间和质量对海洋红酵母的生长及虾青素含量的积累具有很大的影响,所以针对这三个试验因素,利用Design Expert 8.0软件,采用中心组合试验Box-Behnken设计方案,进行3因素3水平的响应曲面工艺优化试验。试验因素水平设计见表2。试验共设17个试验点,包括12个析因点和5个中心点,结果如表3所示。其中Y1为虾青素含量(μg/g),Y2为菌浓度(×108CFU/ml),A为添加量(μg),B为添加时间(h),C为初始pH值。
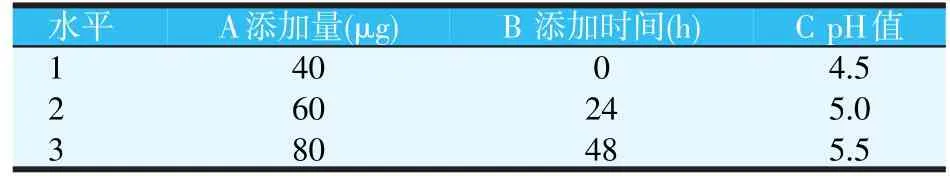
表2 Box-Behnken因素水平编码设计
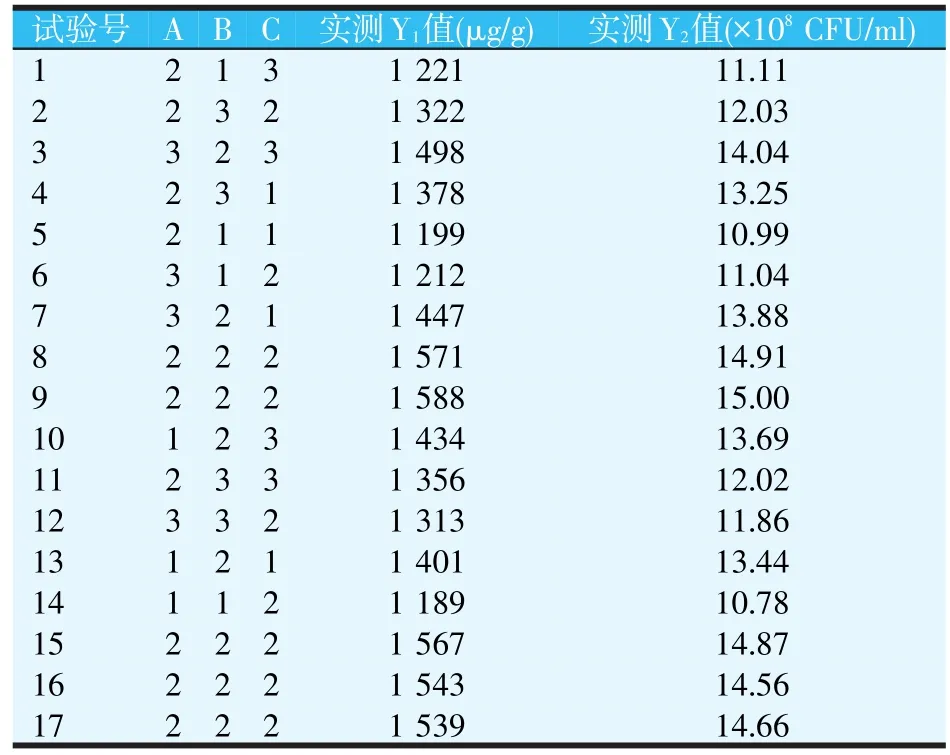
表3 Box-Behnken设计及结果
2.2.8 海洋红酵母菌发酵过程中虾青素含量的响应面回归模型方差分析(见表4)
由表4可知,模型的F值为53.36,其中P值<0.01,表明模型是显著的。在此模型中B、A2、B2、C2为显著项。总体上讲,模型的拟合程度很好、试验误差较小,模型成立,可以用此模型对海洋红酵母发酵条件进行分析。对表4中的结果进行回归拟合分析,可得海洋红酵母发酵过程中虾青素含量的二次回归方程为:Y1=1 561.6+15.50×A+68.5×B+10.50×C-8.00×AB+4.5×AC-11×BC-73.05×A2-229.55×B2-43.55×C2。
海洋红酵母发酵过程中各因素两两交互作用对虾青素含量的影响如图8所示。由图8可知,番茄红素添加时间和添加量的交互作用对虾青素积累影响最为明显,而发酵的初始pH值和添加量的交互作用对虾青素积累影响最小。

表4 海洋红酵母发酵过程中虾青素含量响应面回归模型方差分析
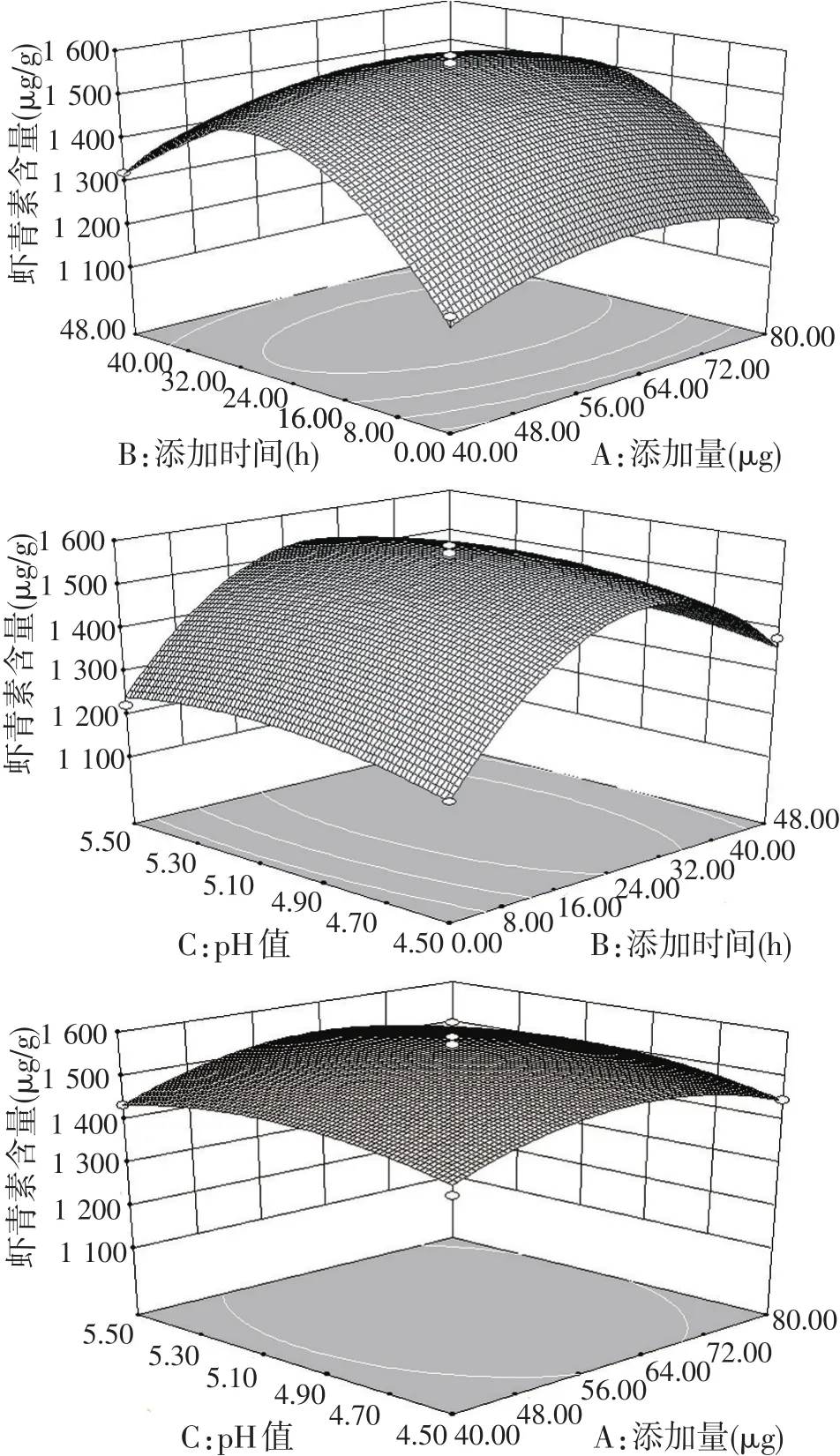
图8 添加量(A)、添加时间(B)、初始pH值(C)交互作用对虾青素含量的影响
2.2.9 海洋红酵母菌发酵过程中细胞数量的响应面回归模型方差分析(见表5)
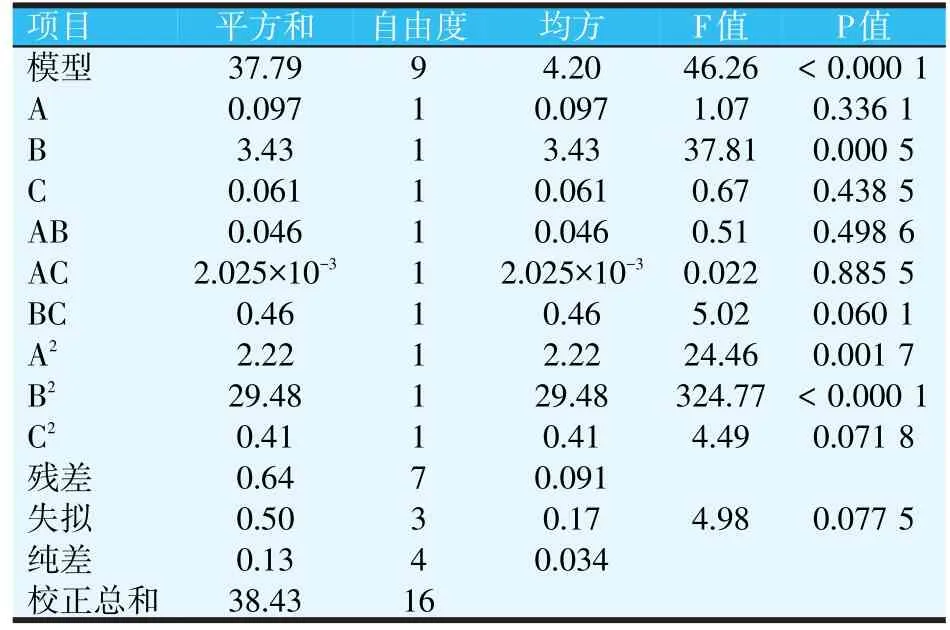
表5 海洋红酵母发酵过程中菌浓度响应面回归模型方差分析
由表5可知,模型的F值为46.26,其中P值<0.01,表明模型是显著的。在此模型中B、A2、B2为显著项。总体上讲,模型的拟合程度很好、试验误差较小模型成立,可以用此模型对海洋红酵母发酵条件进行分析。
对表5中的结果进行回归拟合分析,可得海洋红酵母发酵过程中菌浓度的二次回归方程为:Y2=14.80+0.11×A+0.66×B-0.088×C-0.11×AB-0.023×AC-0.34×BC-0.73×A2-2.65×B2-0.31×C2。
海洋红酵母发酵过程中各因素两两交互作用对菌浓度的影响如图9所示。由图9可看出,番茄红素的添加时间和添加量的交互作用对此菌株的菌量积累影响最为明显,而发酵初始pH值和添加量的交互作用对菌浓度的影响最不明显。
采用Design Expert8.0.6软件进行发酵条件的筛选,得到最佳发酵工艺参数:调节培养基初始pH值为4.99,添加番茄红素的量为62μg,在菌种发酵了27.25 h投放番茄红素,其理论虾青素含量和酵母细胞数最大分别为1 567.12μg/g和14.85×108CFU/ml。所得工艺条件需要进一步试验进行验证。

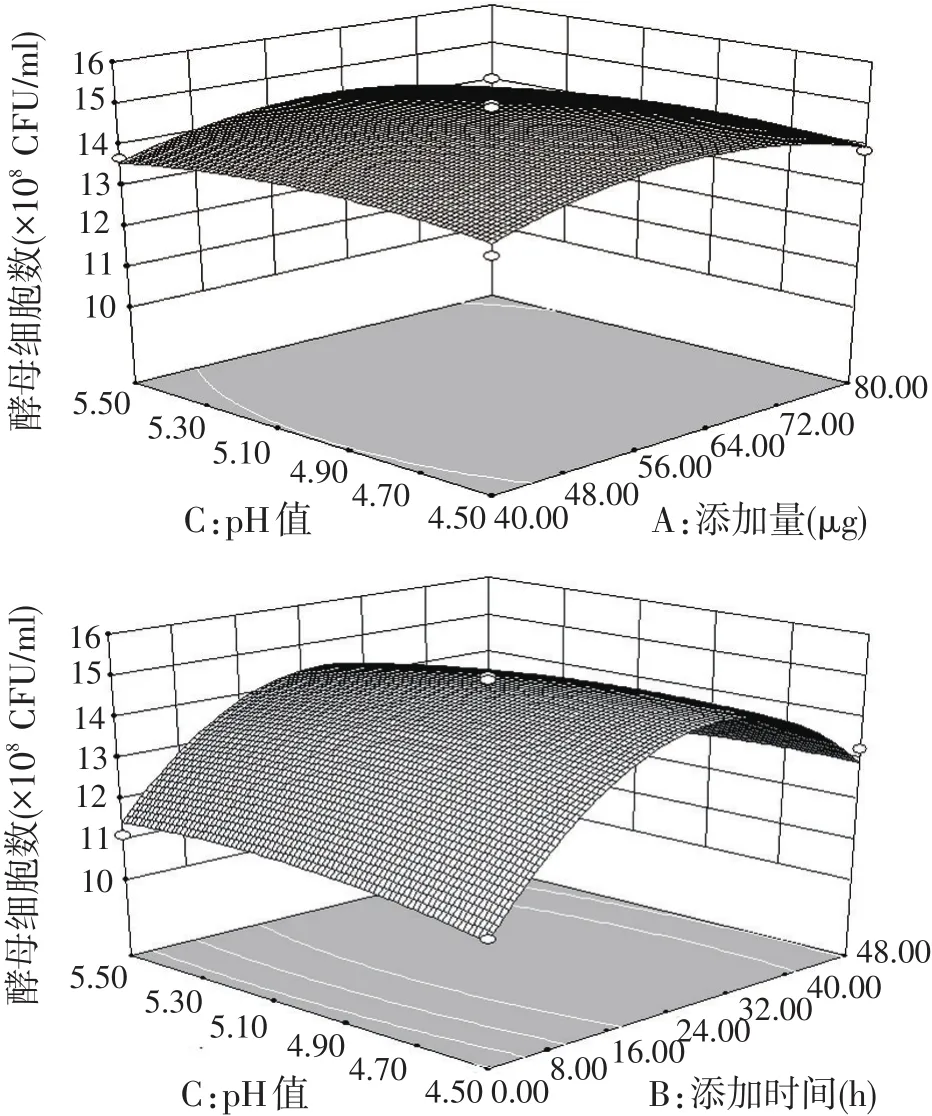
图9 添加量(A)、添加时间(B)、初始pH值(C)交互作用对酵母细胞数的影响
2.3 发酵工艺条件的验证
对响应面优化试验结果进行验证,并结合单因素试验结果,得到的最优条件。在此条件下进行发酵试验,并且与1.3.7培养方法进行比较,结果如表6所示。
在上述发酵条件下,发酵液的菌浓度和虾青素含量与预测值之间无显著差异,并且明显高于优化前海洋红酵母发酵的浓度和虾青素含量,说明模型有效,使用该模型优化出的试验结果可信度高,具有实用价值。并且此优化方法更为优越。
3 结论
海洋红酵母作为海参饵料越来越受到人们关注。研究表明,海洋红酵母对海参养殖起到积极作用,不仅可以提高海参的存活率,并且对海参营养价值也起到积极的作用。海洋红酵母作为海参饵料需要具备菌浓度和虾青素含量高的特点。朱晓立等[12]研究发现,前体物质的添加能够提高虾青素含量,这与本文的结论基本一致。本文通过26SrDNA的鉴定,确定该株从渤海湾提取的酵母菌Rhodosporidium diobovatum,单因素试验和Box-Behnken中心组合设计原理以及响应面分析对海洋红酵母的发酵工艺进行了优化,拟合了初始pH值、添加番茄红素的质量和添加时间这3个因素对海洋红酵母菌浓度和虾青素含量的回归模型,经检验证明该模型合理可靠,由该模型确定的最佳工艺条件为:培养基初始pH值为4.99,在菌种发酵了27.25 h时添加62μg的番茄红素,并且结合单因素试验发酵温度30℃,控制摇瓶转速为180 r/min,接种量为10%。在此条件下,得到的最优酵母细胞数为14.82×108CFU/ml和虾青素含量为1 571.00μg/g,此培养方式与常规培养方式相比分别提高了64.12%和86.14%。

表6 响应面优化验证试验结果
