手术去势和药物去势治疗前列腺癌疗效的回顾性研究
2015-01-19蒋玉清吴国柱王伟贾晓鹏王秀丽郭跃先
蒋玉清 吴国柱 王伟 贾晓鹏 王秀丽 郭跃先
手术去势和药物去势治疗前列腺癌疗效的回顾性研究
蒋玉清 吴国柱 王伟 贾晓鹏 王秀丽 郭跃先
目的 回顾性研究雄激素联合阻断治疗中,手术去势和药物去势两种治疗方式对晚期前列腺癌患者疗效及安全性。方法 选择2011至2013年采用戈舍瑞林联合比卡鲁胺(n=20)和白膜下睾丸实质剥脱术联合比卡鲁胺(n=16)治疗晚期前列腺癌患者,并随访。比较2组前列腺特异性抗原(PSA)抑制率,睾酮水平变化,肝肾功能及心理影响。结果 随访至2014年5月结束,两种治疗方法均能明显降低PSA水平,且2组治疗效果差异无统计学意义(Z=-0.96,P>0.05);2种治疗方式对降低睾酮的效果差异无统计学意义(P>0.05)。结论 激素联合阻断疗法治疗晚期前列腺癌患者能够降低血清PSA,减轻临床症状,去势方式的选择上,手术还是药物对于患者的疗效没有显著差异。
前列腺癌;手术去势;药物去势;最大限度雄激素阻断
前列腺癌的发病率在全球男性恶性肿瘤中占第二位,亚洲发病率低于欧美国家,但近几年呈增长的趋势,且多数患者确诊时已为疾病晚期。对于晚期前列腺癌患者,内分泌治疗已为主要的治疗手段,目前多采用去势+抗雄激素治疗,在去势的方式上,分为手术去势和药物去势。本文回顾性研究两种去势方法治疗晚期前列腺癌的疗效,报告如下。
1 资料与方法
1.1 一般资料 选择2011至2013年我院治疗的36例晚期前列腺癌患者,年龄51~91岁,中位年龄76.5岁。病例入选标准为前列腺核磁示前列腺癌突破包膜,侵及周围组织或器官,即临床分期≥T3。按治疗方式分为药物治疗组(n=20)和手术治疗组(n=16)。临床症状主要有尿频尿急、血尿、进行性排尿困难、腰骶疼痛等。患者行去势治疗前均行前列腺穿刺活检或者行经尿道前列腺电切术病理证实为前列腺癌,前列腺癌Gleason评分5~9分,治疗前血清总前列腺特异性抗原(tPSA)6.93 ~100,中位数 91.48。行核素骨显像检查共33例(药物治疗组18例,手术组15例)发生骨转移,上述资料2组患者差异无统计学意义(P >0.05)。
1.2 方法 (1)手术治疗组患者采用腰麻下双侧白膜下睾丸实质剥脱术,在附睾缘切开睾丸白膜,翻转白膜使白膜腔外露,用刀柄或者纱布将睾丸组织剥离切除,创面电灼止血,连续缝合白膜切口,对侧睾丸同样处理,术中注意彻底清除睾丸实质组织。术后留置橡皮片引流,3 d拔除引流片,7 d拆线,同时,术后当天开始给予患者口服雄激素受体拮抗剂,比卡鲁胺(商品名康士得,阿斯利康公司生产)50 mg,1次/d。(2)药物治疗组患者采用皮下注射黄体生成素释放激素类似物,戈舍瑞林(商品名诺雷德,阿斯利康公司生产),3.6 mg,每个月1次,在用药当日同时口服雄激素受体拮抗剂,比卡鲁胺50 mg,1次/d。
随访至2014年5月结束,对有排尿困难甚至尿潴留患者,行经尿道前列腺电切术,对于有骨转移患者,酌情予以静脉滴注双磷酸盐,缓解骨痛及防止病理性骨折。检测2组患者治疗前及治疗后12个月血清前列腺特异性抗原(PSA)变化(PSA>100的患者PSA记为100)。治疗过程中检测睾酮水平变化,同时监测患者肝肾功能。
1.3 疗效评价 (1)以治疗后血清PSA水平抑制率为疗效指标,抑制率(%)=(治疗开始前PSA值-治疗12个月后PSA值)/治疗开始前PSA值;(2)比较2组治疗1个月后睾酮水平变化,比较2组睾酮达去势水平的患者比率;(3)定期观察2组患者肝肾功能情况。(4)由白膜下睾丸实质剥脱导致的患者心理方面问题由Zung氏抑郁自评量表(self-rating scale,SDS)评估,SDS由20道基本问题组成,每个问题与抑郁症的一个症状相关,患者根据其出现频度按1~4级评分,累计相加得总分,病情指数=总分/80×100%。指数50% ~59%为轻度抑郁,60% ~69%为中度,70%以上为重度[1]。记录各种程度的2组患者数量。同时关注2组去势治疗产生的一些并发症,即去势综合征、潮热、贫血、肥胖、肌肉力量降低,易于疲劳等,记录不能忍受的患者数量。
1.4 统计学分析 应用SPSS 13.0统计软件,PSA属于非正态分布,以中位数和四分位数间距表示该分布的集中趋势和离散趋势,治疗前和治疗后2组比较采用基于秩次的非参数检验中的两独立样本的Wilcoxon秩和检验;2组PSA抑制率组间差异采用两独立样本的Wilcoxon秩和检验。患者抑郁情况属于等级资料,比较采用两独立样本的Wilcoxon秩和检验。P<0.05为差异有统计学意义。
2 结果
2.1 2组治疗资料比较 20例前列腺癌患者行皮下注射戈舍瑞林+口服比卡鲁胺治疗,治疗前患者血清PSA中位数及四分位间距分别为91.48和(16.33~100.00)ng/ml,治疗后为2.66 和(0.65 ~7.74)ng/ml,相对于治疗前明显降低。其中有7例因排尿困难行经尿道前列腺电切术。16例前列腺癌患者行双侧白膜下睾丸实质剥脱术+口服比卡鲁胺治疗,治疗前患者血清 PSA中位数及四分位间距分别为85.15和(22.35 ~ 100.00)ng/ml,治疗后为 1.37 和(0.21 ~6.00)ng/ml,相对于治疗前明显降低。其中有5例患者因排尿困难行经尿道前列腺电切术。见表1。
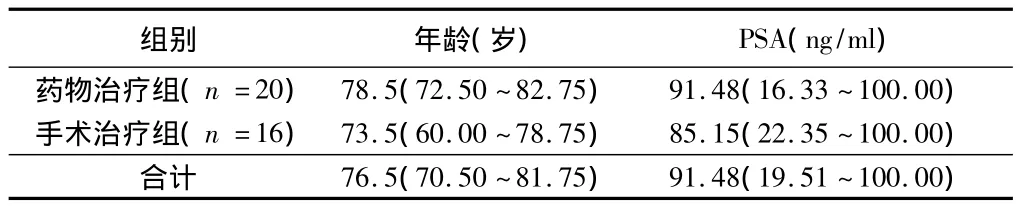
表1 2组患者治疗前血清PSA水平比较中位数与四分位数间距
2.2 2组患者血清PSA水平比较 2组患者治疗前血清PSA水平差异无统计学意义(Z=-0.34,P <0.05)。治疗12个月后,2组PSA抑制率比较采用两独立样本的Wilcoxon秩和检验,经检验,差异无统计学意义(Z= -0.96,P <0.05)。见表2。

表2 2组患者血清PSA水平比较 ng/ml
2.3 2组患者去势治疗所治抑郁情况比较 2组患者在去势治疗后,检测血清睾酮水平,所有患者均降至去势水平,证实两种去势方法对于降低雄激素效果的等效性。2组患者在去势+抗雄激素治疗期间,定期检测转氨酶,肌酐,均无患者治疗后明显增高。2组患者去势治疗所致抑郁情况比较,差异无统计学意义(Z=-0.95,P >0.05)。2组患者均有轻度的面色潮红、性欲降低、易疲劳等去势综合征表现,但是尚在可忍受范围内。见表3。

表3 2组患者去势治疗所致抑郁情况比较 例
3 讨论
随着人们饮食、生活习惯的改变及人口老龄化趋势,我国前列腺癌的发病率逐年增高,前列腺癌是雄激素依赖性肿瘤,内分泌治疗为晚期前列腺癌的主要治疗手段。降低或者阻断雄激素对前列腺癌细胞的抗凋亡作用,能够促使前列腺癌细胞凋亡,使瘤体缩小,这是前列腺癌内分泌治疗的分子生物学基础。体内雄激素主要由睾丸产生,此外,少量由肾上腺产生,单纯手术或者药物去势治疗只能够抑制睾丸产生的睾酮,并不能够阻断肾上腺来源的雄激素,因此,联合雄激素受体拮抗剂药物,如比卡鲁胺、氟他胺,以达到“最大限度雄激素阻断”(maximal androgen blockade,MAB)的目的,且已证实,其与单纯去势相比可延长总生存期3~6个月,平均5年生存率提高2.9%[2]。根据去势方式的不同,MAB可分为手术去势和药物去势,关于手术去势最早可以追溯到1941年,Huggins和Hodges发现手术切除前列腺癌患者的睾丸,能够延缓疾病的进展,开创了内分泌治疗晚期前列腺癌的先河。在20世纪80年代,人们发现黄体生成素释放激素类似物(LHRH-α)能通过降低黄体生成素的分泌,抑制睾丸产生雄激素,能达到手术去除睾丸的效果,被称为药物去势,且逐渐应用于临床。
本研究的2组患者中,33例骨转移的患者治疗后疼痛得到明显缓解,有排尿困难的患者症状得到缓解,行尿流率检查,最大尿流率相对治疗前有明显提高,行前列腺B超检查,示前列腺体积较治疗前明显缩小,提示去势治疗能够缩小前列腺的体积,且对于一些骨转移症状也有缓解作用。
在本研究中,两种治疗方式下患者血清PSA下降情况没有显著差异,这与国外研究[3]一致,证实了两种方法治疗的等效性,在药物去势治疗组患者,1个月后其血清睾酮均下降至去势水平,这与国外研究显示“10%的晚期前列腺癌患者接受LHRH-α治疗睾酮不能达到去势水平”[4]不一致,考虑为样本量较少的缘故。
对于药物治疗患者,在注射LHRH-α后,患者睾酮水平先逐渐升高,然后逐渐下降,即存在“一过性升高”现象,因此,在皮下注射前或者注射当日开始时应给予抗雄激素治疗,以对抗睾酮一过性增高所致的病情加剧。一般注射后3~4周,血清睾酮才可稳定达到去势水平[5],因此,在临床上遇到症状较重的患者,如已有骨转移骨髓压迫症状,因其去势较慢,不推荐使用。
药物治疗的优点避免了手术对患者带来的心理影响,且相对于手术治疗其治疗是可以人为控制和停止的。尽管大部分新确诊的前列腺癌患者为激素依赖型,但仍有15%的前列腺癌细胞一开始就不依赖激素生长[6],治疗前不能准确判断患者是否为激素依赖型,药物治疗能随时更改方案,避免了不必要的医疗。此外,药物治疗还可以单独或者联合抗雄激素药物用于间歇内分泌治疗(intermittent hormonal therapy,IHT),以保持前列腺癌细胞的激素依赖性,延长肿瘤进展到非激素依赖期的时间,可能延长患者总生存期。
手术去势最早是切除患者双侧睾丸实质,术后不同程度的造成患者心理障碍、抑郁等,后来通过改进,行白膜下睾丸实质剥脱术,保留了睾丸白膜腔和附睾,术后阴囊外观无明显改变,但在术中应注意剥离彻底,避免遗留睾丸组织。该术式去势效果和睾丸切除术相比没有显著的差异[7],且术后避免了阴囊空虚对患者带来的心理负担,减少了手术后患者抑郁的风险,在本研究手术治疗组16例患者中,通过随访调查,去势治疗所致抑郁的情况与药物治疗组差异无统计学意义(P>0.05)。目前白膜下睾丸实质剥脱术已经作为一种标准去势治疗方法广泛应用。
手术去势优点在于起效快,疗效确切,手术后1~12 h即可达到去势水平[8],对于临床症状较重的患者,迅速缓解临床症状效果很明显,这点显得尤为适用,此外,尽管本研究中,药物治疗组患者定期检测转氨酶、肌酐,均无治疗后明显增高,但相对于药物去势,手术避免了长期用药带来的肝肾功能损害,对于肝肾功能不全的患者,建议手术治疗。而且,临床上有10%的患者对LHRH-α不敏感,接受LHRH-α治疗后睾酮不能达到去势水平,此类患者可以考虑手术去势治疗。且手术治疗是一次完成的,避免了药物去势终身治疗的花费,更适合于广大基层地区。
两种内分泌治疗有共同的不良反应,如去势综合征、潮红、骨质疏松、贫血等,主要是由于去势治疗剥夺雄激素致代谢及调节中枢紊乱所致,对于去势综合征,主要是由于患者睾酮水平降低引起的性欲性功能降低、勃起功能障碍、易疲劳、肌力降低等,通过对2组患者电话随访,均有该表现,但是尚能忍受。单一抗雄激素治疗,不影响患者血清睾酮及黄体生成素水平,能够避免去势综合征,且总生存期与药物或手术去势无显著差异,但是尚未见到其与MAB的疗效对比研究。对于潮红、骨质疏松、贫血等,予以对症治疗,患者均有不同程度的缓解。
前列腺癌的初期大部分为激素依赖型,对内分泌治疗有效,经过中位时间14~30个月后,绝大部分会发展为去势抵抗性前列腺癌。对于去势抵抗性前列腺癌,目前没有统一的治疗标准,主要有化疗、放疗、免疫治疗及姑息性骨科手术治疗等,且治疗效果较差。Goldenberg等[9]提出间歇内分泌治疗(IHT)的方法,它的生物学基础为间歇补充雄激素刺激雄激素抑制后生存的肿瘤细胞,保持肿瘤细胞对雄激素的敏感性,延长雄激素依赖时间,从而延长生存期。手术去势是一次性治疗,一旦手术去势后无法行IHT治疗,此为药物去势优势所在。
综上所述,雄激素联合阻断疗法治疗晚期前列腺癌患者能够降低血清PSA,减轻临床症状,去势方式的选择上,手术还是药物对于患者的疗效没有显著的差异,在临床上,选用何种方法主要依靠当地的医疗水平、患者的要求及是否需要进行间歇阻断治疗等来进行。
1 舒良.抑郁症的评定与治疗.中华医学杂志,199,79:398-400.
2 Prostate Cancer Trialists'Collaborative Group.Maximum androgen blockade in advanced prostate cancer:an overview of the randomised trials.Lancet,2000,355:1491-1498.
3 Van Poppel H.Evaluation of degarelix in the management of prostate cancer.Cancer Manag Res,2010,2:39-52.
4 Oefelein MG,Cornum R.Failure to achieve castrate levels of testosterone during luteinizing hormone releasing hormone agonist therapy:the case for monitoring serum testosterone and a treatment decision algorithm.J Urol,2000,164:726-729.
5 Limonta P,Montagnani Marelli M,Moretti RM.LHRH analogues as anticancer agents:pituitary and extrapituitary sites of action.Expert Opin Investig Drugs,2001,10:709-720.
6 Chen CD,Welsbie DS,Tran C,et al.Molecular determinants of resistance to antiandrogen therapy.Nat Med,2004,10:33-39.
7 Zhang XZ,Donovan MP,Williams BT,et al.Comparison of subcapsular and total orchiectomy for treatment of metastatic prostate cancer.Urology,1996,47:402-404.
8 Maatman TJ,Gupta MK,Montie JE.Effectiveness of castration versus intravenous estrogen therapy in producing rapid endocrine control of metastatic cancer of the prostate.J Urol,1985,133:620-621.
9 Goldenberg SL,Bruchovsky N,Gleave ME,et al.Intermittent androgen suppression in the treatment of prostate cancer:a preliminary report.Urology,1995,45:839-844.
R 737.25
A
1002-7386(2015)21-3234-03
10.3969/j.issn.1002 -7386.2015.21.010
项目来源:河北省医学科学研究重点课题计划(编号:ZL20140192)
050051 石家庄市,河北医科大学第三医院泌尿外科(蒋玉清、吴国柱、王伟、贾晓鹏、郭跃先),麻醉科(王秀丽)
郭跃先,050051 石家庄市,河北医科大学第三医院泌尿外科;
E-mail:guoyuexian@aliyun.com
2015-04-03)
