磷脂酰肌醇蛋白聚糖3与ki67在不同分化程度肝细胞癌中的表达分析
2015-01-19祖可佳王欣欣冯骥良吕福东
董 坤 常 静 祖可佳 王欣欣 刘 晖 冯骥良 吕福东
首都医科大学附属北京佑安医院病理科,北京 100069
肝细胞癌(hepatocellular carcinoma,HCC)是严重威胁人类生命的恶性肿瘤之一,其发病率在男性癌症中排名第5 位(523 000 例/年,所有癌症中占7.9%),在女性癌症中排名第7 位(226 000 例/年,所有癌症中占6.5%)[1]。 临床初筛HCC 首选肝脏超声及血清甲胎蛋白(AFP)检测,有肝硬化的患者血清AFP>200 ng/mL时强烈提示HCC 可能, 但并不是所有HCC 患者的AFP 水平都会升高,而且AFP 升高并不单纯出现在HCC中[2]。 最近的研究发现,无论血清中还是组织中AFP的敏感性及特异性均不高[3]。 磷脂酰肌醇蛋白聚糖3(GPC3)是近年来比较热门的一种用于肝细胞癌诊断的标志物,因其敏感性好,特异性高,被认为可能是一种新型癌胚因子[4]。 GPC3 在胚胎肝脏中表达丰富,但是在成人正常肝脏中无表达[5]。 有研究发现GPC3 在HCC 中表达的敏感性为68%~72%,特异性为92%[1]。但是GPC3 在不同分化程度的HCC 中敏感性差异的研究较少。 ki67 作为肿瘤细胞增殖活性的标志物,常用于即时反映肿瘤增殖细胞的数量,判断肿瘤的恶性程度及预后[6]。 本研究的目的是通过对不同分化程度的肝细胞癌组织中GPC3 和ki67 表达的情况进行分析,研究GPC3 在不同分化程度的HCC 中表达的强度,同时研究不同分化程度的HCC 中GPC3 和ki67 的关系。
1 材料与方法
1.1 实验材料
收集2010 年7 月~2014 年7 月首都医科大学附属北京佑安医院病理科的HCC 部分肝切除标本共90 例,其中高分化30 例,中分化30 例,低分化30 例。
1.2 材料和试剂
GPC3, ki67 抗体及二抗PV6000 均购自北京中山金桥生物技术有限公司。
1.3 方法
所有标本先经过10%的甲醛固定后,取材,按脱水、透明、浸蜡、包埋程序处理,4 μm 连续切片,之后进行HE 染色,肝癌病理诊断经2 名副主任以上医师复诊。 HCC 的镜下分级采用WHO 推荐HCC 分级标准[7]。1.3.1 染色方法 采用EnVision 两步法,上述切片经烤片、脱蜡,梯度乙醇由高至低入水,入3%过氧化氢5 min,PBS 缓冲液浸透3 次,每次5 min,放入pH 6.0 柠檬酸缓冲液中高温高压修复:高压锅喷气后,加热2 min,变中火2 min,关火后焖10 min,放入冷水中冷却至37℃,之后入PBS 缓冲液洗3 次,加GPC3 一抗(鼠抗人单克隆抗体),4℃冰箱过夜,PBS 缓冲液浸3 次,每次5 min,加二抗PV6000(通用型抗体)37℃10 min,PBS 缓冲液浸3 次,DAB 显色,PBS 液终止染色,甲醛逐级由低至高浓度脱水至入二甲苯,封片。 ki67 染色步骤同GPC3。
1.3.2 判断方法 ki67 染色位于细胞核,免疫组化诊断标准[8]:细胞膜或细胞浆内出现淡黄色、棕黄色或棕褐色为阳性;每张切片随机选取5 个高倍视野(400×),每个视野数100 个细胞, 按阳性细胞所占百分比评分:诊断分级为≤5%,>5%~30%,>30%~50%,>50%。GPC3 染色位于胞浆及细胞膜。 免疫组化诊断标准[8]:细胞膜或细胞浆内出现淡黄色、棕黄色或棕褐色为阳性;每张切片随机选取5 个高倍视野(400×),每个视野数100 个细胞, 按阳性细胞所占百分比评分:“-”:<5%的肿瘤细胞着色;“1”:5%~25%的肿瘤细胞着色;“2”:>25%~50%的肿瘤细胞着色;“3”:>50%~75%的肿瘤细胞着色;“4”:>75%的肿瘤细胞着色;其次染色强度评分:不着色为0 分;淡黄色为1 分;棕黄色为2 分;棕褐色为3 分。最后将染色强度与阳性细胞所占百分比计分乘积作为每例染色的综合评分,0 分为(-),1~2 分为(+),3~5 分为(++),6~9 分为(+++),≥10 分为(++++)。
1.4 统计学方法
采用统计软件SPSS 15.0 对数据进行分析, 正态分布计量资料以均数±标准差(s)表示,两组间比较采用t 检验;计数资料以率表示,采用χ2检验。 以P <0.05 为差异有统计学意义。
2 结果
2.1 90 例患者一般资料情况
90 例患者,年龄38~84 岁,平均(53.7±0.1)岁;男68 例,女22 例;HBsAg 阳性66 例,阴性24 例;肿瘤直径≤5 cm 者46 例,>5 cm 者44 例;肿瘤单发者74 例,多发者16 例;伴肿瘤坏死者30 例,无肿瘤坏死者60 例;伴脉管内癌栓者18 例,无脉管内癌栓者72 例;有肝硬化背景者56 例,无肝硬化背景者34 例。 GPC3的表达强度与患者的年龄、性别、HBsAg 阳性与否、肿瘤直径、肿瘤数目、肿瘤坏死、脉管内癌栓及肝硬化无关(P >0.05)。 见表1。
2.2 不同分化程度的HCC HE 组织染色
高分化HCC 显示细胞轻度异型,肝板结构紊乱,可见肿瘤细胞假腺样排列(图1A,封三);中分化HCC显示肿瘤细胞中度异型,核浆比增加,肿瘤细胞呈假腺样或细梁状排列(图1B,封三);低分化HCC 显示肿瘤细胞异型性明显,细胞核大,核膜不规则,可见核仁,肿瘤细胞呈团巢状或实性片状排列(图1C,封三)。
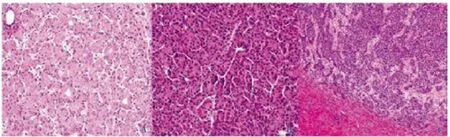
图1 不同分化程度的HCC 组织HE 染色(见内文第24页)
2.3 GPC3 在高、中、低分化HCC 组织中的表达
GPC3 在HCC 中的着色在细胞膜和细胞质,大部分肝细胞癌是混合着色,HCC 分化越低,GPC3 着色越强(图2,封三)。 不同分化的HCC 组织中GPC3 表达的强度及阳性率性况具体见表2。 高分化的HCC中GPC3 阳性率为50.00%,其中“+~++”阳性率为43.33%,“+++~++++”阳性率为6.67%;中分化的HCC中阳性率均为83.33%,其中“+~++”阳性率为60.00%,“+++~+++++”阳性率为23.33%;低分化的HCC 中阳性率为90.00%,其中“+~++”阳性率为23.30%,“+++~++++”阳性率为66.67%。 统计结果显示:GPC3在低分化的HCC 中的阳性率明显高于中分化及高分化,并且中分化高于高分化,差异有高度统计学意义(P <0.01)。 低分化组中GPC3 的强阳性(+++~++++)率明显高于中分化及高分化,并且中分化明显高于高分化,差异有高度统计学意义(P <0.01)。 说明GPC3的表达与HCC 的分化程度有关。

图2 GPC3 免疫组化(SP 法)结果(见内文第24页)

表1 GPC3 表达强度与一般资料的关系(例)

表2 不同分化组中GPC3 表达的强度及阳性率情况(例)
2.4 Ki67 在高、中、低分化肝细胞癌中的表达
ki67 为细胞核着色,在HCC 组织中的阳性率为90%(81/90),在周围肝组织内未见表达(图3,封三)。不同化为的HCC 组织中ki67 的表达情况具体见表3,统计学结果显示: 低分化组中ki67 的表达明显高于中分化及高分化组, 并且中分化组高于高分化组,差异有高度统计学意义(P <0.01),说明ki67 的表达与HCC 的分化程度有关。

图3 ki67 免疫组化(SP 法)结果(见内文第25 页)

表3 不同分化HCC 中ki67 的表达情况(例)
2.5 不同分化组中GPC3 的表达与ki67 增殖指数之间的关系
Spearman 相关分析显示:GPC3 的表达与ki67 表达呈正相关(r = 0.551,P = 0.000),即HCC 中GPC3表达越强,ki67 表达越强。
3 讨论
GPC3 编码的蛋白属于硫酸乙酰肝素蛋白聚糖,通过糖基磷脂肽肌锚蛋白锚定在细胞表面。 GPC3 在细胞的生长发育中起着重要的调控作用,该基因突变可导致细胞增殖和凋亡失衡,且在多种肿瘤和细胞株中常常发生甲基化[9]。 在HCC 组织中GPC3 表达增多,并且在HCC 形成过程中分泌入血[10]。 有的研究提示在肝细胞癌的特异性表达率为52.5%~85%, 而在肝脏良性病变包括:肝硬化(cirrhosis)、肝细胞腺瘤(hepatocellular adenoma,HCA)及局灶结节状增生(focal nodular hyperplasia,FNH)中的表达率为0[5];而且GPC3 的特异性及敏感性均高于AFP,血清中GPC3 mRNA 的表达明显高于AFP(71.7% 比51.3%),尤其是当肿瘤直径小于3 cm 时GPC3 的表达更是高于AFP 的表达(77%比43%)[4,11-12]。 由此分析GPC3 可以作为一个特异性免疫标志物来鉴别肝细胞癌和肝外肿瘤及肝脏良性病变。 研究结果显示GPC3 的着色强度与肿瘤的分化程度有关,GPC3 在HCC 中的阳性率为74.4%,分化越低表达强度越强,分化越高表达强度越低,总体阳性率也随分化程度的降低而升高。 尽管现在关于GPC3 的表达与HCC 生存率的研究较少[9],但是诸多研究发现肿瘤的分化程度与预后相关,分化越差预后越差,GPC3 在HCC中的表达与分化程度呈负相关[13-14],即分化越差表达越强。 以上的研究提示GPC3 的表达与HCC 的预后相关,GPC3 的表达强度对HCC 的预后可能有提示作用。 有学者对5 组关于HCC 的实验进行Meta 分析,发现GPC3 的高表达与患者的总体生存率(OS)及无病生存率(DFS)相关,HCC 组织中高表达GPC3 预示手术后DFS 较差[9]。 又有研究发现低水平表达GPC3 可以增加手术后肿瘤复发的风险[15]。
ki67 基因定位于第10 号染色体,其蛋白质产物定位于细胞核, 由相对分子量为345 000 和395 000 两条肽链组成,其在G1后期开始出现,在S 期和G2期逐渐升高,M 期达高峰, 有丝分裂结束后降解消失,G0期无表达[16-17]。因此,ki67 表达的高低对评价细胞增殖活性,研究肿瘤的生物学行为和预后有重要意义。 本研究中,HCC 组织中ki67 阳性表达率为90%,在周围肝组织内未见表达,说明HCC 的增殖活性明显大于非肿瘤的肝细胞;HCC 分化越差,ki67 增殖指数越高,这与HCC 的浸润性生长、转移及复发等生物学行为密切相关。
目前,GPC3 的表达与肿瘤细胞增殖指数之间的关系目前研究尚少。 有研究发现GPC3 可以促进肿瘤细胞的增殖,作为致癌基因GPC3 可以使c-Myc 原癌基因活化,从而激活多条细胞信号转导通路而促进细胞的增殖,目前研究较多的是Wnt 及IGF 途径[9]。 本研究在不同分化程度的HCC 中GPC3 与ki67 提示的细胞增殖指数呈正相关,即GPC3 表达强度越高,ki67增值指数越高,说明GPC3 对肿瘤的生物学行为有一定的提示作用, 即GPC3 表达越强,HCC 的增殖活性越高,肿瘤转移、复发的概率越高,患者的预后越差。
HCC 对化疗药物不敏感,除了手术切除,目前尚无有效的系统的治疗手段。GPC3 特异性的表达于HCC中,或许它可以成为HCC 靶向治疗的分子靶点[18-19],目前Ⅰ期临床试验正在进行[20]。 本研究对不同分化程度的HCC 表达GPC3 的敏感性的研究, 可能会为将来分子靶向治疗提供筛选条件。
综上所述, 联合检测HCC 组织中GPC3 和ki67增殖指数的表达有着重要的临床意义,不但有利于揭示HCC 发生发展、浸润转移的机制,更重要的是能够对患者预后的评价提供重要帮助。对GPC3 在不同分化程度HCC 中敏感性的研究也为HCC 的靶向治疗提供参考依据,从而帮助提高疗效,延长患者的生存期。
[1] Wang CH,Wey KC,Mo LR,et al. Current trends and recent advances in diagnosis,therapy,and prevention of hepatocellular carcinoma [J]. Asian Pac J Cancer Prev,2015,16(9):3595-3604.
[2] 赵春华,周文峰,陈维华,等.甲胎蛋白在原发性肝癌首诊中的价值[J].临床肝胆病杂志,2013,29(9):698-701.
[3] Bruix J,Sherman M. American association for the study of liver diseases.management of hepatocellular carcinoma:an update [J]. Hepatology,2011,53(3):1020-1022.
[4] Filmus J,Capurro M. Glypican-3:a marker and a therapeutic target in hepatocellular carcinoma[J].FEBS J,2013,280(10):2471-2476.
[5] Gong L,Wei LX,Ren P,et al. Dysplastic nodules with glypican-3 positive immunostaining:a risk for early hepatocellular carcinoma [J]. PLoS One,9(1): e87120.
[6] Raghunandhakumar S,Paramasivam A,Senthilraja S,et al.Thymoquinone inhibits cell proliferation through regulation of G1/S phase cel cycle transition in N-nitrosodiethylamine-induced ex-perimental rat hepatocelular carcinoma [J]. Toxicol Let,2013,223(1):60-72.
[7] Christopher DM,Julia A,Pancras CW,et al. WHO classification of tumors of soft tissue and bone [M]. 4th Edition.Paris:IARC,2013:155-156.
[8] Timek DT,Shi J,Liu H,et al. Arginase-1,HepPar-1,and glypican-3 are the most effective panel of markers in distinguishing hepatocellular carcinoma from metastatic tumor on fine-needle aspiration specimens [J]. Am J Clin Pathol,2012,138(2):203-210.
[9] Li J,Gao JZ,Du JL,et al. Prognostic and clinicopathological significance of glypican-3 overexpression in hepatocellular carcinoma: a meta-analysis [J]. World J Gastroenterol,2014,28(20):6336-6344.
[10] Ozkan H,Erdal H,Kocak E,et al. Diagnostic and prognostic role of serum glypican 3 in patients with hepatocellular carcinoma[J].J Clin Lab Anal,2011,25:350-353.
[11] Xu C,Yan Z,Zhou L,et al. A comparison of glypican-3 with alpha-fetoprotein as a serum marker for hepatocellular carcinoma: a meta-analysis [J]. J Cancer Res Clin Oncol,2013,139(8):1417-1424.
[12] Tangkijvanich P,Chanmee T,Komtong S,et al. Diagnostic role of serum glypican-3 in differentiating hepatocellular car- cinoma from non-malignant chronic liver disease and other liver cancers [J]. J Gastroenterol Hepatol,2010,25(1):129-137.
[13] Reddy OL,Cates JM,Gellert LL,et al. Loss of FOXA1 drives sexually dimorphic changes in urothelial differentiation and is an independent predictor of poor prognosis in bladder cancer [J]. Am J Pathol,2015,185(5):1385-1395.
[14] 邰伯军,姚敏,顾星,等.磷脂酰肌醇蛋白多糖-3 对肝癌细胞增殖和凋亡的影响[J].临床肝胆病杂志,2013,29(11):863-866.
[15] Jin GZ,Dong H,Yu WL,et al. A novel panel of biomarkers in distinction of small well-differentiated HCC from dysplastic nodules and outcome values [J]. BMC Cancer,2013,13:161.
[16] Haroon S,Hashmi AA,Khurshid A,et al. Ki67 index in breast cancer: correlation with other prognostic markers and potential in pakistani patients [J]. Asian Pac J Cancer Prev,2013,14(7):4353-4358.
[17] 叶文静,邢卫斌,秦兰英,等.Survivin 和Ki-67 在皮肤鳞癌和基底细胞上皮瘤的表达及相关性分析[J].中国皮肤性病学杂志,2010,24(1):20-22.
[18] Yu D,Dong Z,Yao M,et al. Targeted glypican-3 gene transcription inhibited the proliferation of human hepatoma cells by specific short hairpin RNA [J]. Tumor Biol,2031,34(2):661-668.
[19] 陈洁,姚敏,姚登福,等.磷脂酰肌醇蛋白多糖-3 介导的信号通路与肝癌靶向治疗[J].临床肝胆病杂志,2013,29(1):77-80,后插1.
[20] Sawada Y,Yoshikawa T,Nobuoka D,et al. Phase I trial of a Glypican-3-derived peptide vaccine for advanced Hepatocellular carcinoma: immunologic evidence and potential for improving overall survival [J]. Clin Cancer Res,2012,18(13):3686-3696.
