Lenti-Toll样受体4-siRNA的构建及对大鼠肺泡巨噬细胞NR8383的影响
2015-01-19张小艺孟红艳马宏博
张小艺 孟红艳 彭 敏 司 皓 马宏博
1.山东大学附属省立医院中医科,山东济南 250021;2.山东大学公共卫生学院,山东济南 250012
内毒素(lipopolysaccharide,LPS)是导致急性肺损伤(acute lung injury,ALI)的重要因素,Toll 样受体(Toll like receptor,TLR)是LPS 信号向细胞内传导的“门户蛋白”[1], 其信号通路的过度激活是导致炎性反应爆发失控的重要机制。 TLR4 可以选择性识别LPS,LPS 与单核巨噬细胞、中性粒细胞等免疫细胞细胞膜上的TLR4 结合,引起炎症瀑布效应[2]。 调节TLR4 信号通路有可能成为脓毒症的一种治疗策略[3]。
RNA 干扰(RNA interference,RNAi)近年来取得相当大的进展,研究人员利用RNAi 作为研究工具引入到细胞或整个生物RNAi 试剂,用以识别新的细胞通路和潜在的药物靶点[4]。 慢病毒载体是一种高效率的转基因和基因治疗工具,其最大优势在于能够感染分裂和静止状态下的细胞,并且能够高效、稳定地整合于宿主细胞内[5]。 本实验通过构建TLR4 siRNA 慢病毒载体,转染至大鼠巨噬细胞NR8383,并通过实时定量聚合酶链反应(RT-PCR)检测TLR4 siRNA 干扰的效果,为进一步探讨TLR4 信号通路在ALI 发生、发展中的机制提供研究工具。
1 材料与方法
1.1 材料与试剂
聚合酶链反应(PCR)反应试剂,Primer(R&F)合成、dsDNA oligo、293T 细胞株、大肠埃希菌菌株DH5α、病毒载体均由上海吉凯基因化学技术有限公司提供;Taq 酶、SYBR Master Mixture 购于TaKaRa;Age Ⅰ、EcoRⅠ、T4 DNA ligase、T4 DNA ligase buffer 来 自 于NEB;QIAGEN Plasmid 大抽Kit 来自QIAGEN;Rnase Inhibitor、dNTP、M-MLV 逆转录酶购于Promega;Lipofectamine 2000、Trizol 购 自Invitrogen;ECL-PLUS/Kit购于Amersham 公司;positive clone 测序由上海美季生物技术有限公司完成;胎牛血清、DMEM 购自Gibco公司;Opti-MEM 购自Invitrogen。
1.2 方法
1.2.1 TLR4 基因RNAi 慢病毒载体构建
1.2.1.1 siRNA 靶点设计 针对TLR4 目的基因靶基因序列,采用Invitrogen 软件(https://rnaidesigner.invitrogen.com/sirna/)设计4 个RNA 干扰靶点序列。见表1。

表1 TLR4 siRNA 靶点设计
1.2.1.2 RNAi 慢病毒载体构建 工具载体选择GV115,框架结构为hU6-MCS-CMV-EGFP,酶切位点:Age Ⅰ,EcoR Ⅰ。 合成含干扰序列的DNA oligo,经退火形成双链DNA,与经Age Ⅰ和EcoR Ⅰ双酶切后的载体连接。 见表2。

表2 RNAi 合成片段
1.2.1.3 克隆制备与鉴定 通过T4 DNA ligase 将酶切回收的载体和DNA 片段进行链接反应, 将链接产物转入制备好的DH5α 细菌感受态细胞,挑取转化子重悬于10 μL LB 溶液,使用GV115 通用引物,进行菌落PCR 鉴定实验。 将PCR 阳性克隆进行测序,经结果比对,确认测序引物与鉴定引物中的上游引物相同即为构建成功的TLR4 目的基因RNAi 慢病毒载体。测序结果通过Chromas 软件进行分析。PCR 鉴定阳性克隆的引物为:上游5′-CCATGATTCCTTCATATTTGC-3′,下游5′-CGCGTGGATAACCGTATTAC-3′。 PCR 鉴定的分组为1:阴性对照(ddH2O);2:阴性对照(空载);3:Marker 自上而下依次为5 kb、3 kb、2 kb、1.5 kb、1 kb、750 bp、500 bp、250 bp、100 bp;4:TLR4-RNAi 转化子(a:Tgt-1;b:Tgt-2;c:Tgt-3;d:Tgt-4)。
1.2.2 RNAi 慢病毒小量包装
制备编码慢病毒颗粒的重组病毒质粒及其两种辅助包装原件载体质粒,分别进行高纯度无内毒素抽提, 在Lipofectamine 2000 介导下共转染293T 细胞,培养8 h 后倒去含有转染混合物的培养基, 加入含10%血清的细胞培养基,继续培养48 h,收集293T 细胞上清液,过滤离心后取病毒浓缩液,分装后保存在病毒管中,-80℃保存,取1 支以荧光法进行病毒生物学滴度测定。
1.2.3 慢病毒感染细胞
1.2.3.1 细胞培养 实验细胞大鼠肺巨噬细胞株NR8383购自ATCC 公司,培养于含15%胎牛血清、青霉素(100 U/mL)、链霉素(100 μg/mL)、L-谷氨酰胺(2 mmo/L)、NaHCO3(1.5 g/L)的Ham′s F12 培养基中,细胞在37℃、5%CO2条件下培养,在对数生长期进行实验。
1.2.3.2 NR8383 细胞慢病毒感染 将处于对数生长期的大鼠肺泡巨噬细胞NR8383 进行胰酶消化,制成细胞悬液,接种于6-well 培养板培养,待细胞融合度达到约30%, 按设计组别分别加入慢病毒颗粒进行NR8383 细胞的感染实验,12 h 后观察细胞状态,如无明显细胞毒性,连续培养24 h 后更换培养基。 感染3 d 后荧光显微镜下观察GFP 表达,荧光率达80%以上,收集细胞,感染效率低于80%的实验组,重新进行感染实验。 见表3。

表3 细胞感染实验分组和病毒用量
1.2.4 qPCR 内源筛靶
收集生长状态良好的目的细胞, 提取RNA,总RNA 抽提根据Trizol 操作说明书进行。 RNA 逆转录获得cDNA,按照M-MLV 操作说明书进行,采用RTPCR 检测目的基因的表达情况。TLR4 上游引物序列:5′-ATGAGGACTGGGTGAGAAACG-3′,下游引物序列:5′-ATGCCAGAGCGGCTACTCA-3′, 扩增长度:247 bp;内参GAPDH 上游引物序列:5′-TTCAACGGCACAGTCAAGG-3′,下游引物序列:5′-CTCAGCACCAGCATCACC-3′,扩增长度:114 bp。 用TP800 序列检测系统软件(TaKaRa 公司)制作扩增曲线并进行数据分析,依据2-ΔΔCt数据分析法,比较各组TLR4 基因mRNA 表达水平。
1.2.5 有效靶点慢病毒大量包装及验证内源性目的基因表达敲减
根据RT-PCR 结果,筛选出敲减效率最高的1 个RNAi 有效靶点,进行慢病毒大量包装。
1.3 统计学方法
采用SPSS 17.0 统计软件对数据进行分析和处理,计量资料以均数±标准差(±s)表示,采用单因素方差分析,组间两两比较采用LSD-t 检验,以P <0.05为差异有统计学意义。
2 结果
2.1 阳性克隆的PCR 鉴定
载体上的引物进行PCR 鉴定阳性克隆, 经琼脂糖凝胶电泳检测其大小和完整性,每个序列阳性克隆各取3 个样品菌种送上海美季公司测序, 结果通过Chromas 软件进行分析。 鉴定电泳结果显示,TLR4 vshRNA 片段已经成功插入质粒,挑选的阳性克隆菌液测序结果与实验要求的DNA 序列完全一致。 见图1。
2.2 慢病毒滴度测定

图1 阳性克隆的PCR 鉴定
测定前1 d 为293T 细胞铺板, 每孔加4×104个细胞,在Eppendorf 管中加入90 μL 无血清培养基,将10 μL 病毒原液加入到第1 个管中, 混匀后取10 μL加入到第2 个管中, 如此分别稀释为1/10~1/100 万,感染293T 细胞,24 h 后加入完全培养基100 μL,4 d后,观察绿色荧光蛋白表达,通过GFP 阳性细胞计数法测定LV-TLR4-RNAi(Tgt-1、2、3、4)的滴度分别为5×108、4×108、4×108、5×108TU/mL。
2.3 慢病毒感染细胞
感染后16 h 更换培养基,感染后96 h 荧光拍照。图2 显示各组慢病毒成功感染NR8383 细胞。

图2 荧光显微镜下慢病毒感染NR8383 细胞GFP的表达(100×)
2.4 RT-PCR 内源筛靶
RT-PCR 检测结果显示,NR8383 细胞中,相对于阴性对照组,KD2 组TLR4 基因敲减效率达到65%(P <0.05)(图3,封三),认为是KD2 有效靶点。
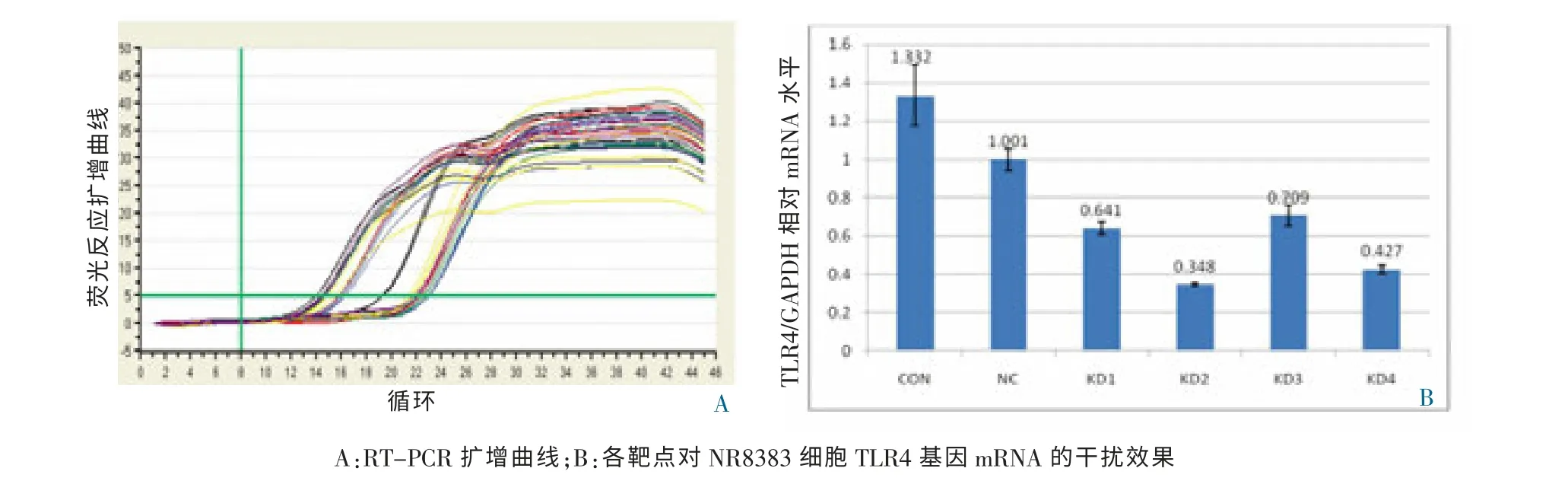
图3 RT-PCR 检测TLR4 mRNA 的表达
2.5 病毒大量包装后的靶点再次验证
根据RT-PCR 筛选结果,选取敲减效率最高的KD2 号靶点进行病毒的大量包装后, 经定量PCR 测定,在NR8383 细胞中,相对于NC、KD2 组TLR4 基因敲减效率达到90.1%(P <0.05)。
3 讨论
ALI 发病的关键是一种肺内过度性、失控性的炎性反应, 多种炎症细胞和炎症介质相互的激活与释放,导致瀑布式的炎性反应,形成肺的过度损伤[6-7]。研究表明,ALI 患者TLR4 的表达水平与急性肺部炎症程度及气道上皮细胞的损伤、肺部中性粒细胞增加相关[8]。TLR4 可以早期识别侵入体内的细菌启动炎性反应,核因子(NF)-κB、激活蛋白-1(AP-1)、肿瘤坏死因子-α(TNF-α)、白细胞介素-1(IL-1)等的激活均为其下游事件, 最终导致多种炎性因子的瀑布式释放,放大炎症效应[9]。 研究证实,TLR4 基因缺陷小鼠对内毒素的敏感性明显下降,肺组织病理损伤和肺水肿程度减轻[10],以TLR4 基因为靶点,从上游调控这种瀑布式的炎症效应,可为治疗急性感染性疾病提供一种新的策略[11]。
RNAi 技术是近年来发现的一种重要的基因沉默技术,RNAi 能够非常特异地降解与之序列相应单个内源基因mRNA, 相对少量的dsRNA 就可以使表型达到缺失突变体程度,抑制基因表达效率很高[12-14],已成为研究信号传导通路的良好工具。 RNAi 技术在调节免疫系统增强免疫反应、控制炎症和治疗自身免疫性疾病中都发挥了作用[15]。
RNAi 的沉默效应与基因的转染效率密切相关[16]。基因转染的方法可分为病毒转染和非病毒转染,常用的病毒载体包括逆转录病毒、慢病毒、腺病毒和腺相关病毒载体[17]。 慢病毒载体是以人类免疫缺陷Ⅰ型病毒(HIV-1)为基础发展起来的基因治疗载体,可感染分裂细胞及非分裂细胞, 转移基因片段容量较大,目的基因表达时间较长,还可整合到宿主细胞的染色体基因组上,不易引发宿主免疫反应[18-20],已成为基因功能研究及基因治疗领域中热门的基因转移载体[21]。
本研究成功构建了4 个TLR4 基因RNAi 慢病毒表达载体, 具有较高滴度,4 种慢病毒载体感染大鼠肺巨噬细胞NR8383 后,TLR4 基因mRNA 表达量均明显下降,其中LV-TLR4-RNAi(Tgt-2)抑制作用最明显,使mRNA 表达下降65%,将2 号靶点进行病毒的大量包装后,TLR4 基因敲减效率达到90.1%,表明本研究构建的慢病毒RNAi 表达载体在NR8383 细胞内能有效地沉默TLR4 基因表达, 为后续研究TLR4信号通路在ALI 发病过程中的作用及中药干预的靶点奠定了基础。
[1] Säemann MD,Weichhart T,Zeyda M,et al. Tamm-Horsfall glycoprotein links innate immune cell activation with adaptive immunity via a Toll-like receptor-4 dependent mechanism [J]. J Clin Invest,2005,115(2):468-475.
[2] 王晶晶,杨敬平,齐明禄.TLR4 介导的信号通路与脓毒症相关性研究[J].临床肺科杂志,2015,20(4):725-727.
[3] Wittebole X,Castanares-Zapatero D,Laterre PF. Toll-like receptor 4 modulation as a strategy to treat sepsis [J]. Mediators Inflamm,2010,2010:568396.
[4] Stephanie EM,Jennifer AS,Caroline ES,et al.RNAi screening comes of age:improved techniques and complementary approaches [J]. Nat Rev Mol Cell Biol,2014,15(9):591-600.
[5] 张曼,孙秀萍,宋铭晶.慢病毒载体用于转基因技术的研究进展[J].中华临床医师杂志:电子版,2014,8(10):1949-1953.
[6] 李玉梅,卫洪.ALI/ARDS 抗炎治疗研究的策略与展望[J].中国病理生理杂志,2009,25(4):813-816,825.
[7] 雷马文,王德明.miRNA:急性肺损伤中新的调控分子[J].中国现代医生,2013,51(11):27-28.
[8] Togbe D,Schnyder-Candrian S,Schnyder B,et al. TLR4 gene dosage contributes to endotoxin-induced acute respiratory inflammation [J]. J Leukoc Biol,2006,80(3):451-457.
[9] 唐婧,莫中成,王德明.TLR4 在急性肺损伤中的作用[J].中南医学科学杂志,2013,41(5):516-519.
[10] 张进祥,王慧,徐建波,等.Toll 样受体4 在急性肺损伤中的作用[J].中华急诊医学杂志,2006,15(8):692-695.
[11] 王娜,张雪梅,陈立杰.TLR4 信号通路与炎症相关性疾病[J].中国实验诊断学,2015,19(5):857-860.
[12] Moffat J,Sabatini DM. Building mammalian signalling pathways with RNAi screens [J]. Nat Rev Mol Cell Biol,2006,7(3):177-187.
[13] 李再新,王慧.RNAi 作用机制及其应用研究进展[J].四川理工学院学报:自然科学版,2005,18(3):19-21.
[14] Chad VP,George AC,Robert LC,et al. RNA interference in the clinic:challenges and future directions [J]. Nat Rev Cancer,2011,11(1):59-67.
[15] Chih-PM,YenYL,ChienFH,et al. Immunological research using RNA interference technology [J]. Immunology,2007,121(3):295-307.
[16] 阮静,王旭,李煜生,等.沉默Toll 样受体4 基因表达的RNAi 慢病毒载体的构建[J].中国组织工程研究与临床康复,2011,15(20):3693-3696.
[17] 陈岩,赖垂金,李雯,等.不同基因转染方法对小鼠内耳毛细胞转染效率的比较[J].听力学及言语疾病杂志,2015,23(2):166-169.
[18] 喻钧,潘铁成,魏翔,等.TLR3 基因RNAi 慢病毒载体的构建与鉴定[J].华中科技大学学报:医学版,2013,42(2):167-171.
[19] 丁震宇,梁后杰.慢病毒载体介导的RNAi 的研究进展[J].医学研究杂志,2009,38(4):15-19.
[20] 孟凡荣,陈琛,万海粟,等.慢病毒载体及其研究进展[J].中国肺癌杂志,2014,17(12):870-876.
[21] Pluta K,Kacprzak MM. Use of HIV as a gene transfer vector [J]. Acta Biochim Pol,2009,56(4):531-595.
