液基细胞学与传统巴氏制片技术在宫颈癌及癌前病变早期筛查中的应用
2015-01-19田玉旺张立英许春伟
田玉旺 张立英 许春伟 张 博
1.北京军区总医院病理科,北京 100700;2.军事医学科学院附属医院病理科,北京 100071
在全球范围内宫颈癌作为最常见恶性肿瘤之一,每年大约有53 万人被诊断为宫颈癌,其中超过27 万人因此而死亡, 约85%的病例发生在发展中国家,其发病率仅次于乳腺癌、肺癌、结直肠癌,居女性恶性肿瘤的第4 位,而每年宫颈癌死亡率仅次于肺癌、乳腺癌、结直肠癌、胰腺癌、卵巢癌和淋巴瘤,居女性恶性肿瘤的第7 位[1]。 随着早婚、早育、多产及性生活紊乱等因素的刺激,宫颈癌发病率逐年上升且发病年龄低龄化,患者年龄分布呈双峰状,35~39 岁和60~64 岁,平均52.2 岁[2]。 目前国内宫颈癌新发病13 万例,患者趋向年轻化,年龄在35 岁以下的宫颈癌患者占到三分之一[3],因此,宫颈癌及其癌前病变的筛查在早期发现、治疗和预防中意义重大。目前,宫颈癌及其癌前病变的筛查已经成为女性体检的一个常规检查项目,重视度越来越高,筛查中传统的巴氏涂片法虽起到非常重要的作用,但其灵敏性不高,假阴性率较低。液基薄层细胞学(TCT)检测技术为近年兴起的一种新技术,在很大程度上弥补了巴氏涂片的不足,为宫颈癌及其癌前病变的诊断提供了可靠依据。本研究旨在对宫颈癌及其癌前病变中TCT 检查与巴氏涂片的临床应用及制片质量进行比较分析。
1 资料与方法
1.1 一般资料
收集2012 年12 月~2013 年12 月北京军区总医院(以下简称“我院”)门诊就诊行宫颈癌筛查患者的TCT 标本6114 例,即TCT 组;随机抽取我院2011 年11 月~2012 年11 月行巴氏涂片检查的6826 例患者标本进行对照,即传统巴氏涂片组。 对两组异常细胞检出者行宫颈组织病理活检,比较两种制片方法的阳性病变检出率及制片质量等。12 940 例样本患者年龄22~69 岁,平均(41.4±3.5)岁,均为已婚妇女。
1.2 仪器及方法
1.2.1 仪器 液基薄层制片系统包括震荡仪、离心制片机、细胞保存液及制片相关试剂均为厦门麦克奥迪医疗诊断系统有限公司生产。
1.2.2 TCT 制片方法 妇科医生在阴道扩张器直视下,用棉签拭去宫颈和阴道表面的分泌物,然后用宫颈刷沿子宫颈外口插入子宫颈管内, 顺时针旋转3~5 圈,取出宫颈刷后,将刷头浸泡于盛有“宫颈细胞保存液”的样本收集管中,旋紧管盖后贴上标签和对应的申请单一起送往病理科检查。取出装有样本的收集管在点触式混匀器上振荡3~5 s,然后取6 mL 标本溶液1500 r/min,离心5 min,弃上清液后用蒸馏水稀释细胞沉淀,在点触式混匀器上再振荡3~5 s 后取2 滴细胞悬液置入小圆底试管,加入100 μL 的细胞分散剂,再次混匀后采用自然悬滴法制片,待晾干后得到直径约1 cm 的薄层细胞涂片,固定液(95%酒精100 mL+冰醋酸1 mL)固定,甲醛60 mL,甲醇320 mL,冰醋酸20 mL。 行HE(苏木精-伊红)或巴氏染色,乙醇脱水,二甲苯透明,中性树胶封片。
1.2.3 传统巴氏直接涂片方法 暴露宫颈,将宫颈刮板插入子宫颈管内,用刮板轻刮,取出后均匀的涂于载玻片上,95%乙醇固定0.5 h,行巴氏染色,乙醇脱水,二甲苯透明,树胶封片后镜下阅片。
1.2.4 细胞学诊断方法 TCT 组诊断参照TBS 分级系统,分为正常、良性细胞学改变(感染、炎症)及宫颈上皮内病变,其中宫颈上皮内病变包括意义不明的不典型鳞状细胞(ASC-US)、低度鳞状上皮内病变(LSIL)、高度鳞状上皮内病变(HSIL)、鳞癌(SCC)和腺癌(AC);以未见上皮内恶性细胞(NILM)为阴性,包括正常、良性细胞改变(感染、炎症),以宫颈上皮内病变表现为阳性[4]。传统巴氏涂片组诊断采用巴氏5 级法,分为Ⅰ、ⅡA、ⅡB、Ⅲ、Ⅳ和Ⅴ,以Ⅰ、ⅡA 级为阴性,ⅡB级及以上表现为阳性[4]。
1.3 涂片满意度评价
由2 名经验丰富的病理医师根据评判标准观察每例涂片的制片质量情况,然后得出标本满意度。 目前妇科细胞学标本满意度评估,采用2001 年修订的Bethesda 报告系统(the Bethesda system,TBS)。满意标准:有足够量的保存好的鳞状上皮细胞。 在常规涂片要求至少有8000 个,TCT 涂片至少有5000 个保存好的、可以明确辨认的鳞状上皮细胞;不满意标准:保存好的鳞状上皮细胞在常规涂片不足8000 个,在TCT 涂片不足5000 个或由于细胞过度重叠、固定差、过度干燥、污染等因素影响75%以上的鳞状上皮细胞观察[5-6]。
1.4 统计学方法
采用SPSS 19.0 统计学软件进行数据分析,计量资料数据用均数±标准差(s)表示,两组间比较采用t 检验;计数资料用率表示,组间比较采用χ2检验及Fisher 确切概率法,以P <0.05 为差异有统计学意义。
2 结果
2.1 两组阳性检出率结果比较
TCT 组共检出异常者(ASC-US 及以上病例)4601 例,包括ASC-US 2545 例、LSIL 1534 例、HSIL 441 例、SCC/AC 81 例,检出率为75.25%;而传统巴氏涂片组在6826 例妇科标本中检出异常者 (ⅡB 及以上病例)4232 例,包括巴氏ⅡB 级2418 例、Ⅲ级1108 例、Ⅳ级554 例、Ⅴ级152 例,检出率为62.00%(4232/6826)。 TCT 组的检出率明显高于传统巴氏涂片组,二者阳性检出率比较差异有统计学意义(P <0.05)。
2.2 两组检查敏感度与特异度比较
对两组异常细胞检出者行宫颈组织病理活检(阴道镜活检),TCT 组阳性者4215 例,其敏感度为84.28%[(4215/(4215+786)],特异度为65.32%[(727/(386+727)];传统巴氏涂片组阳性者2779 例,敏感度为68.80%[(2779/(2779+1260)],特异度为47.87%[1334/(1453+1334)], 两组进行比较,TCT 组检查异常细胞的敏感度与特异度明显优于传统巴氏涂片组,差异有统计学意义(P <0.05)。 见表1、2。

表1 TCT 组检出异常细胞与宫颈组织病理活检相关性比较(例)

表2 传统巴氏涂片组检出异常细胞与宫颈组织病理活检相关性比较(例)
2.3 两组制片质量比较
TCT 组标本满意度为95.31%(5827/6114),传统巴氏涂片组检查标本满意度为75.90%(5181/6826),TCT 组高于传统巴氏涂片组(P <0.05)。 传统巴氏涂片中黏液丝较多,背景污秽,细胞结构显示不清晰,涂片厚薄不均,细胞易重叠,细胞需仔细寻找辨认,见图1。 而TCT 涂片,镜下黏液丝溶解,背景较干净,细胞结构显示清晰,细胞数量明显增多,细胞分布薄层均匀分布,无重叠,容易辨认,阳性细胞不易漏诊。见图2。

图1 传统巴氏涂片结果(巴氏染色,40×)
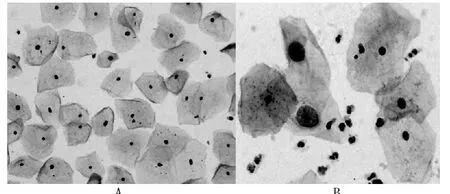
图2 液基细胞学图片结果(液基细胞学涂片,40×)
3 讨论
宫颈癌是最常见的妇科恶性肿瘤之一,因此对宫颈癌的筛查一直受到人们的普遍关注。 随着多产、性生活紊乱、性伴侣过多、人乳头瘤病毒病毒感染等不良习惯和因素刺激导致其发生率不断升高且呈年轻化趋势发展[7]。宫颈上皮内瘤变(CIN)是与子宫颈浸润癌密切相关的一组癌前病变,反映子宫颈癌发生、发展中的连续过程, 其发展为原位癌需要约10 年的过程,而原位癌发展为浸润癌需3~10 年时间,CIN 发展为浸润癌则需要10~15 年甚至更长时间。 原位癌5 年生存率为96%~99%,浸润癌约为67%[8]。 这些数据表明,早期筛查是发现、诊治宫颈癌发生的关键,在防治工作中占有举足轻重的作用,如果早期诊断原位癌或浸润癌,宫颈癌的治愈率可达95%[7]。 多年来,传统的巴氏直接涂片法为早期筛查宫颈癌及癌前病变的主要方法,应用已达数十年[9],曾对提高宫颈癌及其癌前病变的检出率发挥巨大作用,而且成本低,取材方便,方法简便有效。 然而传统的巴氏直接涂片法存在以下缺点:①样本采集采用棉签或软木片,易污染运送人员和工具;②采用直接涂片所收集的细胞只有20%涂在了玻片上,细胞诊断性成分过少;③制片质量差,涂片厚薄不均,细胞重叠严重,检查者阅片时易于疲劳;④涂片时用力过猛使细胞变形;容易干片,造成细胞破裂,难以诊断;⑤丢弃采样器,约有80%的细胞样本被留在取样器上被丢掉[10],可能被发现的异常细胞也被丢掉;⑥细胞标本无法保存,不能再制片;⑦有大量的黏液、红细胞和白细胞覆盖在涂片上,导致涂片背景不清晰和染色不佳,不利于诊断,使检出率受到一定影响,导致其出现假阴性的概率升高[3,11]。临床资料报道,有40%的涂片因涂片质量而影响正确诊断,其假阴性率可高达45%~89%[12]。 传统巴氏涂片的缺点是灵敏度低,国外报道ⅡB 级及以上表现的假阴性率约为20%[13]。在常规巴氏涂片中,有高达53%~90%假阴性的原因是涂片中没有能诊断的细胞[14-15]。
针对传统巴氏直接涂片法存在的问题,细胞学专家近年来又推出了一种新的细胞学制片技术,即TCT制片技术。 它是一种崭新的宫颈癌检查技术,该技术有别于传统巴氏直接涂片法,在制片之前需要将宫颈细胞样本放在“宫颈细胞保存液”中,以防细胞变性并对样本进行前期处理,然后采用先进的液基薄层细胞制片系统,如细胞离心涂片机或膜式超薄细胞制片机进行制片,其特点为:①经“宫颈细胞保存液”处理的标本,几乎100%保存了细胞的形态结构和数量,常温下可保存3 周,且可重复制片;②制片效果好、细胞形态完整、细胞结构清晰、染色鲜艳、细胞分布更均匀且集中、细胞不易重叠、观察省时省力、不易漏诊;③保存液能有效地分解黏液、去除红细胞、减少了炎症细胞的影响,使涂片背景清晰干净;④该保存液常温下保存,12~15 min 内彻底杀灭所有病菌及微生物的活性,确保了操作人员的健康;⑤保存液价格非常便宜,所用试剂易于购买,制片快捷方便,易于普及推广。该技术与传统的细胞学涂片检查相比,TCT 技术取得的标本可靠性强,满意标本数量高,从而增加了宫颈细胞学检查的灵敏度[16-17],增加了宫颈异常细胞的检出率,大大提高了宫颈癌及癌前病变的检出率,降低了假阴性率,但同时增加了假阳性率[18-19]。与传统细胞学检查相比,TCT 与病理组织学诊断结果具有更高的复合率,而且还能用于DNA 倍体分析和免疫组化研究[20],应用范围更广,是目前全世界应用最为广泛的宫颈细胞学检查方法。
本研究结果显示,TCT 组共检出异常者(ASCUS 及以上病例)4601 例,包括ASC-US 2545 例,LSIL 1534 例,HSIL 441 例,SCC/AC 81 例, 检出率为75.25%;而传统巴氏直接涂片组共检出异常者(ⅡB 及以上病例)4232 例,包括巴氏ⅡB 级2418 例,巴氏Ⅲ级1108 例,巴氏Ⅳ级554 例,巴氏Ⅴ级152 例,检出率为62.00%(4232/6826),TCT 制片法的检出率明显高于巴氏直接涂片法,二者阳性检出率比较有统计学意义(P <0.05)。 对两组异常细胞检出者行宫颈组织病理活检(阴道镜活检),TCT 组阳性者4215 例,其敏感度为84.28%,特异度为65.32%;传统巴氏涂片组阳性者2779 例,敏感度为68.80%,特异度为47.87%,两组进行比较,TCT 检出异常细胞的敏感度与特异度明显优于巴氏涂片法,差异有统计学意义(P <0.05)。TCT 组标本满意度为95.31%(5827/6114);传统巴氏涂片组检查标本满意度为75.90%(5181/6826),TCT 组明显高于传统巴氏涂片组。
总而言之,TCT 制片技术的阳性检出率、 敏感度和特异度明显高于传统巴氏涂片法,是早期筛查宫颈癌的理想检诊方法,值得在临床中推广和普及。
[1] Siegel R,Ma J,Zou Z,et al. Cancer Statistics,2014 [J]. CA Cancer J Clin,2014,64(1):9-29.
[2] 章春晓.液基细胞学和巴氏涂片检查对宫颈病变筛查价值对比[J].中国现代医生,2011,49(23):119-120.
[3] 陈国强,韦丽艳.宫颈癌筛查中液基薄层细胞学检查与巴氏涂片法的对比研究[J].国际检验医学杂志,2011,32(17):1996-1997.
[4] 印永祥,赵华,黄望珍.液基细胞学技术与传统细胞学涂片检测宫颈鳞状细胞病变的比较[J].中国妇幼保健,2012,27(8):1234-1236.
[5] Solomon D,Davey D,Kurman R,et al. The 2001 Bethesda System:terminology for reporting results of cervical cytology [J]. JAMA,2002,287(16):2114-2119.
[6] 岳颖,李德昌,任力,等.传统宫颈巴氏涂片与液基细胞薄层涂片的比较[J].内蒙古中医药,2008,16(8):58-61.
[7] 田居祥.妇科液基薄层制片技术和传统宫颈刮片技术对比分析[J].检验医学与临床,2012,9(24):3142-3143.
[8] 翁梅芬,江金香.液基细胞学和巴氏涂片检查对宫颈病变筛查分析[J].中国预防医学杂志,2009,10(6):522-523.
[9] 欧阳艳红,张洁.液基细胞学技术与传统细胞学涂片检测宫颈鳞状细胞病变差异评价[J].社区医学杂志,2012,10(19):1-3.
[10] 史鹏,李金香,张友忠,等.液基细胞学检查与宫颈巴氏涂片的比较[J].陕西医学杂志,2004,33(5):423-425.
[11] 张焱.宫颈液基细胞学检查在宫颈病变诊断中的应用价值[J].中国现代医生,2012,50(6):135-136.
[12] Frable WJ,Austin RM,Greening SE,et al. Medicolegal affairs. International Academy of Cytology Task Force summary. Diagnostic Cytology Towards the 21st Century:an International Expert Conference and Tutorial [J]. Acta Cytol,1998,42(1):76-119,120-132.
[13] Kreuger FA,Beerman H. The screening history of women with cervical cancer in the Rotterdam area [J]. Eur J Epidemiol,2000,16(7):641-645.
[14] Joseph MG,Cragg F,Wright VC,et al. Cyto-histological correlates in a colposcopic clinic:a 1-year prospective study [J]. Diagn Cytopathol,1991,7(5):477-481.
[15] Kristensen GB,Skyggebjerg K D,Holund B,et al. Analysis of cervical smears obtained within three years of the diagnosis of invasive cervical cancer[J].Acta Cytol,1991,35(1):47-50.上接第 页
[16] Treacy A,Reynolds J,Kay EW,et al. Has the ThinPrep method of cervical screening maintained its improvement over conventional smears in terms of specimen adequacy? [J]. Diagn Cytopathol,2009,37(4):239-240.
[17] Beerman H,van Dorst EB,Kuenen-Boumeester V,et al. Superior performance of liquid-based versus conventional cytology in a population-based cervical cancer screening program[J].Gynecol Oncol,2009,112(3):572-576.
[18] Deshou H,Changhua W,Qinyan L,et al. Clinical utility of Liqui-PREP cytology system for primary cervical cancer screening in a large urban hospital setting in China[J].J Cytol,2009,26(1):20-25.
[19] Laiwejpithaya S,Rattanachaiyanont M,Benjapibal M,et al. Comparison between Siriraj liquid-based and conventional cytology for detection of abnormal cervicovaginal smears:a split-sample study[J].Asian Pac J Cancer Prev,2008,9(4):575-580.
[20] Kontzoglou K,Moulakakis KG,Alexiou D,et al. The role of liquid-based cytology in the investigation of colorectal lesions:a cytohistopathological correlation and evaluation of diagnostic accuracy [J]. Langenbecks Arch Surg,2007,392(2):189-195.
