适形调强放疗联合EGFR-TKI治疗晚期非小细胞肺癌的临床观察
2015-01-19郑国平王思本李岱严森祥朱胜裕熊中奎
郑国平 王思本 李岱 严森祥 朱胜裕 熊中奎
适形调强放疗联合EGFR-TKI治疗晚期非小细胞肺癌的临床观察
郑国平 王思本 李岱 严森祥 朱胜裕 熊中奎
目的 评价适形调强放疗联合表皮生长因子受体酪氨酸激酶抑制剂(EGFR-TKI)治疗晚期非小细胞肺癌(NSCLC)的疗效和不良反应。方法 42例初治或复发的IIIB~IV期NSCLC患者,采用三维适形或调强放疗,范围包括原发灶及转移灶。肺原发灶剂量40~60 Gy/20~30次,脑转移灶先行全脑放疗30Gy/10次(或40 Gy/20次),再缩野加量9Gy/3次(或20Gy/10次);骨转移灶放疗30 Gy/10次或40 Gy/20次。自放疗第1天起开始服EGFR-TKI(埃克替尼125mg,2次/d;或吉非替尼250 mg,1次/d;或厄洛替尼150mg,1次/d),直至疾病进展或出现不可耐受的不良反应。放射治疗结束1个月后评价疗效及不良反应。结果 42例患者有效率和疾病控制率分别为28.6%(12/42)、64.3%(27/42);中位疾病进展时间(MTTP)8.1个月,中位生存期(MST)15.5个月。1年和2年生存率分别为58.6%和12.3%。毒副反应以I~Ⅱ级为主,III级不良反应有皮肤的痤疮样皮疹及皮肤搔痒,粒细胞减少、腹泻、食欲减退、贫血,无III级放射性肺炎及食管炎发生。结论 采用适形或调强放疗联合EGFR-TKI治疗晚期非小细胞肺癌治疗有较好的近期疗效及生存,不良反应轻微,多数患者能耐受治疗。
非小细胞肺癌 适形调强放疗 靶向治疗 表皮生长因子受体酪氨酸激酶抑制剂
肺癌的发病率及病死率均高居恶性肿瘤首位,尽管治疗手段不断提高,但目前非小细胞肺癌(NSCLC)患者5年生存率仍不足15%[1]。近年来肺癌分子生物学研究取得突破性进展,尤其以表皮生长因子受体(EGFR)为靶点的酪氨酸激酶抑制剂(TKI)最为突出。在EGFR基因突变阳性的患者中TKI治疗有效率高达70%~80%,明显延长患者无进展生存时间及生活质量[2]。近年来,一些基础及临床研究均证实EGFR-TKI与放射治疗联合具有增效作用,但对EGFR-TKI同步放疗治疗晚期NSCLC的疗效及安全性尚缺乏系统研究。本文回顾性分析了近年采用EGFR-TKI联合同步放疗的42例初治或复发ⅢB~Ⅳ期NSCLC患者的临床资料,以分析其安全性及近期疗效,现报道如下。
1 资料和方法
1.1 一般资料 2011年1月至2014年6月在绍兴第二医院及浙江大学医学院附属第一医院诊治的42例(其中绍兴第二医院26例,浙江大学医学院附属第一医院16例)具有完整随访资料的初治或复发ⅢB~Ⅳ期NSCLC患者,均经细胞学或病理学证实。转移灶根据患者的症状、体征并经CT、MR或PET-CT等检查确诊。男22例,女20例。年龄47~82岁(中位年龄67岁)。功能状态评分(PS)0~1分30例,2分12例。鳞癌12例,腺癌25例,其他5例。ⅢB期5例,Ⅳ期患者转移灶数目均<5个。转移灶主要为肺、脑或骨等;其中单发转移10例,单器官多发转移18例,2~5个器官转移9例,原发灶及转移灶均较局限,不影响放射野设计。
1.2 基因检测及靶向药物 42例患者中有22例经基因检测证实EGFR突变。22例基因突变患者中,3例ⅢB期及9例Ⅳ期患者将靶向联合放疗作为一线治疗方案;另10例为手术、根治性放化疗后转移的患者,入组接受二线治疗。其余的20例中,12例未行基因检测,8例基因检测阴性,均为二线治疗。靶向药物:自放疗第1天起开始服EGFR-TKI,直至疾病进展或出现不可耐受的不良反应。用法:其中服用埃克替尼22例,吉非替尼12例,厄洛替尼8例(埃克替尼125mg,2次/d;或吉非替尼250mg,1次/d;或厄洛替尼150mg,1次/d)。以上3种靶向药物的选择主要受患者入组时间及经济条件等影响,而与病理类型及分期无直接相关。
1.3 放射治疗 所有病灶采用三维适形放疗(3D-CRT)或调强放疗(IMRT)。CT模拟定位,热塑模型固定,西门子Primus H直线加速器,6 MV-X线照射。肺原发灶剂量40~60Gy/20~30次;脑转移灶先行全脑放疗30Gy/10次(或40Gy/20次),再缩野加量9Gy/3次(或20Gy/10次);骨转移灶放疗30Gy/10次或40 Gy/20次。正常组织限制剂量:脊髓≤45Gy,肺V20≤28%,心脏V30≤40%,V40≤30%,脑干≤54Gy,视神经、视交叉及垂体均≤54 Gy。
1.4 评定标准及观察指标 按实体瘤疗效评价标准(RECIST)进行疗效评价,分为完全缓解(CR)、部分缓解(PR)、稳定(SD)和进展(PD)。CR+PR为有效(RR),CR+PR+SD为疾病控制率(DCR)。不良反应评价根据NCI-CTC 3.0评价,分为I~Ⅳ级。无进展生存时间(PFS)定义为患者接受放疗及靶向治疗第1天起至疾病进展的时间。总生存期(OS)定义为患者接受放疗及靶向治疗第l天起至死亡或末次随访的时间。放疗期间每周血常规检查,放射治疗结束1个月后评价疗效及不良反应。以后的随访内容中,体格检查、胸部X线检查(平片或CT)、腹部超声、实验室检查每3个月1次;骨扫描、头颅CT或MRI常规6个月1次;出现新的症状及原有症状加重时随时复查。
1.5 统计学处理 采用SPSS 17.0统计软件,率的比较采用χ2检验。中位生存时间及生存率分析采用Kaplan-Meier法。
2 结果
2.1 近期疗效评价 全组42例患者均可评价疗效,CR 1例,PR 11例,SD 15例,PD 15例,RR为28.6%,DCR为64.3%。42例患者有效率和疾病控制率分别为28.6%(12/42)、64.3%(27/42)。
2.2 随访及生存情况 所有患者都得到随访,末次随访时间为2014年12月31日。截至末次随访,26例已死亡,14例带瘤生存,2例无瘤生存。26例死亡患者中,24例死于肿瘤进展,1例死于脑血管病变,1例死于心力衰竭。全组患者中位疾病进展时间(TTP)8.1个月,中位生存期(MST)15.5个月。1年和2年生存率分别为58.6%和12.3%。42例晚期NSCLC生存曲线见图1。
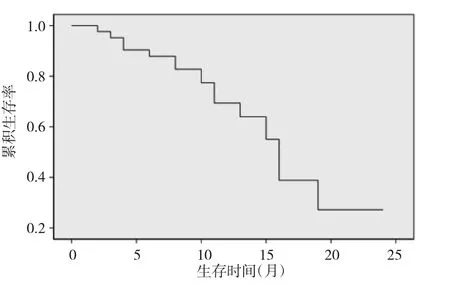
图1 42例晚期NSCLC生存曲线
2.3 不良反应 本组患者不良反应主要表现为皮肤改变、放射性食管炎、放射性肺炎、血白细胞减少、贫血、乏力及腹泻等,以Ⅰ~Ⅱ级为主;Ⅲ级不良反应有皮肤的痤疮样皮疹及皮肤瘙痒,粒细胞减少、腹泻、食欲减退、贫血,无Ⅲ级以上放射性肺炎及食管炎发生;未发生Ⅳ度不良反应,见表1。
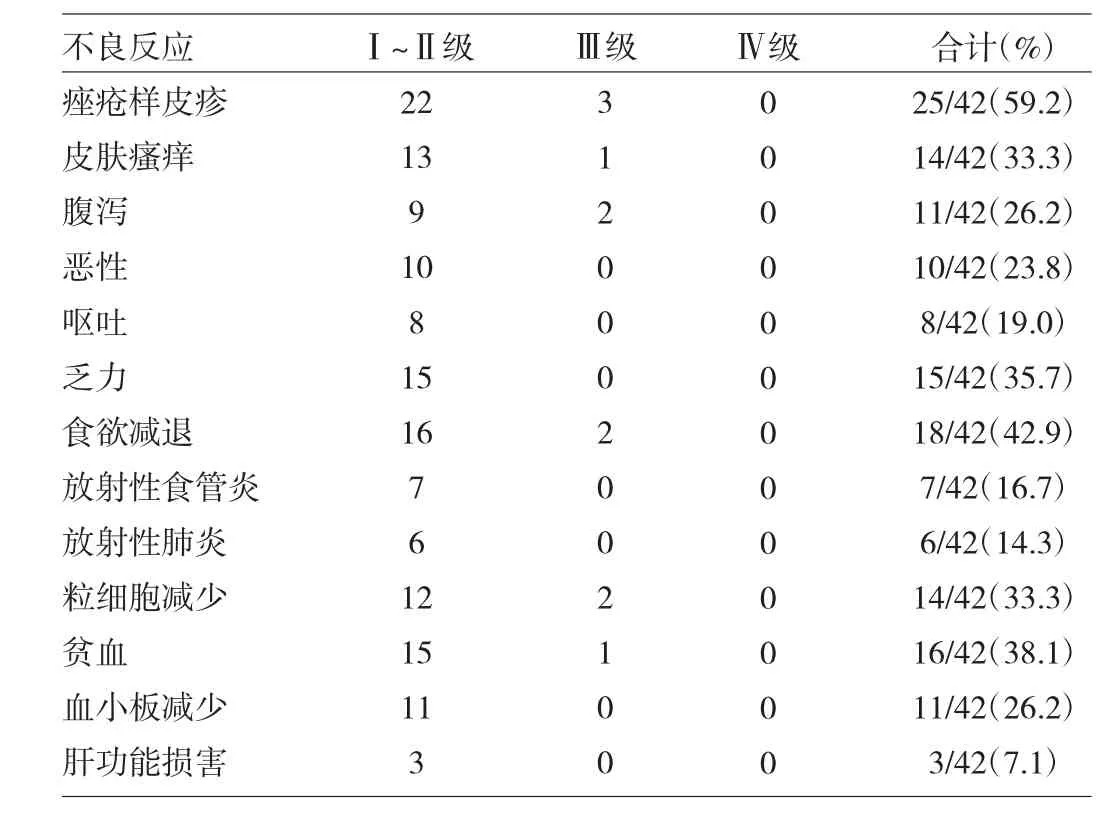
表1 RGFR-TKI同步个体化放射治疗Ⅲ/Ⅳ期NSCLC的不良反应(例)
3 讨论
85%的肺癌为NSCLC,其中2/3在确诊时已失去手术根治的机会,38.1%为Ⅳ期患者[3]。不可手术的Ⅲ期NSCLC的标准治疗方案是同步放、化疗,但不良反应明显,5年生存率仅为13%~20%。近期有多个临床研究探索放化疗加靶向药合联合治疗Ⅲ期NSCLC的临床研究[4-5],认为靶向药物和放、化疗同步是安全的,并使部分患者获益。对于Ⅳ期或经一线治疗失败的转移性NSCLC,治疗目的是提高生活质量、延长生存时间,主要的治疗方法是化疗和靶向治疗。
靶向药物EGFR-TKI通过抑制酪氨酸激酶活性,阻断信号转导,进而抑制肿瘤细胞增殖、侵袭及转移,已被广泛应用于NSCLC的二线及维持治疗[6-7],成为近期治疗晚期NSCLC的重大突破。随着临床对NSCLC基因检测率提高,目前进一步确立了EGFR-TKI在晚期EGFR基因突变型NSCLC一线治疗中的地位[8-9]。本组42例患者无论是初次或二线治疗都积极给予基因检测,但由于部分患者或家属不接受或样本不足等原因仅有30例接受过基因检测。22例基因突变患者中,12例初治者将靶向同步放疗作为一线治疗方案,而其余的30例均是经一线治疗后未控或复发转移的患者。本研究结果显示靶向药物无论是一线或二线使用均能收到良好的效果;正在开展基因突变者与基因阴性或未知者疗效差异的分层研究。
放射治疗是非手术治愈肿瘤的主要方法,在局部晚期肺癌的治疗中占有重要地位。随着放疗设备及技术的进步,放疗靶区的精确性、适形度不断改善,放射治疗在Ⅳ期肺癌治疗中的地位也在不断提高[10]。研究结果显示:不论是针对伴有寡转移NSCLC原发灶的放疗,还是对有限转移病灶进行积极局部治疗都能够改善晚期肺癌患者的生存质量、延长生存时间[11-12]。本组患者虽然大部分为Ⅳ期患者,但在入组过程中排除了广泛转移的患者(转移灶均<5个),为放射治疗的开展提供了基础。放射治疗采用精确的适形或调强治疗技术,提高靶区的精确性;同时予姑息放疗剂量,保护正常组织,最终实现尽可能地减少放疗引起的毒副反应的目的。全组患者都完成计划放疗,与靶向药物同步使用提高了原发灶的局部控制率,改善了由于脑、骨等转移灶引起的临床症状,无放疗引起的Ⅲ级毒性,进一步证实了靶向药物联合放射治疗在治疗晚期NSCLC中的安全性及疗效。
吉非替尼和厄洛替尼两者原理、疗效相当[13]。埃克替尼是参照吉非替尼和厄洛替尼的化学结构设计的EGFR-TKI,其核心结构部分与前两者相似,但具有更好的脂溶性,更易于穿过细胞膜或血脑屏障。临床研究显示,埃克替尼疗效及安全性均优于吉非替尼[14]。本研究中3种靶向药物的选择主要受患者入组时间及经济条件等影响,而与病理类型及分期无直接相关。由于样本量较小,未对3种药物的疗效及不良反应作分层分析。
IPASS研究显示,对于EGFR基因突变的晚期(ⅢB/Ⅳ期)肺腺癌,吉非替尼一线治疗的有效率为71.2%,中位PFS为9.5个月[15]。Wang等[16]研究EGFR-TKI联合放疗同步治疗Ⅲ/Ⅳ期NSCLC(大部分病例未行基因检测),结果显示中位无进展生存期和中位生存期分别为10.2个月和21.8个月。1、2、3年生存率分别为57%、45%、30%。本组有效率和疾病控制率分别为28.6%、64.3%;中位疾病进展时间(TTP)8.1个月,中位生存期(MST)15.5个月。1年和2年生存率分别为58.6%和12.3%。与上述文献报道的结果相比,本研究大多数为Ⅳ期患者,22例有基因突变,但仍取得较好的临床疗效。
本研究中,主要的不良反应以Ⅰ~Ⅱ级为主,患者整体耐受性较好。Ⅲ级不良反应有皮肤的痤疮样皮疹及皮肤瘙痒,粒细胞减少、腹泻、食欲减退、贫血。无Ⅲ级放射性肺炎及食管炎发生,说明在适形调强放疗技术的支持下,合理控制全肺剂量,EGFR-TKI联合同步放疗治疗NSCLC是安全的,并未增加间质性肺病的发生率。
总之,基础研究证实EGFR-TKI具有明确的放射增敏作用。本研究及已有的临床资料显示,精确放疗联合EGFR-TKI治疗晚期NSCLC是安全的,且具有较好的临床疗效,能显著改善患者生活质量,提高肿瘤局部控制率及生存率,可能优于单用EGFR-TKI方案,是治疗晚期NSCLC的一种较好的姑息手段,值得在临床进一步开展前瞻性随机对照研究联合方案的可行性。
[1]Yang P,Allen M S,Aubry M C,et al.Clinical features of 5,628 primary lung cancer patients:experience at Mayo Clinnic from 1997 to 2003[J].Chest,2005,128(1):452-462.
[2]Petrelli F,Borgonovo K,Cabiddu M,et al.Efficacy ofEGFR tyrosine kinase inhibitors in patients with EGFR-mutated non-small cell lung cancer:a meta-analysis of13 randomized trials[J].Clin Lung Cancer,2012,13(2):107-114.
[3]Siegel R,Naishadham D,Jemal A.Cancer statistics,2012[J].CA Cancer J Clin,2012,62(1):10-29.
[4]Ready N,Janne P A,Bogart J,et al.Chemoradiotherapy and gefitinib in stage III Non-small Cell Lung Cancer with epidermal growth factor receptor and KRAS mutation analysis:cancer and leukemia group B(CALEB)30106,a CALGB-stratified phaseⅡtrial[J].Journal of Thoracic Oncology,2010,5(9):1382-1390.
[5]Okamoto I,Takahashi T,Okamoto H,et al.Single-agent gefitinib with concurrent radiotherapy for locally advanced Non-small Cell Lung Cancer harboring mutations of the epidermal growth factor receptor[J].Lung Cancer,2011,72(2):199-204.
[6]Ciuleanu T,Stelmakh L,Cicenas S,et al.Efficacy and safety of erlotinib versus chemotherapy in second-line treatment of patients with advanced,non-small cell lung cancer with poor prognosis (TITAN):a randomized multicentre,open-label,phase 3 study [J].Lancet Oncol,2012,13:300-308.
[7]Cappuzzo F,Ciuleanu T,Stelmakh L,et al.Erlotinib as maintenance treatment in advanced non-small-celllung cancer:a multicentre, randomised, placebo-controlled phase 3 study[J]. Lancet Oncol,2010,11:521-529.
[8]Mok T S,Wu YL,Thongprasert S,et al.Gefitinib or carboplatinpaclitaxel in pulmonary adenocareinoma[J].N Engl J Med,2009, 361:947-957.
[9]Inoue A,Kobayashi K,Usui K,et al.First-line gefitinib for pateints with advanced non-small-cell lung cancer harboring epidermal growth factor receptor mutations without indication for chemotherapy[J].J Clin Oncol,2009,27:1394-1400.
[10]Chen A B,Cronin A,Weeks J C,et al.Palliative radiation therapy practice in patients with metastatic non-small-cell lung cancer: a Cancer Care Outcomes Research and Surveillance Consortium(CanCORS)Study[J].J Clin Oncol,2013,31(5):558-564.
[11]Lopez G J,Gomez D,Zhuang Y,et al.Prognostic impact of radiation therapy to the primary tumor in patients with non-smallcell lung cancer and oligometastasis at diagnosis[J].Int J Radiat Oncol Biol Phys,2012,84(1):e61-e67.
[12]Yao T,Okamoto T,Haro A,et al.Localtreatment of oligometastatic recurrence in patients with resected non-smallcelllung cancer[J].Lung Cancer,2013,82(3):431-435.
[13]Wu J Y,Wu S G,Yang C H,et al.Comparison of gefifinib and erlotinib in advanced NSCLC and the efect of EGFR mutations[J]. Lung Cancer,2011,72(2):205-212.
[14]Sun Y,Shi Y,Zhang L,et al.A randomized,double-blind phaseⅢ study of icotinib versus gefitinib in patients with advanced non-small cell lung cancer(NSCLC)previously treated with chemotherapy(ICOGEN)[J].J Clin Oncol,2011,29(Supp1):abstr 7522.
[15]Mok T S,Wu Y L,Thongprasert S,et al.Gefitinib or carboplatin-paclitaxel in pulmonary adenocarcinoma[J].N Engl J Med,2009,361(10):1-11.
[16]Wang J,Xia T Y,Wang YJ,et al.Prospective study of epidermal growth factor receptor tyrosine kinase inhibitors concurrent with individualized radiotherapy for patients with locally advanced or metastatic non-small cell lung cancer[J].Int J Radiat Oncol Biol Phys,2011,81(3):e59-e65.
Three-dimensional conformal radiotherapy(3D-CRT)or intensity-modulated radiotherapy(IMRT)combined with epidermal growth factor receptor tyrosine kinase inhibitors(EGFR-TKIs)for patients with advanced non-small cell lung cancer
ZHENG Guoping,WANG Siben,LI Dai,et al.
Center of Lung Cancer,Shaoxing Second Municipal Hospital,Shaoxing 312000,China
Objective To evaluate the efficacy and safety of three-dimensional conformal radiotherapy(3D-CRT)or intensity-modulated radiotherapy(IMRT)combined with epidermal growth factor receptor tyrosine kinase inhibitors(EGFR-TKIs)for patients with advanced non-small cell lung cancer(NSCLC). Methods Forty two patients with initial or relapse IIIB-IV stage NSCLC received 3D-CRT or IMRT on primary and metastatic lesions.Radiation dose for thoracic primary lesions was 40~60 Gy/20~30 fractions;and whole brain radiotherapy(WBRT)was administered at a dose 30Gy/10 fractions(or 40 Gy/20 fractions)for brain metastasis,then boost to 9Gy/3 fractions(or 20Gy/10 fractions);the dose for bone metastasis was 30 Gy(10 fractions)or 40 Gy(20 fractions).From d1 of treatment,patients took EGFR-TKIs(Icotinib 125mg,bid;or gefitinib 250 mg,qd;or erlotinib150mg, qd)till tumor progression or unacceptable toxicities.After one month the efficacy and adverse reaction of the treatment were evaluated. Results In 42 cases,the response rate was 28.6%(12/42)and the disease control rate was 64.3%(27/42).Median time to tumor progression(MTTP)was 8.1m;median survival time (MST)was 15.5m.The 1-y and 2-y survival rates were 59.6%and 12.3%respectively.The main toxicities were I-II level,and the III level reactions included acne-like rashes and pruritis,granulocytopenia,diarrhea,loss of appetite,anemia;however radiation pneumonitis or esophagitis were not observed. Conclusion CRT or IMRT combined with EGFR-TKIs is safe and effective for patients with advanced or metastatic NSCLC.
NSCLC 3D-CRT Molecular target therapy EGFR-TKI
2015-02-02)
(本文编辑:田云鹏)
312000 绍兴第二医院肺部肿瘤诊疗中心(郑国平、王思本、李岱、朱胜裕、熊中奎);浙江大学医学院附属第一医院放疗科(严森祥)
