上皮细胞黏附分子在胃癌组织中的表达及其与预后的关系
2015-01-19何琦文叶再元徐继赵仲生王元宇
何琦文 叶再元 徐继 赵仲生 王元宇
●论 著
上皮细胞黏附分子在胃癌组织中的表达及其与预后的关系
何琦文 叶再元 徐继 赵仲生 王元宇
目的 探讨上皮细胞黏附分子(EPCAM)在胃癌组织中的表达及其与胃癌浸润转移及预后的关系,以及EPCAM作为胃癌早期诊断、预后判断和治疗靶点的临床价值。方法 应用免疫组织化学法检测436例胃癌组织及92例癌旁非肿瘤胃黏膜组织中EPCAM的表达情况,分析并探讨EPCAM的表达与临床病理参数及预后的关系。结果 在92例非肿瘤胃黏膜组织中,50例(54.3%)EPCAM蛋白为阴性表达,42例(45.7%)呈弱阳性表达。在436例胃癌组织中,EPCAM蛋白高表达179例(41.1%),低表达257例(58.9%),主要在细胞包膜表达。EPCAM蛋白的表达强度与肿瘤部位、肿瘤大小、Lauren分型、浸润深度、淋巴结分期、TNM分期、淋巴结转移和远处转移密切相关(均P<0.01),而与患者性别、分化程度、组织学类型无关(均P>0.05)。EPCAM高表达患者的5年生存率(57.2%)明显低于EPCAM低表达胃癌患者的5年生存率(17.3%,P<0.05)。I、II和III期EPCAM高表达胃癌患者的5年生存率明显低于EPCAM低表达患者的5年生存率(P<0.05);IV期EPCAM高表达和低表达胃癌患者的5年生存率无统计学差异。EPCAM表达、远处转移和TNM分期(均P<0.05)是胃癌的独立预后因素。结论 EPCAM在胃癌中高表达,且其表达与淋巴结转移、远处转移、肿瘤的TNM分期显著相关,提示EPCAM可以作为胃癌的早期诊断的筛查指标以及治疗的靶点之一。
胃癌 上皮细胞黏附分子 侵袭 转移 预后
胃癌是我国病死率最高的肿瘤之一。经外科手术治疗后,胃癌5年生存率Ⅰ期为83.0%~99.0%,Ⅱ期为48.0%~70.0%,而Ⅳ期仅为25.0%[1]。在我国,大多数患者确诊时已经是Ⅲ或Ⅳ期。肿瘤的淋巴结及远处转移是胃癌患者死亡的最主要原因,对肿瘤进行早期监测,有助于提高胃癌患者的生存率。上皮细胞黏附分子(epithelial cell adhesion molecule,EPCAM)是一个分子量为40kD、含314个氨基酸的钙离子依赖的Ⅰ型跨膜糖蛋白,1979年由Koprowski等[2]首先描述的肿瘤相关抗原。目前关于EPCAM在胃癌组织表达及其临床意义的研究甚少。本研究从蛋白水平探讨EPCAM在92例非肿瘤胃黏膜组织和436例石蜡固定胃癌组织的表达情况及其表达与临床病理参数和预后的关系,旨在明确EPCAM作为胃癌早期筛查指标、预后判断及治疗靶点的临床应用价值。
1 对象和方法
1.1 对象 收集我院2002年1月至2004年12月期间436例胃癌患者的胃癌组织标本,所有病例均经病理证实,术前未经任何治疗。患者中男311例,女125例,男女比例为2.49∶1;年龄17~91岁,中位年龄为60岁;随访起止日期为2002年1月至2008年12月,所有病例随访5年以上,生存期的计算从手术日期到随访截止日期,或由于复发、转移而死亡的日期为止。肿瘤位于贲门55例,胃体163例,胃窦218例;肿瘤<5cm 256例,≥5cm 180例;按Lauren分型:肠型胃癌223例,弥漫型胃癌213例;按WHO 2002年胃癌分类标准分为:乳头状腺癌16例,管状腺癌326例,黏液腺癌29例,印戒细胞癌65例;高分化腺癌13例,中分化腺癌128例,低分化腺癌293例,未分化癌2例;TNM分期:Ⅰ期90例,Ⅱ期104例,Ⅲ期173例,Ⅳ期69例;胃癌淋巴分期:PN0期166例,PN1期136例,PN2期99例,PN3期35例;有远处转移61例,无远处转移375例。并取同期距癌边缘5cm以上的无增生或不典型增生的非肿瘤胃黏膜92例作对照。
1.2 试剂 鼠抗人EPCAM抗体购于abcam公司,广谱二抗试剂盒及DAB显色试剂盒均购于北京中杉金桥生物技术有限公司。
1.3 免疫组织化学染色 按文献[3-4]进行。
1.4 结果判定 EPCAM以细胞膜出现棕黄色颗粒判为阳性,根据染色程度和染色细胞百分率进行评定和分析[5-6]:基本不着色为0分,着色淡为1分,着色适中为2分,着色深为3分;着色细胞占计数细胞的百分率≤5%记0分,6%~25%记1分,26%~50%记2分;≥51%记3分。将每张切片的染色程度与染色细胞百分率得分相乘,其乘积为最后得分。0~1分为阴性(-),2~3分为弱阳性(+),4~6分为中等阳性(++),>6分为强阳性(+++)。在统计分析中,将表达(-/+)划为低表达组,(++~+++)划为高表达组。
1.5 统计学处理 采用SPSS13.0统计软件,计量资料采用表示,两两比较采用t检验,计数资料采用χ2和 Fisher精确概率检验,对生存数据采用Kaplan-Meier分析并绘制生存曲线,应用Log-rank检验差异性,用Cox风险模型进行独立预后因素分析。
2 结果
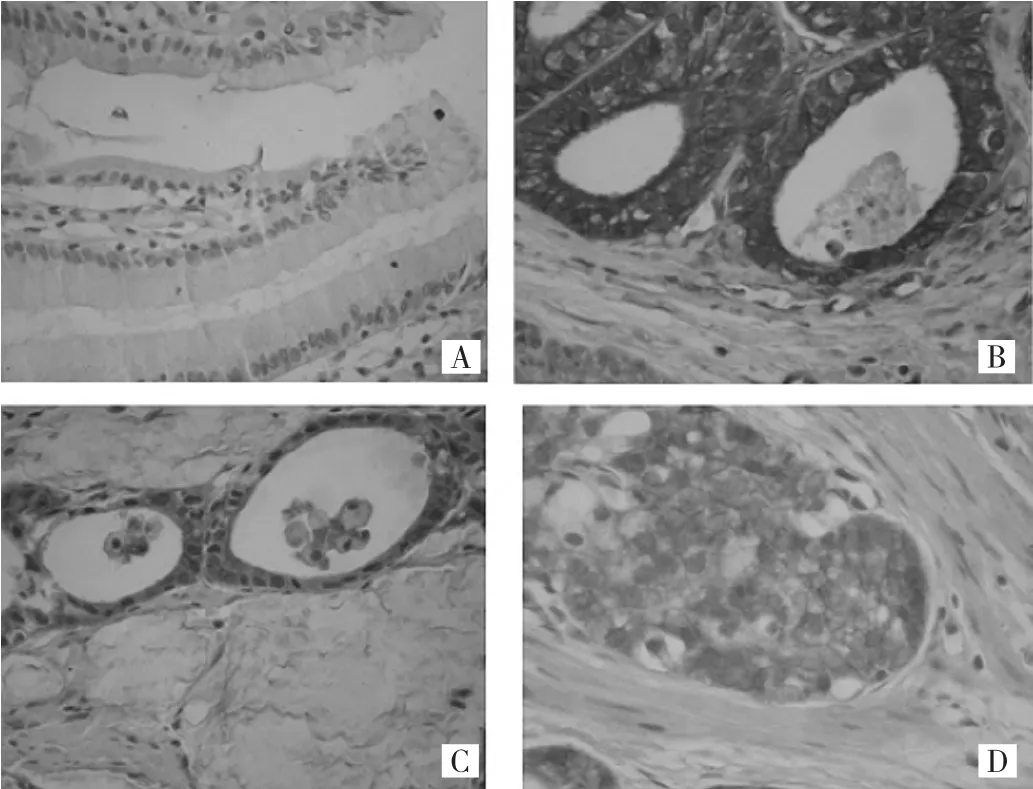
图1 EPCAM在正常胃黏膜和胃癌组织中的表达(A:非肿瘤胃黏膜阴性表达,B:高分化腺癌阳性表达,C:中分化腺癌阳性表达,D:低分化腺癌阳性表达,SP法染色,×400)
2.1 EPCAM在正常胃黏膜和胃癌组织中的表达在92例非肿瘤胃黏膜组织中,50(54.3%)例EPCAM蛋白为阴性表达,42(45.7%)例呈弱阳性表达。在436例胃癌组织中,EPCAM蛋白高表达179(41.1%)例,低表达257(58.9%)例,主要在细胞膜表达,见图1。
2.2 EPCAM在胃癌组织的表达与临床病理参数间的关系 EPCAM蛋白的表达强度与患者的年龄、肿瘤部位、肿瘤大小、Lauren分型、浸润深度、TNM分期、淋巴结转移、远处转移、及淋巴结分期有关(均P<0.01),而与患者性别、分化程度、组织学类型无关(均P>0.05),见表1。EPCAM高表达患者的5年生存率明显低于EPCAM低表达患者的5年生存率(图2,见插页)。
2.3 EPCAM在胃癌组织的表达与预后的关系 Kaplan-meier分析EPCAM高表达和低表达患者总的5年生存率,EPCAM低表达患者的5年生存率(57.2%)明显高于EPCAM高表达患者的5年生存率(17.3%)(P<0.05)。在Ⅰ期,EPCAM高表达患者的5年生存率(57.1%)明显低于EPCAM低表达患者的5年生存率(88.0%)(P<0.05)。在Ⅱ期,EPCAM高表达患者的5年生存率(60.0%)明显低于EPCAM低表达患者的5年生存率(74.2%)(P<0.01)。在Ⅲ期,EPCAM高表达患者的5年生存率(17.3%)明显低于EPCAM低表达患者的5年生存率(33.8%)(P<0.01)。在Ⅳ期,EPCAM高表达患者的5年生存率(3.6%)与EPCAM低表达患者的5年生存率(0.0%)无统计学差异(P>0.05)。独立预后因素分析表明,EPCAM表达(P<0.05)、浸润深度(P<0.05)、淋巴结(P<0.05)、远处转移(P<0.05)和TNM分期(P<0.05)是胃癌的独立预后因素。
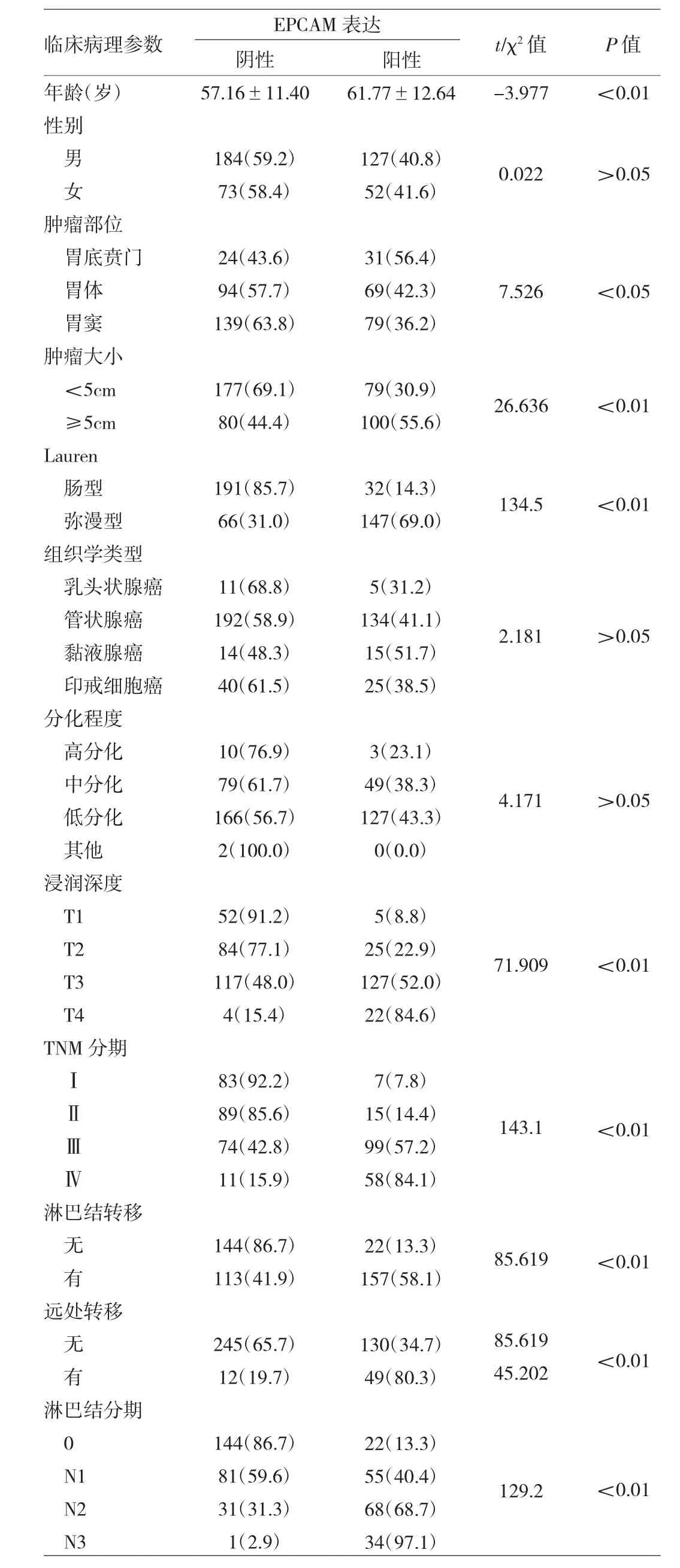
表1 EPCAM在胃癌组织的表达与临床病理参数间的关系[例(%)]
3 讨论
据统计,胃癌病死率仅次于肺癌,居第2位[7]。在我国,胃癌患者5年生存率仍低于40.0%,大多数患者确诊时已经是Ⅲ或Ⅳ期,淋巴结转移率高达50.0%~75.0%[8]。早期诊断及治疗可有效提高患者生存率。EPCAM作为一种肿瘤相关抗原,在上皮细胞来源的快速增殖的肿瘤组织高表达,在各种正常组织表达不一,但表达水平均低于肿瘤组织[9]。在绝大多数的实体肿瘤中,高表达的EPCAM与患者的不良预后有着对应关系[10]。早期的研究表明EPCAM是一个细胞黏附分子。现有研究表明,EPCAM不仅具有黏附分子的功能,还参与细胞信号传导、细胞迁移、增殖和分化[11]。EPCAM在各种实体肿瘤高表达,近年来研究表明EPCAM也是一个肿瘤干细胞标记物,在很多恶性增生的上皮肿瘤中EPCAM表达的强度远远超过正常组织的表达水平。恶性肿瘤组织不但高表达EPCAM分子而且EPCAM阳性细胞无论从数量还是阳性程度上都与肿瘤发展的程度密切相关[12]。EPCAM在转移性胃癌组织表达显著高于非转移性胃癌组织,siRNA下调EPCAM的表达将显著抑制体外胃癌细胞的黏附、侵袭和迁移能力及体内胃癌细胞的转移能力[13]。EPCAM能促进相关肿瘤细胞的远处转移,其单克隆抗体(单抗17-1a)在德国已经被批准许可用于直肠癌的术后辅助化疗,提高了21.0%的7年生存率以及减少了30.0%的复发率[14]。
EPCAM蛋白表达水平在绝大多数的上皮细胞来源的肿瘤中高表达。EPCAM蛋白的高表达与肿瘤不良预后有着密切关系,如肺癌、卵巢癌、胰腺癌、泌尿上皮癌以及胆囊癌[15-18],但在肾癌以及甲状腺癌中高表达的EPCAM蛋白反而有较高的生存率[19-20]。但关于胃癌与EPCAM关系的研究非常少见。本研究就以胃癌的发生、侵袭以及远处转移等方面与EPCAM的关系作为切入点进行研究,发现EPCAM蛋白的表达强度与胃癌的肿瘤部位、肿瘤大小、Lauren分型、浸润深度、淋巴结分期、TNM分期、淋巴结转移和远处转移密切相关,而与患者性别、分化程度、组织学类型无关,EPCAM表达、浸润深度、淋巴结、远处转移和TNM分期是胃癌的独立预后因素。
综上所述,胃癌中EPCAM蛋白与胃癌的发生、侵袭及远处转移关系密切,并与胃癌患者的生存率呈负相关性,这为EPCAM蛋白作为胃癌早期诊断的重要筛查指标、治疗靶点、预后判断及复发监测的候选指标提供了理论基础。
[1]Jung H,Lee H H,Song K Y,et al.Validation of the seventhedition of the american joint committee on cancer TNM staging systemfor gastric cancer[J].Cancer,2011,117(11):2371-2378.
[2]Koprowski H,Steplewski Z,Mitchell K,et al.Colorectal carcinoma antigens detected by hybridomaantibodies[J].Nat Cell Biol,2009,11(2):162-171.
[3]Lee H S,Lee H K,Kim H S,et al.Tumour suppressor gene expression correlates with gastric cancer prognosis[J].J Pathol, 2003,200(1):39-46.
[4]Geisler S A,Olshan A F,Weissler M C,et al.p16 and p53 protein expression as prognostic indicators of survival and disease recurrence from head and neck cancer[J].Clin Cancer Res,2002, 8(11):3445-3453.
[5]Fukuoka J,Fujii T,Shih J H,et al.Chromatin remodeling factors and BRM/BRG1 expression as prognostic indicators in non-smallcelllung cancer[J].Clin Cancer Res,2004,10(13):4314. [6]Jemal A,Siegel R,Xu J,et al.Cancer statistics[J].CA J Clin, 2010,60(5):277-300.
[7]詹文华,韩方海.我国胃癌外科治疗的现状和思考[J].实用肿瘤杂志, 2008,23(2):91-93.
[8]Rajkumar T,Vijayalakshmi N,Gopal G,et al.Identification and validation of genes involved in gastric tumorigenesis[J].Cancer Cell Int,2010,10(1):45.
[9]Vander Gun B T,Melchers L J,Ruiters M H,et al.EpCAM in carcinogenesis:the good,the bad or the ugly[J].Carcinogenesis, 2010,31(11):1913-1921.
[10]Balzar M,Winter M J,De Boer C J,et al.The biology of the 17-IA antigen(Ep-cam)[J].Mol Med,1999,77(10):699-712.
[11]Rajkumar T,Vijayalakshmi N,Gopal G,et al.Identification and validation of genes involved in gastric tumorigenesis[J].Cancer Cell Int,2010,10(1):45.
[12]Zhao Z S,Wang Y Y,Chu Y Q,et al.SPARC is associated with gastric cancer progression and poor survival of patients[J].Clin Cancer Res,2010,16(1):260-268.
[13]Punt C J,Nagy A,Douillard J Y,et al.Edrecolonmab alone or in combination with fluorouracil and folinic acid in the adjuvant treatment of stageⅢ colon cancer.A randomized study[J]. Lancet,2002,360(9334):671-677.
[14]Spizzo G,Went P,Dirnhofer S,et al.High Ep-CAM expression is associated with poor prognosis in node-positive breast cancer[J].Breast Cancer Res,2004,86(3):207-213.
[15]Varga M,Obrist P,Schneeberger S.Overexpression of epithelial cell adhesion molecule antigen in gallbladder carcinoma is an independent marker for poorsurvival[J].Cancer Res,2004, 10(9):3131-3136.
[16]Brunner A,Schaefer G,Veits L,et al.EpCAM overexpression is associated with high-grade urothelial carcinoma in the renalpelvis[J].Anticancer Res,2008,28(1A):125-128.
[17]Scheunemann P,Stoecklein N H,Rehders A,et al.Occult tumor cells in lymph nodes as a predictor for tumor relapse in pancreatic adenocarcinoma.Langenbecks[J].Arch Surg,2008,393 (3):359-365.
[18]Seligson D B.Epithelial cell adhesion molecule(KSA)expression:pathobiology and its role as an independent predictor of survival in renal cell carcinoma[J].Clin Cancer Res,2004,10 (8):2659-2669.
[19]Ralhan R,Cao J,Lim T,et al.EpCAM nuclear localization identifies aggressive thyroid cancer and is a marker for poor prognosis[J].BMC Cancer,2010,10(1):331.
Expression of EPCAM correlated with invasion,metastasis and poor prognosis in patients with gastric cancer
HE Qiwen,YE Zaiyuan,XU Ji,et al.
Department of Gastrointestinal Surgery,Zhejiang People’s Hospitol,Hangzhou 310014,China
Objective To investigate the clinical significance of EPCAM expression in gastric cancer. Methods The expression of EPCAM was detected by immunohistochemistry(SP-9000)in 436 tissue samples of gastric cancer and 92 samples of non-cancerous gastric tissue. Results Low levels of EPCAM protein were detected in 42 of 92(45.7%)non-tumor mucosa samples.High expression of EPCAM protein was detected in 179(41.1%)gastric cancer samples,EPCAM was localized mainly in the cytoplasm of primary cancer.The expression of EPCAM was correlated with age,tumor location,tumor size,Lauren's classification,depth of invasion,distant metastases,regional lymph node stage and TNM stage(P<0.05).EPCAM expression was not correlated with sex,differentiation or histological classification(P>0.05).In stage I,II and III tumors,the 5-year survival rate in patients with high expression of EPCAM was significantly lower than that in patients with low expression(P<0.05).In stage IVtumors,the expression of EPCAM was not correlated with the 5-year survival rate(P>0.05).Cox regression analysis revealed that lymph node and distant metastases(P<0.05),TNM stage(P<0.05)and expression of EPCAM(P<0.05)were independent prognostic factors in patients with gastric carcinoma. Conclusion Expression of EPCAM in gastric cancer is associated significantly with lymph node and distant metastases,and poor prognosis,which indicates that EPCAM may be a useful marker for predicting the development,progression and metastasis of gastric cancer.
Gastric carcinoma EPCAM Invasion Metastasis Prognosis
2014-04-22)
(本文编辑:沈昱平)
浙江省科技计划项目(2011C33009)
310014 杭州,浙江省人民医院胃肠外科(何琦文、叶再元、徐继、王元宇,何琦文为浙江中医药大学硕士研究生),病理科(赵仲生)
叶再元,E-mail:zaiyuanye@163.com
