补骨脂素固体脂质纳米粒的制备及其理化性质考察
2015-01-17张荣华周甜甜邵长丽蔡天革
宁 杰, 张荣华, 杨 丽, 周甜甜, 邵长丽, 蔡 宇*, 蔡天革
(1.暨南大学药学院,广东广州510632;2.辽宁大学生命科学学院,辽宁沈阳110036)
补骨脂素固体脂质纳米粒的制备及其理化性质考察
宁 杰1, 张荣华1, 杨 丽1, 周甜甜1, 邵长丽1, 蔡 宇1*, 蔡天革2*
(1.暨南大学药学院,广东广州510632;2.辽宁大学生命科学学院,辽宁沈阳110036)
目的制备补骨脂素固体脂质纳米粒(PSO-SLN)并对其理化性质进行考察。方法Phenomenex C18色谱柱(250 mm×4.6 mm,4μm),流动相为乙腈-水 (55:45),检测波长245 nm,体积流量1.0 mL/min,进样量20μL。采用高温乳化-低温固化法制备PSO-SLN,利用激光粒度分析仪对粒径、Zeta电位进行考察,透射电子显微镜观察形态,超滤法测定包封率。结果补骨脂素在0.5~16μg/mL质量浓度范围内线性关系良好 (r2=0.999 8)。日内、日间精密度试验的RSD均小于2%,平均回收率98.87%。所制备的PSO-SLN结构圆整,平均粒径(108.7±0.47)nm,Zeta电位(-18.8±0.27)mv。超滤管平均回收率为102.5%,平均包封率为(82.6±0.1)%。结论高温乳化-低温固化法可用于对PSO-SLN的制备。
补骨脂素;固体脂质纳米粒;高温乳化-低温固化法;包封率;超滤法
补骨脂素(psoralen,PSO)是一种天然香豆素类化合物,具有抗肿瘤、雌激素样以及多药耐药等多种药理活性[1-3]。补骨脂素水溶性较差[4],直接口服生物利用度低,将水难溶性药物用固体脂质纳米粒进行包裹可以提高生物利用度[5-6]。固体脂质纳米粒 (SLN)是一种新型的给药系统[7-8],它以生物相容性好的脂质材料作为载体,将药物包裹于脂质中可以有效防止药物的泄露,提高被包裹药物的稳定性。本研究采用高温乳化-低温固化法制备补骨脂素固体脂质纳米粒 (PSO-SLN)并对其理化性质进行考察。
1 仪器与材料
Agilent1200高效液相色谱仪(美国安捷伦公司);UV-2550紫外可见分光光度计 (岛津公司);CP124C万分之一分析电子天平(美国奥豪斯);TECNAI10透射电子显微镜(荷兰飞利浦公司);DF-101S集热式恒温加热磁力搅拌器(河南巩义予华仪器有限公司);激光粒度分析仪 (Zetasizer Nano ZS90,英国Malvern公司);超声波清洗器(昆山市超声仪器有限公司);30KD超滤离心管(Millipore)。
补骨脂素对照品 (批号110739-200613,纯度99%,广州市药品检验所);补骨脂素原料药 (批号 BGZS20140216,纯度98%,南京春秋生物工程有限公司);单硬脂酸甘油酯 (天津市博迪化工有限公司);注射级大豆卵磷脂(上海太伟药业);Labrasol辛酸癸酸聚乙二醇甘油酯(法国Gattefosse);药用级吐温80(阿拉丁试剂有限公司);水为纯净水;甲醇、乙腈为色谱纯,其他试剂均为分析纯。
2 方法与结果
2.1 补骨脂素固体脂质纳米粒的制备 采用高温乳化-低温固化法制备PSO-SLN:称取2.5 mg补骨脂素、120 mg单硬脂酸甘油酯、180 mg大豆卵磷脂、30 mg Labrasol溶于适量无水乙醇中,置于75℃恒温水浴中加热溶解形成油相;同时将吐温80溶解于纯水中形成2.0%的吐温80水溶液作为水相。在75℃条件下,用注射器将油相缓缓注入水相中,在磁力搅拌器1 000 r/min的搅拌条件下搅拌乳化浓缩,当体积浓缩至约1/3体积时,将浓缩液倒入冰水中固化,过0.45μm滤膜即得PSO-SLN,同法可制备空白SLN。
2.2 包封率测定
2.2.1 固体脂质纳米粒包封率测定 采用超滤离心法取补骨脂素固体脂质纳米粒溶液0.5 mL,用甲醇溶解,HPLC法测定药物总量 (w1),另取0.5 m L置于超滤管中,12 000 r/min离心20min,HPLC法测定超滤管外管中游离药物含量 (w2):包封率=(w1-w2)/w1。
2.2.2 超滤管回收率试验 取适量补骨脂素与空白固体脂质纳米粒溶液配制成质量浓度分别为20、50、100μg/mL的样品,各取0.5 mL的上述样品置于超滤管中,12 000 r/m in离心20 min,HPLC法测定超滤管外管中补骨脂素的量,测定3次,所得回收率分别为 (103.2±0.39)%、(100.0±0.97)%、(104.4±0.53)%,平均回收率102.5%,说明超滤法可用于对补骨脂素-固体脂质纳米粒包封率的测定。
按照上述方法,对所制备的补骨脂素-固体脂质纳米粒进行包封率测定,连续测定3次,包封率分别为82.5%、82.6%、82.7%,包封率平均值为 (82.6±0.1)%。
2.3 补骨脂素测定方法
2.3.1 最大吸收波长的选择 以纯甲醇为空白,一定质量浓度的补骨脂素甲醇溶液按照紫外分光光度法在200~400 nm波长范围内扫描,补骨脂素在245 nm处有最大吸收。
2.3.2 色谱条件 Phenomenex C18色谱柱(250 mm×4.6 mm,4μm);流动相 乙腈-水 (55:45);检测波长245 nm;体积流量1.0 mL/min;柱温25℃;进样量20μL。
2.3.3 专属性考察 取空白固体脂质纳米粒与补骨脂素固体脂质纳米粒分别用甲醇溶解,上述溶液分别过0.45μm滤膜后按照 “2.3.2”项色谱条件分别进样20μL,高效液相色谱法测定,见图1。
2.3.4 补骨脂素标准曲线的制备 精密称取干燥至恒定质量的补骨脂素对照品5 mg,加甲醇超声溶解,制成50 μg/mL的标准溶液,分别取上述溶液适量,加甲醇稀释成质量浓度为0.5、1、2、4、8、16μg/mL一系列的标准溶液,按照 “2.3.2”项色谱条件分别进样20μL,以峰面积对补骨脂素质量浓度进行线性回归,得到的标准曲线y= 158.22x+15.881(r2=0.999 8)表明补骨脂素在0.5~16 μg/mL范围内线性关系良好。
2.3.5 精密度试验 取1、4、16μg/mL不同质量浓度的补骨脂素溶液,一日内平行测定5次,RSD分别为1.6%、0.45%、1.27%;连续测定 5 d,RSD分别为 1.7%、0.73%、0.78%,日内、日间精密度均小于2%,精密度良好。
2.3.6 加样回收率试验 取空白固体脂质纳米粒,加入补骨脂素溶液,甲醇定容,配制成质量浓度分别为1、4、16 μg/mL的溶液,过膜,按照 “2.3.2”项色谱条件分别进样20μL测定,计算回收率分别为100.3%、98.75%、97.56%,平均回收率98.87%。
2.3.7 稳定性试验 取质量浓度为4μg/mL的补骨脂素溶液,分别于2、4、6、8、12、24 h进样测定,计算RSD= 1.1% (n=6),稳定性良好。
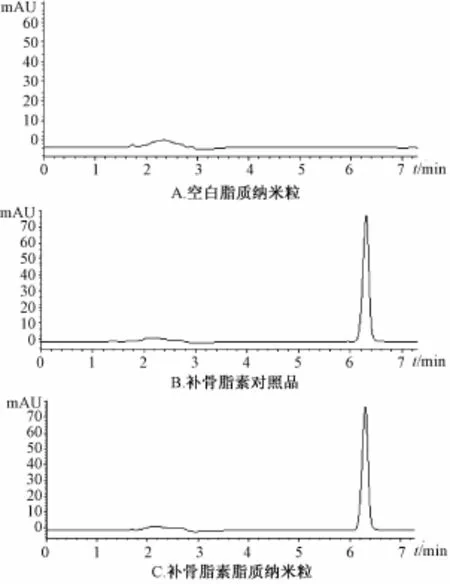
图1 空白SLN、补骨脂素对照品溶液、补骨脂素SLN色谱图
2.4 Zeta电位与粒径测定 将补骨脂素-固体脂质纳米粒分散液稀释适当的倍数,用激光粒度分析仪测定Zeta电位与粒径,所得粒径(108.7±0.47)nm,PDI 0.224±0.015,Zeta电位(-18.8±0.27)mv,见图2。

图2 补骨脂素固体脂质纳米粒Zeta电位及粒径分布图
2.5 补骨脂素SLN形态观察 取补骨脂素-固体脂质纳米粒分散液,将其滴在有碳膜的铜网上,2%磷钨酸染色30 s,铜网晾干之后在透射电子显微镜下观察粒子的形态,补骨脂素-固体脂质纳米粒结构圆整,粒子平均粒径在100 nm左右,见图3。
3 讨论
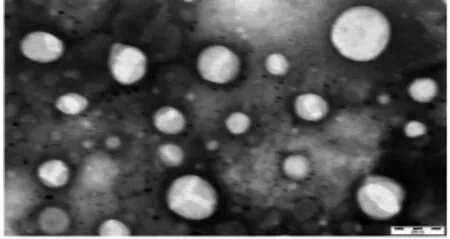
图3 补骨脂素SLN透射电镜图
实验曾采用薄膜超声法与乳化超声法制备固体脂质纳米粒,超声法得到的固体脂质纳米粒粒度分散较大,有可见性颗粒存在,采用高温乳化-低温固化的方法制备固体脂质纳米粒,操作简单,制备的SLN粒度分散好,所以实验选用高温乳化-低温固化法。
实验室常用的固体脂质纳米粒的脂质材料有硬脂酸、单硬脂酸甘油酯以及山嵛酸甘油酯[9-10],本实验采用硬脂酸稳定性极差,放置2 h以上会出现絮凝现象,山嵛酸甘油酯的熔点较高,制备过程需要较高的温度,并且脂质黏度较大,得到的固体脂质纳米粒粒径偏高。用单硬脂酸甘油酯作为载体所制得的固体脂质纳米粒粒径、包封率均较好,所以实验选用单硬脂酸甘油酯作为脂质载体。
包封率的常用测定方法有葡聚糖凝胶柱层析法、超高速离心法以及超滤法[11-12],由于补骨脂素水溶性较差,在采用葡聚糖凝胶柱层析法测定补骨脂素-固体脂质纳米粒包封率的过程中游离药物较难洗脱,并且操作费时费力。单硬脂酸甘油酯的密度约为0.97 g/cm3,密度与水相近,采用高速离心的方法不能实现脂质载体与分散介质的有效分离。本研究选用超滤离心法测定补骨脂素-固体脂质纳米粒包封率,操作简单,结果准确,可用于对补骨脂素-固体脂质纳米粒包封率的测定。
[1]谭 敏,孙 静,赵 红,等.补骨脂素对乳腺癌MCF-7和MDA-MB-231细胞体外作用的比较研究[J].北京中医药大学学报,2009,6(4):259-362.
[2]赵丕文,牛建昭,王继峰,等.补骨脂素的植物雌激素作用及其作用机制探讨[J].中国中药杂志,2008,33(1):59-63.
[3]陈 超,蔡天革,张荣华,等.6种中药活性成分对K562/ADM耐药性逆转及P27和P170蛋白表达影响[J].中成药,2014,36(1):1-4.
[4]郭 洁,宋殿荣.补骨脂香豆素成分研究进展[J].天津中医药,2013,30(4):250-253.
[5]胥 娜,钟文英,朱丹妮.固体脂质纳米粒在提高难溶性药物生物利用度中的应用[J].中华中医药学刊,2007,25(8):1605-1607.
[6]Esposito E,Fantin M,MartiM,et al.Solid lipid nanoparticles as delivery systems for bromocriptine[J].Pharm Res,2008,25(7):1521-1530.
[7]薛 梅,李学军,刘素嬛,等.固体脂质纳米粒在中药研究中的进展[J].南京中医药大学学报,2012,28(6):597-600.
[8]Yoon C,Park JW,Yoon IS.Solid lipid nanoparticles(SLNs)and nanostructured lipid carriers(NLCs):recent advances in drug delivery[J].JPharm Invest,2013,43(5):353-362.
[9]盛欢欢,杨 涛,李 岩,等.HPLC法测定穿心莲总内酯固体脂质纳米粒载药量与包封率[J].中成药,2012,34(3):458-462.
[10]张 卿,张良珂,袁 佩,等.和厚朴酚固体脂质纳米粒的制备及性质研究[J].中草药,2011,42(4):691-693.
[11]赵 锋,栾瀚森,罗华菲,等.葡聚糖凝胶色谱法用于纳米粒包封率的测定[J].中国药学杂志,2012,47(17):1385-1390.
[12]李 园,陈桐楷,林华庆,等.石杉碱甲固体脂质纳米粒包封率的测定方法研究[J].广东药学院学报,2010,26(2):111-114.
R944
B
1001-1528(2015)04-0887-03
10.3969/j.issn.1001-1528.2015.04.045
2014-07-21
国家自然科学基金 (81273707);教育部新世纪优秀人才支持计划 (NECT-12-0677);广东省自然科学基金(S2013010012880);广东省教育厅科研项目 (2013KJCX0021);广州市对外科技合作平台项目 (2014J4500005)
宁 杰(1989—),男,硕士生,从事中药制剂学研究。Tel:18924254326,E-mail:xinxinxiaojie@163.com
*通信作者:蔡 宇 (1972—),男,博士,教授。Tel:15625156405。蔡天革,满族,教授,从事中药逆转肿瘤多药耐药机制研究。Tel:15322249305,E-mail:caitiange@163.com
