津力达颗粒对高脂诱导的胰岛素抵抗ApoE-/-小鼠骨骼肌SREBP-1c的影响
2015-01-17张会欣崔雯雯常丽萍
金 鑫, 张会欣,2*, 崔雯雯,3, 常丽萍
(1.黑龙江中医药大学,黑龙江哈尔滨150040;2.河北以岭医药研究院,河北石家庄050000;3.国家中医药管理局重点研究室 (心脑血管络病),河北 石家庄 050000;4.河北医科大学,河北 石家庄050017;5.河北省络病重点实验室,河北石家庄050000)
津力达颗粒对高脂诱导的胰岛素抵抗ApoE-/-小鼠骨骼肌SREBP-1c的影响
金 鑫1, 张会欣1,2*, 崔雯雯1,3, 常丽萍4,5
(1.黑龙江中医药大学,黑龙江哈尔滨150040;2.河北以岭医药研究院,河北石家庄050000;3.国家中医药管理局重点研究室 (心脑血管络病),河北 石家庄 050000;4.河北医科大学,河北 石家庄050017;5.河北省络病重点实验室,河北石家庄050000)
目的探究津力达颗粒 (人参、黄精、苍术、苦参、麦冬、地黄、何首乌、山茱萸等)对高脂诱导的胰岛素抵抗ApoE-/-小鼠骨骼肌甘油三酯相关基因的影响。方法8只雄性C57BL/6J小鼠设为正常组。40只雄性ApoE-/-小鼠喂养16周后分为模型组、罗格列酮组、津力达颗粒低,中和高剂量组,灌胃给药8周.采用组织游离脂肪酸试剂盒、BCA蛋白浓度法测定骨骼肌游离脂肪酸含量;葡萄糖耐量实验 (OGTT)评价小鼠的胰岛素抵抗程度;实时荧光定量反转录PCR和蛋白质印迹法(Western-blot)测定小鼠骨骼肌胰岛素受体、胰岛素受体底物2、胆固醇调节元件结合蛋白-1c(SREBP-1c)mRNA和蛋白表达。结果津力达颗粒能够降低小鼠的空腹血糖、胆固醇、甘油三酯和低密度脂蛋白胆固醇,升高高密度脂蛋白,下调小鼠骨骼肌游离脂肪酸含量,提高胰岛素敏感指数。同时上调小鼠胰岛素受体和胰岛素受体底物2,下调SREBP-1cmRNA和蛋白表达。结论津力达颗粒能够明显改善小鼠糖耐量异常来改善高脂诱导的ApoE-/-小鼠的胰岛素抵抗。
津力达颗粒;ApoE-/-小鼠;胰岛素抵抗;胰岛素受体;胰岛素受体底物2;胆固醇调节元件结合蛋白-1c(SREBP-1c)
脂毒性在2型糖尿病的发生发展中所起到的作用日益受到大家的关注[1]。所谓 “脂毒性”指的是过多的脂质沉积超过了脂肪组织本身的储存能力而转移到非脂肪组织,如骨骼肌等,导致脂肪的异位沉积,促使胰岛素的外周作用和分泌功能受到损害[2]。迄今为止脂毒性导致胰岛素抵抗的机理尚未明确[3]。SREBP-1c是调控脂肪酸合成和细胞内脂质含量的关键因子[4-5]。因此,探讨SREBP-1c的作用,能够为了解胰岛素抵抗的能量代谢过程提供实验依据。
1 药品与试剂
津力达颗粒由人参、黄精、苍术 (炒)、苦参、麦冬、地黄、何首乌、山茱萸、茯苓、佩兰、黄连、知母、淫羊藿、丹参、葛根、荔枝核、地骨皮等十七味中药组成,石家庄以岭药业股份有限公司提供,批号120429;盐酸罗格列酮片由贵州圣济堂制药有限公司生产,批号20120202;组织游离脂肪酸测定试剂盒购自南京建成科技有限公司;胰岛素受体(INSR)、胰岛素受体底物2(IRS-2)和胆固醇调节元件结合蛋白-1c(SREBP-1c)抗体均购于abcam公司;INSR、IRS-2、SREBP-1c引物由上海生工生物公司合成。
1.1 实验动物 ApoE-/-小鼠、C57BL/6J小鼠,雄性,18~20 g,SPF级,均购自北京大学医学部,许可证号SCXK(京)2011-0012,动物合格证号C57BL/6J小鼠(0302333),ApoE-/-小鼠(0302331)。
1.2 实验饲料 实验基础饲料购自河北医科大学实验动物中心,热量组成为蛋白质24.2%,碳水化合物65.5%,脂肪10.3%,总热量为348 kcal/ 100 g;参照文献 [6]自制高脂饲料,热量组成为蛋白质占20.1%,碳水化合物20.1%,脂肪59.8%,总热量为501 kcal/100 g。
1.4 实验方法
1.4.1 动物分组 8只雄性C57BL/6J小鼠设为正常组,给予正常饲料;40只雄性ApoE-/-小鼠,给予高脂饲料,喂养16周后,分为5组:模型组、罗格列酮组、津力达高剂量组、津力达中剂量组、津力达低剂量组,津力达用纯水配制,参照文献[6]按照小鼠体质量高剂量3.8 g/kg,中剂量1.9 g/kg,低剂量0.95 g/kg进行灌胃给药,盐酸罗格列酮片按1.33 mg/kg灌胃给药。正常组和模型组给予纯水,连续8周,处死小鼠后,留取血清、骨骼肌标本,-80℃保存备用。
1.4.2 血清生化指标检测 空腹血糖、甘油三酯、胆固醇、低密度脂蛋白胆固醇、高密度脂蛋白胆固醇水平采用全自动生化分析仪检测。
1.4.3 骨骼肌游离脂肪酸检测 采用游离脂肪酸测试盒检测小鼠骨骼肌游离脂肪酸含量,BCA法测定蛋白浓度校正骨骼肌游离脂肪酸含有量,实验严格按照说明书操作。
1.4.4 胰岛素敏感性评价
1.4.4.1 空腹胰岛素水平和胰岛素敏感指数 空腹胰岛素水平测定采用放射免疫分析法检测,计算胰岛素敏感指数评价其胰岛素抵抗程度,胰岛素敏感指数=1/(空腹血糖×空腹胰岛素)。
1.4.4.2 小鼠葡萄糖耐量实验评价小鼠的胰岛素敏感性 小鼠饲养24周后,禁食不禁水14~16 h,尾部采血,测定空腹血糖,记为小鼠葡萄糖耐量实验0min的血糖值,随后各组小鼠口服30%的葡萄糖溶液,用微量血糖仪测定30、60、120 min血糖水平。
1.4.5 骼肌INSR、IRS-2、SREBP-1cmRNA表达水平检测 参照文献[6]取小鼠骨骼肌组织匀浆并用Trizol法提取总RNA后,反转录反应。采用实时荧光定量反转录PCR(RT-PCR)方法检测小鼠骨骼肌胰岛素受体 (INSR)、胰岛素受体底物2(IRS-2)、胆固醇调节元件结合蛋白-1c(SREBP-1c)的表达。
内参β-actin及各目的基因引物序列如下:
INSR正向引物TTTGCCCAACCATCTGTAAG,反向引物GACCATCCAGGTAGAAGTTTCG;IRS-2正向引物TCTCTGGCAGTTCAGGTCG,反向引物AGTCCTCTGGGTAAGGGTTG;SREBP-1c正向引物CAAAGAGGAGATTGGCATTG,反向引物TGCGTGTGGAGAAGTAGATGT。反应结束后,按照各反应孔Ct值,以β-actin基因为内参,根据公式2-ΔCt计算各样品目的基因相对表达量。
1.4.6 骨骼肌INSR、IRS-2、SREBP-1c蛋白表达水平测定 小鼠骨骼肌胰岛素受体 (INSR)、胰岛素受体底物2(IRS-2)、胆固醇调节元件结合蛋白-1c(SREBP-1c)蛋白表达水平采用Western blot法测定。参照文献 [6]取骨骼肌组织100 mg,加入1 mL裂解液,充分裂解并采用改良酚试剂法定量。取30μg进行SDS聚丙烯酰胺凝胶电泳,完毕后进行半干转膜,转膜完毕,取出聚偏氟乙烯膜室温封闭2 h,将封闭后的PVDF聚偏氟乙烯膜置入稀释的一抗溶液中,4℃缓慢摇动过夜。洗膜后将聚偏氟乙烯膜置入适量稀释的辣根过氧化物酶标记的二抗溶液中,室温反应2 h。抗体结合区带用化学发光法检测。以目的蛋白的IOD与β-actin的IOD比值表示该样品的目的蛋白相对含量。
1.4.7 统计学处理 用SPSS 13.0统计软件进行分析各项数据资料以表示,组间比较采用单因素方差分析,以P<0.05表示差异有统计学意义。
2 结果
2.1 血清生化指标比较 与正常组相比,模型组小鼠血糖、胆固醇、甘油三酯、低密度脂蛋白胆固醇明显升高,高密度脂蛋白胆固醇明显降低,差异均有统计学意义 (P<0.05);与模型组相比,罗格列酮组、津力达高剂量组小鼠血糖水平明显降低(P<0.05);罗格列酮组、津力达不同剂量组小鼠胆固醇、甘油三酯明显降低 (P<0.05);津力达高剂量组低密度脂蛋白胆固醇明显降低 (P<0.05);津力达中剂量组、高剂量组小鼠高密度脂蛋白胆固醇升高 (P<0.05)。见表1。
表1 津力达对血液生化指标的影响 ()Tab.1 Effects of JLD on biochem ical parameters in blood()
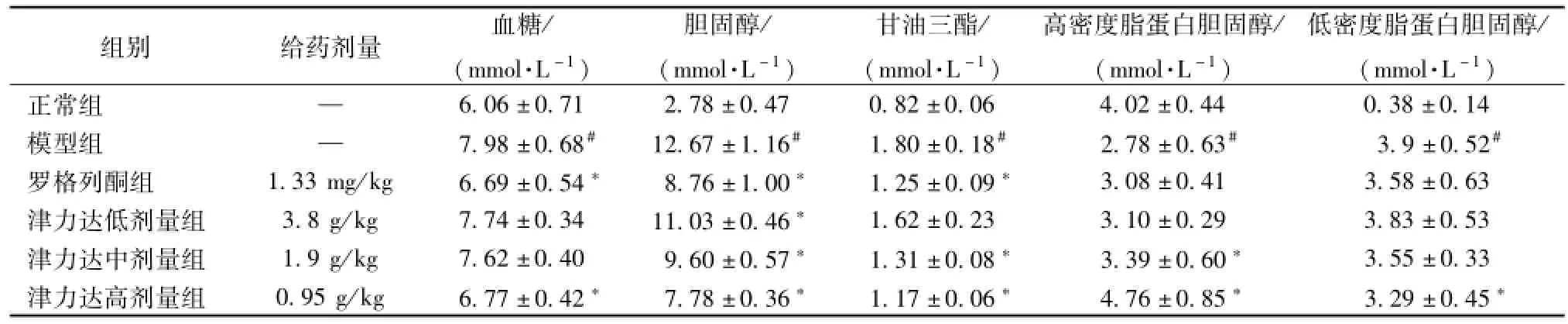
表1 津力达对血液生化指标的影响 ()Tab.1 Effects of JLD on biochem ical parameters in blood()
注:与正常组比较,#P<0.05,与模型组比较,*P<0.05
组别 给药剂量 血糖/(mmol·L-1)胆固醇/(mmol·L-1)甘油三酯/(mmol·L-1)高密度脂蛋白胆固醇/(mmol·L-1)低密度脂蛋白胆固醇/(mmol·L-1)正常组 —6.06±0.71 2.78±0.47 0.82±0.06 4.02±0.44 0.38±0.14模型组 — 7.98±0.68# 12.67±1.16# 1.80±0.18# 2.78±0.63# 3.9±0.52#罗格列酮组 1.33 mg/kg 6.69±0.54* 8.76±1.00* 1.25±0.09* 3.08±0.41 3.58±0.63津力达低剂量组 3.8 g/kg 7.74±0.34 11.03±0.46* 1.62±0.23 3.10±0.29 3.83±0.53津力达中剂量组 1.9 g/kg 7.62±0.40 9.60±0.57* 1.31±0.08* 3.39±0.60* 3.55±0.33津力达高剂量组 0.95 g/kg 6.77±0.42* 7.78±0.36* 1.17±0.06* 4.76±0.85* 3.29±0.45*
2.2 骨骼肌游离脂肪酸含量比较 与正常组相比,模型组小鼠骨骼肌游离脂肪酸水平明显升高,差异均有统计学意义 (P<0.05);与模型组比较,罗格列酮组、津力达各剂量组小鼠骨骼肌游离脂肪酸水平均明显降低 (P<0.05)。见表2。
2.3 胰岛素敏感性评价
2.3.1 空腹胰岛素和胰岛素抵抗指数 与正常组相比,模型组空腹胰岛素水平升高,胰岛素抵抗指数升高 (P<0.05),与模型组比较,罗格列酮组、津力达低、中、高剂量组空腹胰岛素水平、胰岛素抵抗指数明显下降,结果具有统计学意义 (P<0.05)。见表3。
表2 津力达对骨骼肌游离脂肪酸的影响 ()Tab.2 Effects of JLD on skeletalmuscle of the FFA()

表2 津力达对骨骼肌游离脂肪酸的影响 ()Tab.2 Effects of JLD on skeletalmuscle of the FFA()
注:与正常组比较,#P<0.05;与模型组比较,*P<0.05
组别 给药剂量 骨骼肌游离脂肪酸/(mmol·L-1)正常组 —12.32±4.01模型组 — 98.19±18.23#罗格列酮组 1.33 mg/kg 27.61±6.44*津力达低剂量组 0.95 g/kg 62.55±10.26*津力达中剂量组 1.9 g/kg 41.16±6.97*津力达高剂量组 3.8 g/kg 27.57±5.30*
表3 津力达对血清胰岛素和胰岛素敏感指数的影响 ()Tab.3 Effects of JLD on FIns and ISI()

表3 津力达对血清胰岛素和胰岛素敏感指数的影响 ()Tab.3 Effects of JLD on FIns and ISI()
注:与正常组比较,#P<0.05;与模型组比较,*P<0.05
胰岛素敏感指数正常组 —组别 给药剂量 血清胰岛素/(mU·L-1)26.14±7.97 -5.01±0.43模型组 — 145.28±8.22# -7.05±0.12#罗格列酮组 1.33 mg/kg 60.46±9.03* -5.99±0.18*津力达低剂量组 3.8 g/kg 121.82±2.33* -6.85±0.05*津力达中剂量组 1.9 g/kg 95.13±8.18* -6.58±0.09*津力达高剂量组 0.95 g/kg 63.94±10.04* -6.06±0.21*
2.3.2 小鼠葡萄糖耐量实验 各组小鼠糖耐量于口服葡萄糖30 min后出现血糖水平升至高峰,以后逐渐降低;与正常组相比模型组各时间点的血糖水平均有明显升高;与模型组小鼠比较,津力达各组小鼠血糖升高峰值明显降低,降低血糖时间缩短,与模型组相比差异显著。见表4。
表4 津力达对葡萄糖耐量的影响 ()Tab.4 Effect of JLD on glucose tolerance()
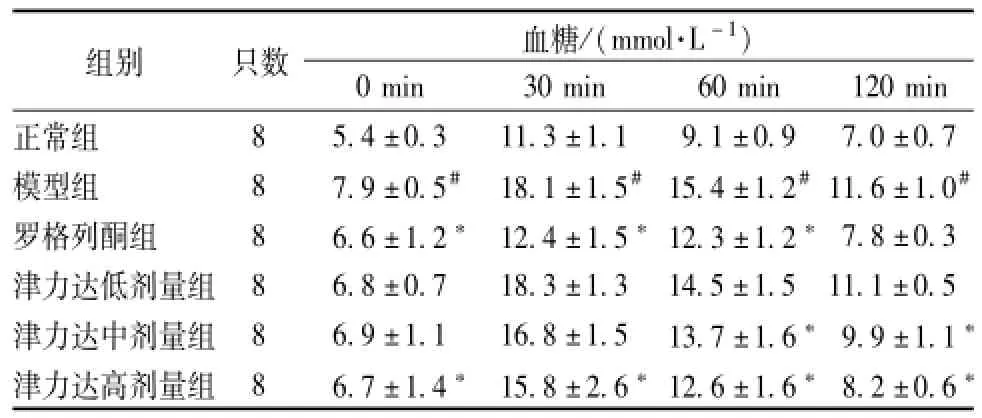
表4 津力达对葡萄糖耐量的影响 ()Tab.4 Effect of JLD on glucose tolerance()
注:与正常组比较,#P<0.05;与模型组比较,*P<0.05
0 min 30 min 60 min 120 min正常组组别 只数 血糖/(mmol·L-1)8 5.4±0.3 11.3±1.1 9.1±0.9 7.0±0.7模型组 8 7.9±0.5# 18.1±1.5#15.4±1.2#11.6±1.0#罗格列酮组 8 6.6±1.2* 12.4±1.5*12.3±1.2*7.8±0.3津力达低剂量组 8 6.8±0.7 18.3±1.3 14.5±1.5 11.1±0.5津力达中剂量组 8 6.9±1.1 16.8±1.5 13.7±1.6*9.9±1.1*津力达高剂量组 8 6.7±1.4* 15.8±2.6*12.6±1.6*8.2±0.6*
2.4 骨骼肌INSR、IRS-2、SREBP-1c mRNA水平比较 与正常组比较,模型组骨骼肌INSR、IRS-2水平均明显低于正常组,SREBP-1c明显升高(P<0.05);与模型组比较,罗格列酮组、津力达中、高剂量组INSR、IRS-2 mRNA水平明显上升(P<0.05);津力达各个剂量组SREBP-1c mRNA水平均明显降低(P<0.05)。见表5。
2.5 骨骼肌INSR、IRS-2、SREBP-1c蛋白表达比较 与正常组相比,模型组INSR、IRS-2蛋白表达均有明显降低,SREBP-1c蛋白水平明显升高,差异具有统计学意义 (P<0.05);与模型组相比,罗格列酮组、津力达各组INSR蛋白水平明显升高,罗格列酮组、津力达高、中剂量组的IRS-2蛋白表达明显升高,津力达中、高剂量组SREBP-1c蛋白水平明显降低,差异有统计学意义 (P<0.05)。见表6,图1。
表5 津力达对INSR、IRS-2、SREBP-1cm RNA表达的影响 ()Tab.5 Effects of JLD on INSR,IRS-2 and SREBP-1c m RNA expression()

表5 津力达对INSR、IRS-2、SREBP-1cm RNA表达的影响 ()Tab.5 Effects of JLD on INSR,IRS-2 and SREBP-1c m RNA expression()
注:与正常组比较,#P<0.05;与模型组比较,*P<0.05
INSR IRS-2 SREBP-1c正常组 —组别 给药剂量1.04±0.18 1.03±0.15 1.00±0.1模型组 — 0.26±0.04#0.24±0.04# 5.52±0.74#罗格列酮组 1.33 mg/kg 0.79±0.14*0.51±0.08* 5.08±0.55津力达低剂量组 3.8 g/kg 0.31±0.06 0.32±0.05 2.67±0.35*津力达中剂量组 1.9 g/kg 0.49±0.09*0.57±0.09* 2.18±0.21*津力达高剂量组 0.95 g/kg 0.60±0.10*0.74±0.12* 2.06±0.26*
表6 津力达对INSR、IRS-2、SREBP-1c蛋白表达的影响()Tab.6 Effects of JLD on INSR,IRS-2 and SREBP-1c protein expression()
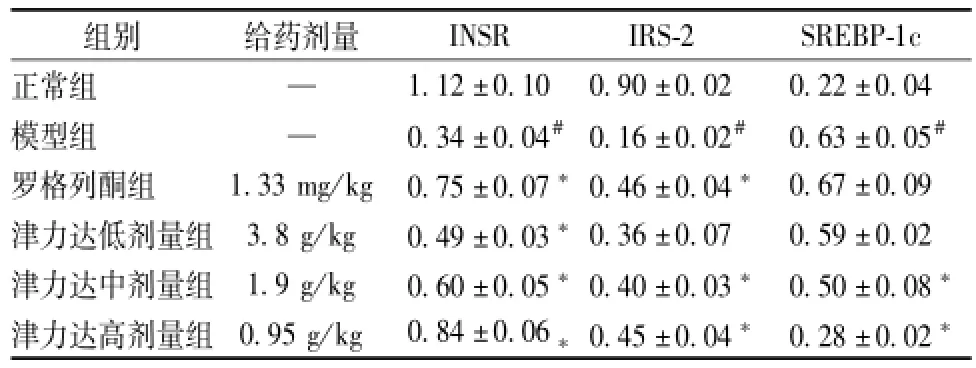
表6 津力达对INSR、IRS-2、SREBP-1c蛋白表达的影响()Tab.6 Effects of JLD on INSR,IRS-2 and SREBP-1c protein expression()
注:与正常组比较,#P<0.05;与模型组比较,*P<0.05
INSR IRS-2 SREBP-1c正常组 —组别 给药剂量1.12±0.10 0.90±0.02 0.22±0.04模型组 — 0.34±0.04#0.16±0.02# 0.63±0.05#罗格列酮组 1.33 mg/kg 0.75±0.07*0.46±0.04* 0.67±0.09津力达低剂量组 3.8 g/kg 0.49±0.03*0.36±0.07 0.59±0.02津力达中剂量组 1.9 g/kg 0.60±0.05*0.40±0.03* 0.50±0.08*津力达高剂量组 0.95 g/kg 0.84±0.06*0.45±0.04* 0.28±0.02*
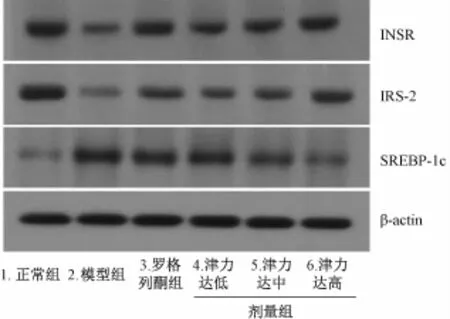
图1 津力达对INSR、IRS-2、SREBP-1c蛋白表达的影响Fig.1 E ffects of JLD on protein expression of INSR,IRS-2 and SREBP-1c in skeletalmuscle
3 讨论
胰岛素抵抗 (IR)指的是正常剂量的胰岛素产生低于正常生物学效应的一种状态,也就是胰岛素对其靶器官的敏感性下降[7]。没有高脂诱导的ApoE-/-小鼠,就会产生很明显的脂代谢紊乱[8],经过长期高脂诱导之后,发现模型组小鼠相对于正常组的血脂水平明显升高;胰岛素敏感指数明显下降,小鼠的糖耐量实验都表明模型组小鼠产生了明显的胰岛素抵抗特征;骨骼肌的游离脂肪酸含量明显上升。而津力达能够不同程度的改善小鼠的以上指标,可以看出津力达具有一定的改善胰岛素抵抗的作用。
胰岛素抵抗的发生是一个十分复杂的过程,其牵涉到复杂的胰岛素信号网络的共同作用,任何一个环节发生改变都可能会产生胰岛素抵抗。INSR存在于多数哺乳动物的细胞表面,是胰岛素信号的起始部位。胰岛素到达靶细胞后,与其表面的INSR的α亚基特异性结合,构型改变,导致酪氨酸激酶活化,激活β亚基,导致受体磷酸化激活IRS。然后被磷酸化的 IRS与 p85结合,激活PI3K,再激活葡萄糖转运因子,促进糖的转运活动[9-10]。INSR和IRS在胰岛素的信号转导过程中起到十分重要的作用。2型糖尿病的患者普遍存在INSR蛋白、基因不同程度的下降,可见INSR在胰岛素信号转导过程中的重要性。IRS在胰岛素的信号传导过程中也起到十分重要的作用,其中IRS的家族成员中主要有IRS-1和IRS-2广泛分布在外周组织中。有实验发现,剔除IRS-1基因纯合子的大鼠只发生胰岛素抵抗,血糖变化不明显;而敲除IRS-2的纯合子大鼠不仅胰岛素抵抗严重,而且血糖升高明显,我们可以猜测在胰岛素信号转导的过程中,IRS-2的作用可能较IRS-1更为重要[11]。本实验研究发现,HF组的INSR和IRS-2的蛋白和mRNA含量明显下降,而津力达能够不同程度的增加INSR和IRS-2的表达,从而改善胰岛素的传导过程来调节外周脂代谢,从这一点我们推测津力达改善小鼠骨骼肌的胰岛素抵抗可能与这个原因有关,其具体机制仍需进一步研究。
SREBP-1c作为骨骼肌细胞内调节糖代谢和调控脂肪酸的转录因子,参与调控脂肪酸合成酶、己糖激酶Ⅱ、乙酰辅酶A羧化酶2,能够调控细胞内脂质含量,控制脂肪酸的合成。有研究证明:胰岛素可以调节SREBP-1c的水平。高糖可以诱导SREBP-1c的表达[12];早期胰岛素治疗后肌细胞的脂质合成减少,SREBP-1c的蛋白和mRNA含量均降低[13]。骨骼肌的SREBP-1c表达增加会促进脂质合成,增加细胞内脂质的含量,促进脂毒性的产生。本实验发现,模型组小鼠骨骼肌内游离脂肪酸含量明显高于正常组组,并且SREBP-1c的蛋白和基因水平发生上调。津力达干预的小鼠骨骼肌内SREBP-1c基因、蛋白水平发生不同程度的下调,可能是由于津力达能够下调SREBP-1c的表达,因此而减少津力达小鼠骨骼肌内的脂质沉积,降低其脂毒性,以改善胰岛素抵抗,但其具体机制还不是很明确。在胰岛素抵抗和糖尿病的动物模型中,IRS-2的基因敲除鼠均可观察到SREBP-1c在肝脏的过度表达[14]。大量研究证明,SREBP-1c的过度表达可以抑制IRS-2和糖原合成酶基因的的表达,但是这些研究大多集中在肝脏上,对骨骼肌的研究关注较少。本实验中模型组小鼠骨骼肌的IRS-2的表达下降,可能和SREBP-1c的过度表达或者直接参与抑制骨骼肌胰岛素信号通路的作用有关,仍需进一步研究。
[1]McGarry JD.Banting lecture 2001 Dysregulation of fatty acid metabolism in the etiology of type 2 diabetes[J].Diabetes,2002,51(1):7-18.
[2]Raz I,Eldor R,Cernea S,et al.Diabetes:insulin resistance and derangements in lipid metabolism.Cure through intervention in fat transportand storage[J].DiabetesMetab Res,2005,21(1):3-14.
[3]李映红,郭文鹏,戎志斌,等.糖胰敏对实验性胰岛素抵抗糖尿病大鼠脂毒性和胰岛素抵抗的影响[J].中国中医药科技,2014,21(2):128-131.
[4]Krebs M,Roden M.Molecularmechanisms of lipid‐induced insulin resistance inmuscle,liver and vasculature[J].Diabetes ObesMetab,2005,7(6):621-632.
[5]Ferre P,Foufelle F.SREBP-1c transcription factor and lipid homeostasis:clinical perspective[J].Horm Res,2007,68(2):72-82.
[6]金 鑫,张彦芬,秘 尧,等.津力达对高脂诱导的胰岛素抵抗ApoE-/-小鼠骨骼肌胆固醇相关基因的影响[J].中国药理学通报,2014,25(11):1415-1420.
[7]戴 冰,邢 瑞,周方亮,等.六味地黄汤及其水提醇沉物对2型糖尿病大鼠胰岛素抵抗的影响[J].中成药,2014,36(3):608-610.
[8]Phillips JW,Barringhaus K G,Sanders JM,et al.Rosiglitazone reduces the accelerated neointima formation after arterial injury in amouse injurymodel of type 2 diabetes[J].Circulation,2003,108(16):1994-1999.
[9]严哲琳,董正平,孙 文,等.翻白草水提液对2型糖尿病胰岛素抵抗大鼠糖脂代谢的影响[J].中国实验方剂学杂志,2012,18(7):216-219.
[10]牛燕媚,刘艳辉,李慧阁,等.胰岛素受体底物蛋白l及其丝氨酸磷酸化活性在胰岛素抵抗发生中的作用[J].中国糖尿病杂志,2012,20(2):136.
[11]彭定琼,高 妍.Ⅱ型糖尿病病人脂肪组织胰岛素受体底物1和含2个SH2结构的蛋白酪氨酸磷酸酶的蛋白表达[J].中华内科杂志,2000,39(11):739-742.
[12]Commerford SR,Peng L,DubéJ J,et al.In vivo regulation of SREBP-1c in skeletalmuscle:effects of nutritional status,glucose,insulin,and leptin[J].Am JPhysiol Regul Integr Comp Physiol,2004,287(1):218-227.
[13]Bi Y,Cai M,Liang H,et al.Increased carnitine palmitoyl transferase1 expression and decreased sterol regulatory elementbinding protein 1c expression are associated with reduced intramuscular triglyceride accumulation after insulin therapy in highfat-diet and streptozotocin-induced diabetic rats[J].Metabolism,2009,58(6):779-786.
[14]毕 艳,朱大龙,翁建平.胆固醇调节元件结合蛋白-1c与胰岛素抵抗——早期胰岛素治疗改善胰岛素抵抗的可能分子机制[J].中华内科杂志,2011,50(11):982-984.
Effect of Jinlida Granules on SREBP-1c in skeletalmuscle in fat-induced insulin resistance ApoE-/-m ice
JIN Xin1, ZHANG Hui-xin1,2*, CUIWen-wen1,3, CHANG Li-ping4,5
(1.Heilongjiang University of ChineseMedicine,Harbin 150040,China 2.Yiling Medical Research Institute of Hebei Province,Shijiazhuang 050000,China;3.Key Laboratory of State Administration of Traditional ChineseMedicine(Cardio-Cerebral Vascular Network Disease),Shijiazhuang 050000,China;4.Yiling Hospital of Hebei Medical University,Shijiazhuang 050017,China;5.Key Laboratory of Network Disease of Hebei Province,Shijiazhuang 050000,China)
ABSTRACT:AIMTo investigate the effect of Jinlida Granules(Ginseng Radix et Rhizoma,Polygonati Rhizoma,Atractylodis Rhizoma,Sophorae flavescentis Radix,Ophiopogonis Radix,Rehmanniae Radix,Polygonimultiflori Radix,Corni Fructus,etc)on SREBP-1c in skeletalmuscle in fat-induced insulin resistance ApoE-/-mice.METHODSEightmale C57BL/6Jmice were assigned to the normal group.Forty male ApoE-/-mice fed for sixteen weeks were divided into model group,rosiglitazone group,Jinlida Granules low,middle and high-dose groups,and then gavaged for eightweeks.The organization free fatty acid kit,BCA protein concentration determination method was used to determine skeletalmuscle FFA levels,glucose tolerance test(OGTT)was adopted to evaluate the degree of insulin resistance in mice.Real-time fluorescent quantitative reverse transcription PCR(RTPCR)and Western-blot(Western-blot)method were used to determinemice skeletalmuscle insulin receptor(INSR),insulin receptor substrate 2(IRS-2),cholesterol regulating element binding protein 1c(SREBP-1c)mRNA and protein expression.RESULTSJinlida Granules could decrease fasting blood glucose,cholesterol,triglyceride and low density lipoprotein cholesterol in blood and skeletalmuscle FFA content in mice,while increase high density lipoprotein and raise insulin sensitive index.Jinlida Granules significantly improved abnormal glucose tolerance and up-regulated the skeletalmuscle INSR,IRS-2,down-regulated SREBP-1c mRNA and protein expression in mice.CONCLUSIONJinlida Granules can adjust the skeletalmuscle SREBP-1c protein and gene expression,improve the ApoE-/-mice induced by high fat of insulin resistance.
Jinlida Granules;ApoE-/-mice;insulin resistance;INSR;IRS-1;SREBP-1c
R285.5
A
1001-1528(2015)04-0705-06
10.3969/j.issn.1001-1528.2015.04.004
2014-08-12
国家重点基础研究发展计划 (973计划)项目 (2012CB518606)
金 鑫(1989—),女,硕士生,研究方向为中药学。E-mail:jinxin19890712@163.com
*通信作者:张会欣(1976—),女,博士,正高级工程师,研究方向为糖尿病微血管病。E-mail:zhanghuixin@yiling.cn
