远志、厚朴配伍对其活性成分在大鼠肠段吸收的影响
2015-01-17黄立华吴明权朱璋佩高天慧陆小华
黄立华, 王 建, 吴明权, 朱璋佩, 高天慧, 陆小华
(成都中医药大学药学院,教育部重点实验室中药标准化实验室,四川成都611137)
[制 剂]
远志、厚朴配伍对其活性成分在大鼠肠段吸收的影响
黄立华, 王 建*, 吴明权, 朱璋佩, 高天慧, 陆小华
(成都中医药大学药学院,教育部重点实验室中药标准化实验室,四川成都611137)
目的研究远志和厚朴配伍对其活性成分细叶远志皂苷,远志口山酮Ⅲ,和厚朴酚,厚朴酚在大鼠不同肠段的吸收影响。方法采用在体单向肠灌流模型,用重量法校正灌流液体积,通过HPLC-DAD测定肠灌流液中的被测成分质量浓度,以及P-糖蛋白 (P-gp)和多药耐药相关蛋白2(MRP2)抑制剂对吸收的影响。结果配伍组细叶远志皂苷在空肠、结肠的Ka、Papp值均显著低于远志组 (P<0.05,P<0.01),远志口山酮Ⅲ在各肠段的Ka、Papp值与远志组比较均有减小趋势;配伍组和厚朴酚、厚朴酚的Ka、Papp值与厚朴组比较均有增大趋势。加入不同P-gp抑制剂盐酸维拉帕米后,各组中细叶远志皂苷、远志口山酮Ⅲ和厚朴酚的Ka值和中、高浓度组中厚朴酚的Ka值均显著高于空白组(P<0.05,P<0.01)。加入MRP2抑制剂吲哚美辛后,各组中细叶远志皂苷及中、高浓度组中远志口山酮Ⅲ的Ka、Papp值均极显著高于空白组 (P<0.01),和厚朴酚与厚朴酚的Ka、Papp值均有高于空白组的趋势。结论厚朴能抑制远志中细叶远志皂苷、远志口山酮Ⅲ在空肠和结肠的吸收,但受P-gp和MRP2外排影响,提示两成分可能是P-gp和MRP2的底物;而远志能促进厚朴中和厚朴酚、厚朴酚的吸收,但均不是P-gp和MRP2的底物,远志和厚朴配伍不宜与P-gp和MRP2酶抑制剂同用。
远志;厚朴;配伍;肠吸收;在体单向肠灌流;细叶远志皂苷;远志口山酮Ⅲ;和厚朴酚;厚朴酚;P-糖蛋白;多药耐药相关蛋白2
远志与厚朴均首载于 《神农本草经》,是临床常用中药。现代临床应用发现,远志常规用量偶可引起轻度恶心、胃肠胀气;大剂量则可引起恶心、呕吐、腹泻、溶血等不良反应,主要表现为胃肠运动障碍及黏膜损伤。课题组前期研究显示,远志有抑制胃肠动力的副作用。杨伟峰等[1]研究发现,远志总皂苷能显著抑制胃电振幅和小肠电慢波频率,且能显著抑制小鼠胃排空,抑制肠推进,且副作用强于等量生远志。为了降低远志胃肠抑制作用,课题组[2]采用远志与厚朴配伍法,发现厚朴能缓解远志胃动力障碍副作用,显著缓解远志胃肠动力抑制副作用,并保存了远志安神益智、镇咳化痰的功效,达到了 “减副存效”的目的。
课题组[3]还从化学角度对远志厚朴配伍后主要指标性成分的含量测定和指纹图谱进行了比较,显示酚类物质和苷类成分均无显著性变化且也未发现新成分。本实验以远志厚朴及其配伍为研究对象,以远志中细叶远志皂苷、远志口山酮Ⅲ,厚朴中和厚朴酚与厚朴酚为指标性成分或有效成分,以及加入不同的抑制剂后,探讨各成分及抑制剂在大鼠不同肠段的吸收特性,以及配伍前后厚朴缓解远志胃肠动力障碍机制。
1 材料
1.1 仪器 Agilent 1200型高效液相色谱仪(美国Agilent公司,自动进样器,DAD检测器);BT101L恒流智能蠕动泵 (保定雷弗流体科技有限公司);BP211D型电子分析天平 (北京赛多利仪器系统有限公司);UPH-1-10T优普系列超纯水器(成都超纯科技有限公司);TG16-W微量高速台式离心机 (长沙湘仪离心机仪器有限公司);SC-15超级恒温槽 (上海新芝生物技术研究所);KQ-600 DE型数控超声波清洗器 (40 kHz,600 W,昆山市超声仪器有限公司)。
1.2 试药与试剂 远志和厚朴均购于西南药都中药材市场,经成都中医药大学卢先明教授鉴定分别为远志科植物远志Polygala tenuifolia Willd.的干燥根及木兰科植物厚朴Magnolia officinalis Rehd.et Wils.或凹叶厚朴Magnolia officinalis Rehd.et Wils.var.biloba Rehd.etWils.的干燥干皮。细叶远志皂苷、远志口山酮Ⅲ、和厚朴酚、厚朴酚对照品(中国食品药品检定研究院,批号分别为111849-201303、 111850-201203、 110730-201112、110729-200412);盐酸维拉帕米(verapamil hydrochloride,VH,批号100223-200102)、吲哚美辛(indometacin,IT,批号100258-200904)均购自中国食品药品检定研究院;戊巴比妥钠 (北京化学试剂公司,德国进口分装,批号060222);乙腈(HPLC级,美国Fisher公司);水为超纯水;其他试剂均为分析纯。
1.3 动物 健康SD雄性大鼠,SPF级,体质量250~270 g,由成都达硕生物科技有限公司提供,许可证号SCXK(川)2013-24。实验场所,国家中医药管理局成都中医药大学中药药理三级科研实验室(NOTCM-09-315)。
2 方法与结果
2.1 药液的制备
2.1.1 Krebs-Ringer营养液(简称K-R液)的制备[4]称取NaCl 7.80 g,KCl 0.35 g,NaHCO31.37 g,NaH2PO40.32 g,MgCl2·6H2O 0.043 g,于1 000 mL量瓶中,先加纯化水溶解,再一边搅拌一边加CaCl20.37 g,D-glucose 1.40 g用时临时加入混匀,加超纯水定容,pH 7.4。
2.1.2 对照品溶液的配制 分别取细叶远志皂苷10.40 mg、远志口山酮Ⅲ10.00 mg、和厚朴酚12.60 mg、厚朴酚18.80 mg对照品,精密称定,置10mL量瓶中,加甲醇制成质量浓度为细叶远志皂苷1.04 mg/mL、远志口山酮Ⅲ1.00 mg/mL、和厚朴酚1.26 mg/m L、厚朴酚1.88 mg/mL,用0.45μm微孔滤膜滤过,即得,4℃冷藏,备用。
2.1.3 供试液的配制 称取远志粉末 (过三号筛)1 kg,加90%乙醇回流提取2 h,提取1次,过滤,减压回收溶剂,蒸干得远志浸膏290 g。称取远志浸膏151 g,将其置于500 mL 1%的NaOH溶液中,加热回流2 h,放冷,用盐酸调节pH为4~5。将酸化后的碱水解溶液以D101大孔吸附树脂进行柱层析,先用去离子水洗脱至流出液基本无色,弃去洗脱液;再用95%乙醇洗脱至流出液基本无色,减压回收溶剂,蒸干得远志皂苷水解产物33.0 g(细叶远志皂苷质量分数为209 mg/g,远志口山酮Ⅲ质量分数为1.63 mg/g)。
取厚朴粉末 (过三号筛)2 kg,精密称定,用90%乙醇回流提取2 h,提取1次,趁热过滤,减压回收溶剂,蒸干得厚朴浸膏210 g(和厚朴酚含有量为36.4 mg/g,厚朴酚含有量为85.4 mg/g)。
精密称取远志浸膏0.94 g,置研钵中,加SDS 5.0 g,充分研磨均匀,分次加入K-R液,充分研磨混匀,于1 000 m L量瓶中,定容,15 min超声充分均匀,即得0.94 mg/m L的远志供试液(细叶远志皂苷为0.20 mg/mL,远志口山酮Ⅲ为1.53 μg/mL),即相当于制成每1mL溶液中含远志原生药14.8 mg。取厚朴浸膏3.12 g,同法制成3.12 mg/mL的厚朴供试液(和厚朴酚为0.11 mg/m L,厚朴酚为0.27 mg/mL),即相当于制成每1 mL溶液中含厚朴原生药29.6 mg。精密称取远志皂苷水解产物0.94 g,厚朴浸膏3.12 g,同法制成远志和厚朴的质量浓度分别为0.94 mg/mL和3.12 mg/mL的配伍供试液。
2.1.4 含P-gp抑制剂的配伍供试液的配制 精密移取盐酸维拉帕米贮备液0.2、0.4、2.0 mL,加“2.1.3”项配伍供试液定容至250 mL量瓶中。即得含盐酸维拉帕米分别为0.05、0.1、0.5 mmol/L的低、中、高浓度组供试液。
2.1.5 含MRP2抑制剂的配伍供试液的配制 取吲哚美辛贮备液0.1、0.2、0.4 mL,精密移取,加 “2.1.3”项配伍供试液定容至250 mL量瓶中。即得含吲哚美辛分别为0.02、0.04、0.08 mmol/L的低、中、高浓度组供试液。
2.2 色谱条件 Inertsil®ODS-3 C18色谱柱(250 mm×4.6 mm,5μm);流动相:乙腈 (A)-0.05%磷酸水溶液 (B),pH为2.3,体积流量1.0 mL/min,梯度洗脱0~5 min,25%~35%A;5~13 min,35%~67%A;13~16 min,67%~90%A;16~17 min,90%A;17~18 min,90%~25%A;18~22 min,25%A,柱温40℃;进样量:20μL;检测波长:细叶远志皂苷 210 nm、远志口山酮Ⅲ254 nm、和厚朴酚与厚朴酚294 nm。
2.3 灌流液样品处理 移取灌流液样品1.0 mL,加入1.0 mL甲醇涡旋2min,12 000 r/min离心10 min后,取上清液20μL进样测定。
2.4 在体单向肠灌流试验 取实验前禁食12 h(期间正常饮水)的健康SD大鼠,腹腔注射1%戊巴比妥钠溶液 (40 mg/kg),麻醉后仰卧固定于手术台上,手术操作参考文献 [4-6],灌流流速为0.28 mL/min,从第一滴供试液滴下开始计时,前30 min的灌流液舍去,后每隔15 min迅速更换一次装有供试液的安瓿瓶和用来收集灌流液的安瓿瓶,称重,计算泵入供试液的质量,称定每15 min内收集到流出液的质量。直至120 min结束实验。
实验结束后,将大鼠麻醉处死,轻柔地将被考察的肠段剪下,保持自然长度,在37℃的0.9%生理盐水浸润下剪开肠段,用手术丝线附着法测量其长度l(cm)和周长C(cm),测量过程尽量迅速且避免牵拉肠段,由周长计算肠段的内半径r(cm)。所得灌流液样本经预处理后进样测定细叶远志皂苷、远志口山酮Ⅲ、和厚朴酚与厚朴酚的含有量。
2.5 灌流液体积的校正及统计分析 参照文献[7],采用重量法对灌流液的流入和流出的体积进行校正,消除其体积变化的影响。按下式计算Ka和Papp值。
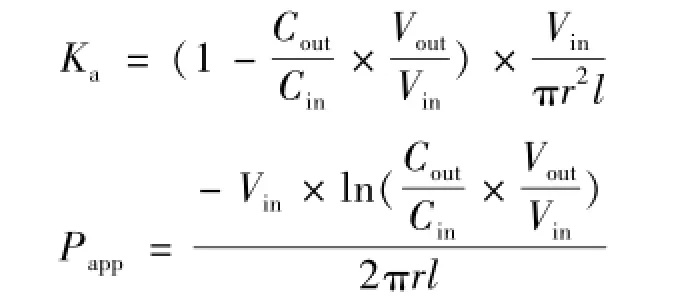
其中,Vin和Vout分别为灌入和收集的供试液体积 (mL);Cin和Cout分别为进口和出口处缓冲液中的药物质量浓度(mg/L);l和r分别为被考察肠段长度 (cm)和半径 (cm);Vin为灌流速度(mL/min)。
采用Grubbs检验法对Ka和Papp值分别进行偶然误差值进行取舍,直至无显著性误差。结果用SPSS 17.0统计软件分析。
2.6 方法学考察
2.6.1 专属性试验 分别取大鼠空白灌流液,空白灌流液加细叶远志皂苷、远志口山酮Ⅲ、和厚朴酚及厚朴酚对照品,远志厚朴配伍肠灌流液,按“2.3”项方法预处理,结果见图1。

图1 各样品的HPLC图Fig.1 HPLC of d ifferent sam p les
2.6.2 线性与范围考察 用空白灌流液配制混合样品,含细叶远志皂苷质量浓度为1.875、3.75、7.5、15、30、60、120μg/m L;远志口山酮Ⅲ质量浓度0.012 5、0.025、0.05、0.1、0.2、0.4、0.8 μg/mL;和厚朴酚质量浓度为3.125、6.25、12.5、25、50、100、200μg/mL;厚朴酚质量浓度为6.25、12.5、25、50、100、200、400μg/mL。按“2.3”项方法预处理后,进样测定。以细叶远志皂苷、远志口山酮Ⅲ、和厚朴酚与厚朴酚的峰面积(Y)作为纵坐标,以细叶远志皂苷、远志口山酮Ⅲ、和厚朴酚与厚朴酚质量浓度 (X)作为横坐标,绘制标准曲线,见表1,结果显示细叶远志皂苷 (TF)、远志口山酮Ⅲ (PT)、和厚朴酚 (HN)及厚朴酚 (MN)线性关系良好。

表1 线性范围考察结果Tab.1 Linear range investigation
2.6.3 精密度试验 分别配制含细叶远志皂苷3.75、15,60μg/mL;远志口山酮Ⅲ0.025、0.1、0.4μg/m L;和厚朴酚6.25、25、100μg/mL;厚朴酚12.5、50、200μg/mL的低、中、高3个混合浓度灌流液,按 “2.3”方法预处理后1 d内每个浓度连续测6次,同法连续测定7 d。结果见表2,表明精密度良好。
2.6.4 稳定性试验 取细叶远志皂苷、远志口山酮Ⅲ、和厚朴酚与厚朴酚质量浓度分别为3.75、15、60μg/mL,0.025、0.1、0.4μg/m L,6.25、25、100μg/mL,12.5、50、200μg/mL的低、中、高3个混合供试液,按 “2.3”项方法预处理后,连续测定6 d,结果见表2,表明稳定性良好。
2.6.5 回收率试验 分别配制质量浓度为3.75、15、60μg/m L,0.025、0.1、0.4μg/mL,6.25、25、100μg/m L,12.5、50、200μg/m L 3种不同质量浓度的细叶远志皂苷、远志口山酮Ⅲ、和厚朴酚与厚朴酚灌流液,按 “2.3”项方法预处理后,进样测定并记各成分峰面积,将峰面积代入回归方程计算质量浓度。结果见表2,表明低、中、高质量浓度的提取回收率均符合要求。
2.7 细叶远志皂苷、远志口山酮Ⅲ、和厚朴酚及厚朴酚在大鼠各肠段吸收特性的考察 取SD大鼠随机分成远志组,厚朴组,配伍组3组,每组6只,分别取 “2.1.3”项下灌流液,按 “2.4”项方法进行实验,考察细叶远志皂苷、远志口山酮Ⅲ、和厚朴酚与厚朴酚在十二指肠、空肠、回肠和结肠的吸收,结果见表3。结果显示,配伍后远志中细叶远志皂苷、远志口山酮Ⅲ在各肠段吸收均明显减少(P<0.05,P<0.01),而厚朴中和厚朴酚、厚朴酚肠吸收均有增大趋势。
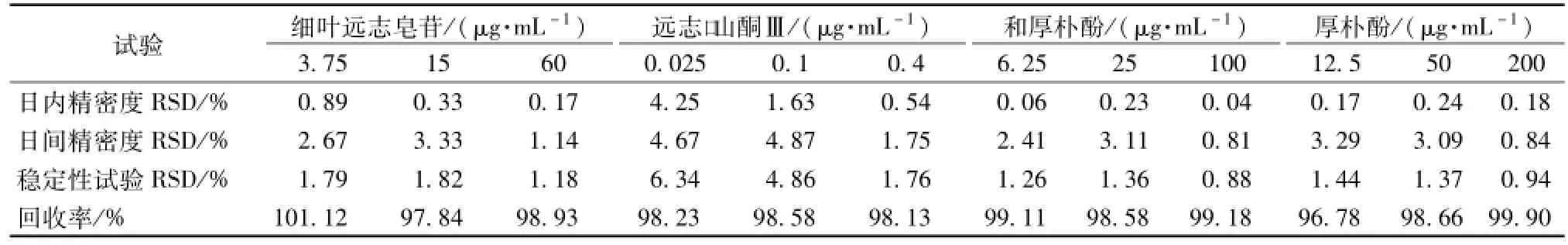
表2 精密度、稳定性、加样回收试验结果Tab.2 Precision,stability and recovery test
表3 细叶远志皂苷 (TF)、远志口山酮Ⅲ (PT)、和厚朴酚(HN)及厚朴酚(MN)在大鼠不同肠段的吸收 (n=6,)Tab.3 Absorption of TF,PT,HN and MN in different intestinal segments in rats(n=6,)
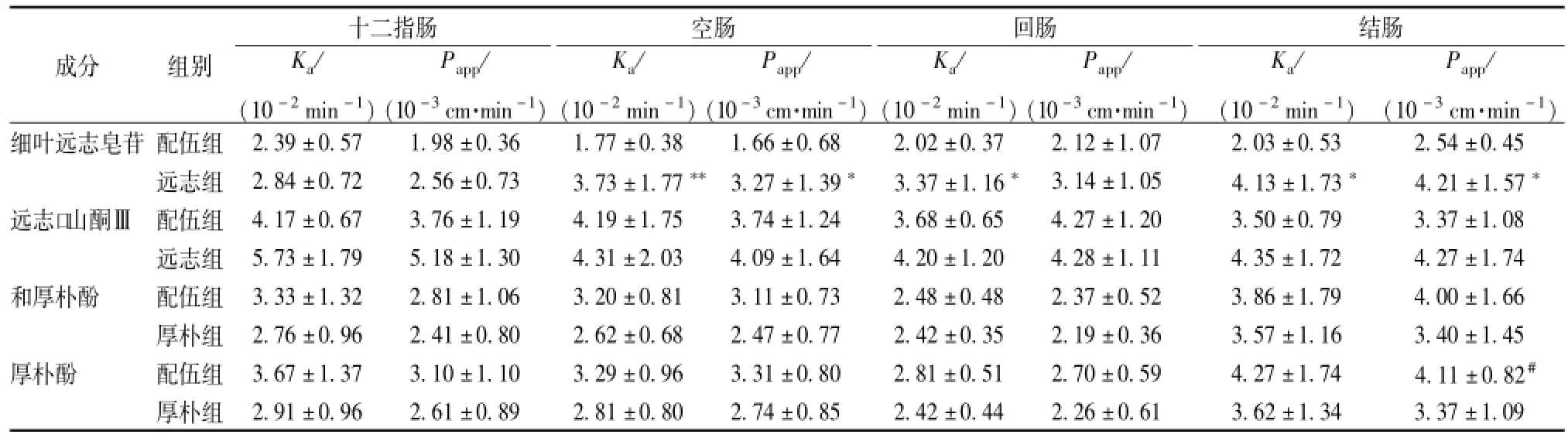
表3 细叶远志皂苷 (TF)、远志口山酮Ⅲ (PT)、和厚朴酚(HN)及厚朴酚(MN)在大鼠不同肠段的吸收 (n=6,)Tab.3 Absorption of TF,PT,HN and MN in different intestinal segments in rats(n=6,)
注:与配伍组比较,*P<0.05,**P<0.01;与回肠段配伍组比较,#P<0.05
成分 组别十二指肠K a/(10-2min-1)P app/(10-3cm·min-1)空肠K a/(10-2min-1)P app/(10-3cm·min-1)回肠K a/(10-2min-1)P app/(10-3cm·min-1)结肠K a/(10-2min-1)P app/(10-3cm·min-1)细叶远志皂苷 配伍组2.39±0.57 1.98±0.36 1.77±0.38 1.66±0.68 2.02±0.37 2.12±1.07 2.03±0.53 2.54±0.45远志组 2.84±0.72 2.56±0.73 3.73±1.77**3.27±1.39* 3.37±1.16* 3.14±1.05 4.13±1.73* 4.21±1.57*远志口山酮Ⅲ 配伍组 4.17±0.67 3.76±1.19 4.19±1.75 3.74±1.24 3.68±0.65 4.27±1.20 3.50±0.79 3.37±1.08远志组 5.73±1.79 5.18±1.30 4.31±2.03 4.09±1.64 4.20±1.20 4.28±1.11 4.35±1.72 4.27±1.74和厚朴酚 配伍组 3.33±1.32 2.81±1.06 3.20±0.81 3.11±0.73 2.48±0.48 2.37±0.52 3.86±1.79 4.00±1.66厚朴组 2.76±0.96 2.41±0.80 2.62±0.68 2.47±0.77 2.42±0.35 2.19±0.36 3.57±1.16 3.40±1.45厚朴酚 配伍组 3.67±1.37 3.10±1.10 3.29±0.96 3.31±0.80 2.81±0.51 2.70±0.59 4.27±1.74 4.11±0.82#厚朴组2.91±0.96 2.61±0.89 2.81±0.80 2.74±0.85 2.42±0.44 2.26±0.61 3.62±1.34 3.37±1.09
2.8 P-gp抑制剂对细叶远志皂苷、远志口山酮Ⅲ、和厚朴酚、厚朴酚肠吸收的影响 取SD大鼠随机分成4组,每组6只,取 “2.1.3”项配伍供试液和 “2.1.4”项下供试液,选取回肠段,按 “2.4”项方法进行实验。结果见表4。
表4 添加P-gp抑制剂 (盐酸维拉帕米)后细叶远志皂苷 (TF)、远志口山酮Ⅲ (PT)、和厚朴酚 (HN)及厚朴酚 (MN)吸收的Ka、Papp值 (n=6,)Tab.4 Kaand Pappof TF,PT,HN and MN with verapam il hydroch loride(n=6,)
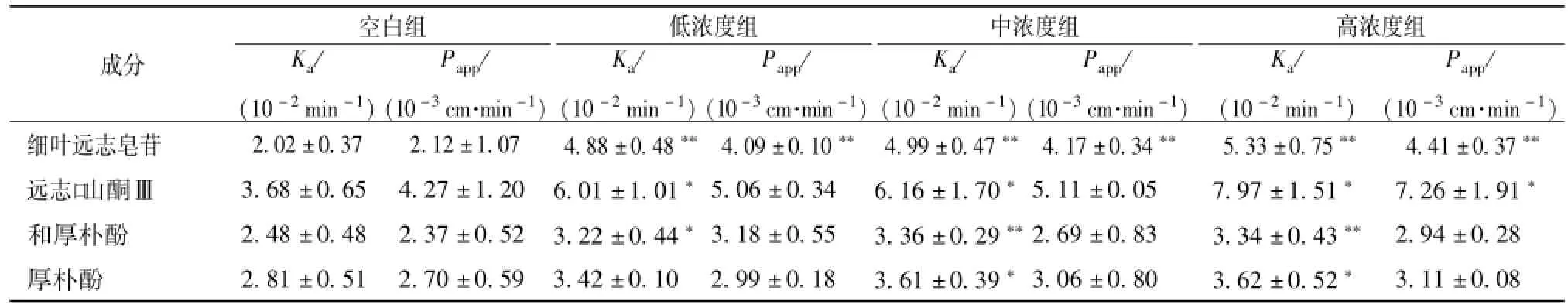
表4 添加P-gp抑制剂 (盐酸维拉帕米)后细叶远志皂苷 (TF)、远志口山酮Ⅲ (PT)、和厚朴酚 (HN)及厚朴酚 (MN)吸收的Ka、Papp值 (n=6,)Tab.4 Kaand Pappof TF,PT,HN and MN with verapam il hydroch loride(n=6,)
注:与空白组比较,*P<0.05,**P<0.01
成分空白组K a/(10-2min-1)P app/(10-3cm·min-1)低浓度组K a/(10-2min-1)P app/(10-3cm·min-1)中浓度组K a/(10-2min-1)P app/(10-3cm·min-1)高浓度组K a/(10-2min-1)P app/(10-3cm·min-1)细叶远志皂苷 2.02±0.37 2.12±1.07 4.88±0.48**4.09±0.10** 4.99±0.47**4.17±0.34** 5.33±0.75** 4.41±0.37**远志口山酮Ⅲ 3.68±0.65 4.27±1.20 6.01±1.01*5.06±0.34 6.16±1.70*5.11±0.05 7.97±1.51* 7.26±1.91*和厚朴酚 2.48±0.48 2.37±0.52 3.22±0.44*3.18±0.55 3.36±0.29**2.69±0.83 3.34±0.43** 2.94±0.28厚朴酚 2.81±0.51 2.70±0.59 3.42±0.10 2.99±0.18 3.61±0.39*3.06±0.80 3.62±0.52*3.11±0.08
结果显示,添加抑制剂后细叶远志皂苷、远志口山酮Ⅲ的Ka值均显著高于空白组 (P<0.05,P<0.01),均呈剂量依赖性。
2.9 MRP2抑制剂对细叶远志皂苷、远志口山酮Ⅲ、和厚朴酚及厚朴酚肠吸收的影响 取SD大鼠随机分成4组,每组6只,取 “2.1.3”项配伍供试液和 “2.1.5”项供试液,选取空肠段按 “2.4”项方法进行实验。结果见表5。结果显示,添加抑制剂后,细叶远志皂苷的Ka、Papp值均极显著高于空白组,呈剂量依赖性,且高浓度组极显著地高于低、中浓度组 (P<0.01)。中、高浓度组中远志口山酮Ⅲ的Ka值极显著高于空白组,也有剂量依赖性,且高浓度组显著高于低浓度组 (P<0.05);抑制剂组的Papp值极显著高于空白组 (P<0.01),且低浓度组极显著低于高浓度组 (P<0.01)。抑制剂各组中和厚朴酚及厚朴酚的Ka、Papp值与空白组比较均无显著性差异 (P>0.05)。推测,远志厚朴配伍后,细叶远志皂苷、远志口山酮Ⅲ可能均是MRP2的底物,和厚朴酚及厚朴酚可能均不是MRP2的底物。
表5 添加M RP2抑制剂 (吲哚美辛)后细叶远志皂苷 (TF)、远志口山酮Ⅲ (PT)、和厚朴酚 (HN)及厚朴酚 (M N)吸收的Ka、P app值(n=6,)Tab.5 Kaand P app of TF,PT,HN and MN w ith indometacin(n=6,)

表5 添加M RP2抑制剂 (吲哚美辛)后细叶远志皂苷 (TF)、远志口山酮Ⅲ (PT)、和厚朴酚 (HN)及厚朴酚 (M N)吸收的Ka、P app值(n=6,)Tab.5 Kaand P app of TF,PT,HN and MN w ith indometacin(n=6,)
注:与空白组比较,*P<0.05,**P<0.01;与高质量浓度组比较,△P<0.05,△△P<0.01
成分空白组K a/(10-2min-1)P app/(10-3cm·min-1)低质量浓度组K a/(10-2min-1)P app/(10-3cm·min-1)中质量浓度组K a/(10-2min-1)P app/(10-3cm·min-1)高质量浓度组K a/(10-2min-1)P app/(10-3cm·min-1)细叶远志皂苷 1.77±0.38 1.66±0.68 4.83±0.97**△△4.68±0.71**△△5.09±0.68**△△4.90±0.23**△△ 7.45±0.55** 6.91±0.55**远志口山酮Ⅲ 4.19±1.75 3.74±1.24 6.93±3.52△ 7.55±0.91**△△10.77±2.56** 10.36±0.88** 11.93±2.73** 12.15±1.64**和厚朴酚 3.20±0.81 3.11±0.73 3.24±0.44 4.10±0.88 3.37±1.75 4.13±0.81 4.83±1.64 4.27±1.45厚朴酚3.29±0.96 3.31±0.80 3.36±0.49 4.03±0.11 3.37±1.82 4.06±0.92 5.37±2.17 4.38±1.45
3 讨论
3.1 色谱条件及K-R液 由细叶远志皂苷、远志口山酮Ⅲ、和厚朴酚及厚朴酚的3D光谱图可知,细叶远志皂苷为末端吸收,参考文献 [8]故选择210 nm为检测波长;远志口山酮Ⅲ在360、320、254、240 nm均有较大吸收,而254 nm为最大吸收波长;和厚朴酚在294 nm、258 nm和206 nm均有较大吸收,虽206 nm为最大吸收波长,但此波长干扰较多不易分离且为末端吸收,故选择干扰最小的294 nm;厚朴酚在294 nm和218 nm处均有较大吸收,但218 nm干扰较多,故选择294 nm为检测波长。文献[9]报道K-R液加入CaC12十分浑浊,且有沉淀,影响实验结果。本实验配制时加入CaC12并边搅拌边加入,故克服了浑浊和沉淀现象。
3.2 助溶剂选择 厚朴中酚类物质 (和厚朴酚、厚朴酚)在K-R液中溶解度很小,需要加助溶剂使之溶解,常用的助溶剂主要有吐温-80、SDS及泊洛萨姆(Poloxamer)等,预实验考察了1%、2%、5%吐温-80和0.1%、0.2%、0.5%SDS对远志厚朴各目标成分的溶解性,结果1%、2%吐温-80和0.1%、0.2%SDS均不能完全溶解酚类物质,5%吐温-80和0.5%SDS均能完全溶解。选5%吐温-80和0.5%SDS对远志厚朴进行考察,结果0.5%SDS对肠吸收没有显著影响,而5%吐温-80对小肠吸收均有显著促进作用 (P<0.05),与文献 [10]报道吐温-80可能是P-gp抑制剂相符,参考文献 [11-12]选择0.5%SDS作为助溶剂。
3.3 肠段选择 MacLean C等[13]研究表明P-gp在大鼠肠段的表达依次为结肠>回肠>空肠>十二指肠。考虑到虽然P-gp在结肠表达最高,但结肠内存在的大量微生物及水解酶可能会对实验结果造成误差,所以本研究选择在远端回肠段。Johnson等[14]研究表明,MRP2表达较高的肠段是空肠,故本研究选择空肠段。
3.4 抑制剂与底物 远志厚朴配伍后,远志能增加厚朴中和厚朴酚、厚朴酚的肠吸收,在配伍组中加入P-gp抑制剂后,抑制剂各浓度组中和厚朴酚、厚朴酚的肠吸收显著高于空白组,但前期实验显示单味厚朴中加入P-gp抑制剂盐酸维拉帕米后,和厚朴酚肠吸收有增加趋势,但无显著性差异,可以推测是远志和抑制剂二者作用之和使和厚朴酚、厚朴酚的肠吸收出现显著性差异,因此不能确定和厚朴酚是P-gp的底物;在配伍组中加入MRP2抑制剂后,抑制剂各质量浓度组中和厚朴酚、厚朴酚的肠吸收与空白组均无显著性差异,可以说明和厚朴酚、厚朴酚均不是MRP2的底物。在配伍组中加入P-gp和MRP2抑制剂后,肠吸收显著增加。推测二者均是P-gp和MRP2底物。综合提示,临床治病时,若处方以及制剂中含有远志厚朴配伍时,与盐酸维拉帕米、利血平、奎尼丁、育亨宾、长春新碱、Valspodar(PSC833)、Zosuguidar(LY-335979)、Tariquidar(XR-9576)等P-gp抑制剂联合用药,或与吲哚美辛、丙磺舒、呋塞米等MRP2抑制剂联合应用,可能会使药物的口服生物利用度提高,使治疗作用增加的同时,毒副作用也增加,治疗安全窗口变小。因此,厚朴与远志配伍使用,为避免皂苷对胃肠动力带来的抑制副作用,不宜与P-gp、MRP2抑制剂联用。
3.5 远志厚朴配伍关系 基于课题组前期研究[2,15],远志厚朴1:2配伍能在有效缓解远志胃肠动力抑制的同时,其安神、祛痰镇咳功效仍存,故本实验选择1:2配比。远志中苷类成分既是主要药效成分,又是引起胃肠动力障碍的主要成分。本实验研究远志与厚朴配伍前后二者的主要有效成分在十二指肠、空肠、回肠及结肠的吸收变化情况,结果显示,远志和厚朴配伍后,远志中的细叶远志皂苷肠吸收速率常数 (Ka)在十二指肠有降低趋势,在回肠、结肠、空肠均显著性降低;表观吸收系数 (Papp)值在空肠和结肠有显著性降低,在十二指肠和回肠段均有降低趋势。二者配伍后,厚朴的酚类成分肠吸收均有增加趋势,但无显著性差异,厚朴酚在结肠的Papp值显著高于回肠。综上可以说明远志厚朴配伍后,厚朴能显著抑制远志中苷类成分在小肠的吸收;而远志能促进酚类成分吸收。这可能是二者配伍后能缓解胃肠动力障碍副作用,发挥 “减副存效”的机制之一。中药配伍原理复杂,其吸收后的作用机制尚待深入研究。
[1]杨伟峰,王 建,刘丽娜,等.生远志及其总皂苷与蜜远志对大鼠胃肠电慢波的影响[J].中药药理与临床,2010,26(3):28-31.
[2]田 竞,王 建,班炳坤,等.厚朴与远志配伍对大鼠胃肠道消化功能的影响[J].中药药理与临床,2010,27(1):66-68.
[3]马 骁,王 建,田 徽,等.厚朴汁炮炙远志对和厚朴酚、厚朴酚及细叶远志皂苷的影响[J].中成药,2013,35(9):1972-1976.
[4]杨 希,顾政一,贺金华,等.金蒿抗流感滴丸一枝蒿酮酸和金丝桃苷的肠吸收特性研究[J].中成药,2013,35(11):2372-2378.
[5]张 艳,王 平,王进荣,等.在体单向肠灌流模型研究大黄素的大鼠肠吸收特性[J].中药新药与临床药理,2012,23(3):286-290.
[6]马 燕,林宝琴,李卫中,等.柚皮素大鼠在体肠吸收动力学的研究[J].中成药,2013,34(8):1487-1491.
[7]聂淑芳,潘 卫,杨星钢,等.对大鼠在体肠单向灌流技术中重量法的评价[J].中国新药杂志,2005,14(10):1176-1179.
[8]国家药典委员会.中华人民共和国药典:2010年版一部[S].北京:中国医药科技出版社,2010:146-147.
[9]王利胜,涂 星,陈 豆,等.在体肠循环法研究黄芪提取物对川芎嗪大鼠肠吸收的影响[J].中国医院药学杂志,2012,32(9):661-664.
[10]顾玲玲,陈志祥,陆伟根.ABC跨膜转运蛋白外排抑制剂促进药物肠吸收的研究进展[J].世界临床药物,2012,33(3):176-182.
[11]夏丽文,董培良.羟基积雪草苷在大鼠肠内吸收的研究[J].药物评价研究,2011,34(1):22-25.
[12]王 志,冯年平,叶贝妮,等.大鼠在体单向肠灌流模型研究麝香及其复方配伍的肠吸收机制[J].上海中医药杂志,2013,47(6):101-106.
[13]MacLean C,Moenning U,Reiehel A,et al.Closing the gaps:A full scan of the intestinal expression of p-glycoprotein,breast cancer resistance protein,and multidrug resistance-associated protein 2 in male and female rats[J].Drug Metab Dispos,2008,36(7):1249-1254.
[14]Johnson BM,Zhang P,Sehuetz D J,etal.Characterizalion of transport protein expression in multidrug resistance-assoeiated protein(MRP)2-deficient rats[J].Drug Metab Dispos,2006,34(4):556-562.
[15]肖 武.厚朴缓解远志胃肠动力抑制及粘膜损伤部分机制研究[D].成都:成都中医药大学,2010.
Active elements from Yuanzhiand Houpo,and their intestinal absorption due to the com bined use
HUANG Li-hua, WANG Jian*, WU Ming-quan, ZHU Zhang-pei, GAO Tian-hui, LU Xiao-hua
(College of Pharmacy,Chengdu University of Traditional Chinese Medicine,The Ministry of Education Key Laboratory for Standardization of Chinese Herbal Medicine,Chengdu 611137,China)
AIMTo explore the intestinal absorption of tenuifolin,onjixanthoneⅢ,honokiol,and magnolol by the combined use of Yuanzhi(Polygalae Radix)and Houpo(Magnoliae officinalis Cortex).METHODSHPLC-DAD was applied tomeasureing the abovementioned active components contents in one-way intestinal perfusion modelwith corrected perfusate gravimetricmethod.Moreover,the influence to the absorption site,inhibitor,and the effect on permeability glycoprotein(P-gp)and multidrug resistance-associated protein(MRP2)by the combined use of Yuanzhiand Houpowere assessed.RESULTSKaand Pappof tenuifolin on jejunum and colon in combination group was lower than that of Yuanzhi group(P<0.01,P<0.05).Kaand Pappof onjixanthoneⅢin intestinal segments tended to decrease compared to Yuanzhigroup.Kaand Pappof honokiol and magnolol in combination group performed differently compared to Houpo group.Kaof tenuifolin,onjixanthoneⅢ,and honokiol in each group and Kaofmagnolol in middle and high concentrations were significantly higher than these in the blank group(P<0.05,P<0.01)adding of Verapamil.Kaand Pappof tenuifolin in groups and onjixanthoneⅢinmiddle and high concentration were significantly higher than these in the blank group(P<0.01)due to Indometacin,but Kaand Pappofhonokiolandmagnololwere found higher in the trial group.CONCLUSIONHoupu can inhibit the absorption of tenuifolin and onjixanthoneⅢin jejunum and colon,given the efflux of P-gp and MRP2 and possibly the substrates of P-gp and MRP2.Whereas Yuanzhi can improve the absorption of honokiol and magnolol in jejunum and colon,but not because of the substratesof P-gp and MRP2.The combination of Yuanzhiand Houpo mustavoid sharing with P-gp and MRP2 enzyme inhibitor.
Yuanzhi(Polygalae Radix);Houpo(Magnoliaeofficinalis Cortex);combination;intestine absorption;one-way intestinal perfusion model in vivo;tenuifolin;onjixanthoneⅢ;honkiolmagnolol;P-gp;MRP2
R969.1
A
1001-1528(2015)04-0739-07
10.3969/j.issn.1001-1528.2015.04.011
2014-09-04
国家自然科学基金资助项目 (81173567)
黄立华 (1986—),男,博士生,从事中药药性理论研究。Tel:13880622139,E-mail:378097998@qq.com
*通信作者:王 建 (1959—),女,教授,博士生导师,从事中药药性理论研究。Tel:(028)61800231,E-mail:jianwang08@ 163.com
