茅苍术提取物含药血清对大鼠心肌细胞氧化损伤的保护作用
2015-01-16刘菊燕巢建国席蓓莉李孟洋
刘菊燕, 巢建国, 谷 巍, 席蓓莉, 李孟洋
(南京中医药大学,江苏南京210023)
茅苍术提取物含药血清对大鼠心肌细胞氧化损伤的保护作用
刘菊燕, 巢建国*, 谷 巍, 席蓓莉, 李孟洋
(南京中医药大学,江苏南京210023)
目的利用中药血清药物化学及血清药理学方法,探讨茅苍术保护心肌细胞氧化损伤的物质基础。方法测定
和比较茅苍术提取物及其灌胃给药前后大鼠空白和含药血清中的入血成分,然后体外培养H9c2大鼠心肌细胞,建立
H2O2氧化损伤模型,以细胞形态、LDH释放量、SOD活力、MDA水平及细胞相对凋亡情况为指标,考察茅苍术提取
物及其含药血清对心肌细胞损伤的影响。结果茅苍术提取物在血清中出现11个移行成分,其中7个为原型成分,
另外4个可能为代谢产物。H2O2损伤组与正常对照组相比,细胞皱缩并且变圆,数量明显减少,LDH释放量及MDA
水平明显升高,SOD活性降低,细胞凋亡率增加;与H2O2损伤组相比,阳性Vc对照组、茅苍术提取物及其含药血
清作用组的细胞数目增多,LDH释放量和MDA水平均有不同程度的降低,SOD活性升高,凋亡细胞数目减少。结论茅苍术提取物的11个入血成分可能为茅苍术保护心肌细胞氧化损伤的物质基础。
茅苍术;血清药物化学;血清药理学;氧化损伤;H9c2心肌细胞
研究表明[1],体内抗氧化功能减弱以及自由基,特别是活性氧自由基 (ROS)的增加与各种心血管疾病的发生和发展密切相关。H2O2是一种重要的ROS,极易透过细胞膜与细胞内Fe2+反应,形成高活性的自由基,从而导致一系列反应。由于其易于获得,而且性质相对稳定,因此已成为研究细胞氧化损伤的重要工具[2]。近年来研究发现[3],一些中药及其有效成分对心肌细胞的氧化损伤具有保护作用,并且活性高、毒性小、临床效果优于单体。
茅苍术为菊科植物茅苍术Atractylodes lancea(Thunb.)DC.的干燥根茎,中医临床应用历史悠久。药理和临床实验表明[4-5],它具有保肝、降血糖、抗炎、抗肿瘤和抗氧化等作用,但对其抗氧化的作用机制及发挥药效的物质基础研究较为薄弱。本实验采用中药血清药物化学和血清药理学方法来探讨茅苍术保护心肌细胞氧化损伤的作用,为建立该植物及其提取物的多指标质量控制标准奠定基础。
1 材料
1.1 动物 SPF级SD雄性大鼠,体质量180~220 g,动物许可证号SCXK(京)2012-0001(北京维通利华实验动物技术有限公司),于SPF级动物房饲养,定时喂食全价营养饲料,室温20℃~25℃,相对湿度50%~70%。
1.2 药材与试剂 茅苍术采自江苏省茅山地区,经南京中医药大学中药资源学教研室巢建国教授鉴定为菊科植物茅苍术Atractylodes lancea(thumb.)Dc.的根茎,除去其杂质及泥土,自然晾干后粉碎,过60目筛。
甲醇、乙腈为分析纯 (美国天地试剂公司);甲酸为分析纯 (上海晶纯生化科技股份有限公司);澳洲胎牛血清、DMEM高糖培养液、0.25%胰蛋白酶 (批号分别为1431602、NYH0948、20140216,美国Gibco公司);青链霉素混合液(100X)、PBS磷酸盐缓冲液(0.01 mol/L)、3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐 (MTT)(批号分别为20140317、T20130825、509E024,北京索莱宝科技有限公司);二甲基亚砜 (DMSO,批号为1028D005,国药集团化学试剂有限公司);抗坏血酸 (Vc,批号为100425-201103,中国食品药品检定研究院);LDH、SOD、MDA试剂盒 (批号分别为 20140417、20140331、20140321,南京建成生物工程研究所)。
1.3 仪器 Agilent 1100高效液相色谱仪,包括Agilent DAD二极管阵列检测器(美国Agilent Technologies公司);Hedra C18色谱柱(4.6 mm×250 mm,0.5μm),包括5 cm保护柱 (江苏汉邦科技有限公司);CO2细胞培养箱 (日本Sanyo公司);CKX31型倒置显微镜(日本Olympus公司);752型紫外可见分光光度计 (上海光谱仪器有限公司);Model680型酶标仪(美国Bio-Rad公司);96孔细胞培养板(美国Corning公司);AUW220D电子天平(日本岛津公司);Milli-Q超纯水器(美国Millipore公司)。
1.4 细胞系 H9c2心肌细胞系 (中国科学院上海细胞库)。
2 方法
2.1 茅苍术提取物制备 茅苍术药材干燥粗粉用重蒸水浸泡1 h,回流提取2次,每次1 h,提取液合并后过滤,滤液减压浓缩得到浸膏,65℃下烘干,即得茅苍术提取物(每1 g相当于生药3.5 g),4℃冰箱保存备用。
2.2 茅苍术提取物供试液制备 精密称取 “2.1”项下制备的茅苍术提取物0.2 g,置于小烧杯中,缓慢加入95%乙醇,慢加快搅,至不再有絮状物析出为止。然后静置过夜,抽滤后将滤液浓缩,甲醇溶解并定容至50 mL,离心(3 000 r/min,10min),取上清液,过0.22μm微孔滤膜后取续滤液,即得茅苍术提取物供试液,供HPLC分析用。
2.3 茅苍术提取物灌胃样品的制备 精密称取 “2.1”项下制备的茅苍术提取物适量,重蒸水溶解并配置成0.052 1 g/mL的茅苍术提取物药液,即得茅苍术提取物灌胃样品(约相当于临床成人用药量的30倍)。
2.4 含药血清和空白血清样品制备[6]取成年健康SD大鼠10只,禁食12 h后眼眶取血,以1 mL/100 g的量灌胃给予 “2.3”项下制备的茅苍术提取物药液 (0.065 g/mL),空白组灌胃给予等量重蒸水,每日2次,连续3 d,末次给药后2 h采集含药和空白血液,取血前大鼠自由饮水。将空白和含药血液低温静置40 min,凝结后低速离心15 min(3 000 r/min),分离血清。取上层血清1 mL,加乙腈5 mL后快速涡旋3 min,混匀,高速离心后取上清液,45℃氮吹仪吹干。残渣用初始比例的流动相复溶,离心10 min(12 000 r/min),取上清液,供HPLC分析用。另取血清适量,56℃下水浴灭菌30 min,0.22μm微孔滤膜过滤,-20℃下保存备用。
2.5 HPLC条件 Hedra C18色谱柱(4.6 mm×250 mm,0.5μm),保护柱 5 cm;检测波长221 nm;流量 0.6 mL/min;柱温30℃;进样量20μL;流动相为乙腈 (A)-0.25%甲酸水溶液 (B),梯度洗脱顺序见表1。

表1 流动相梯度洗脱顺序
2.6 心肌细胞培养[7]H9c2心肌细胞在含有10%胎牛血清的DMEM高糖培养基中,37℃、5%CO2条件下培养,至贴壁细胞达到瓶壁的85%~90%时,PBS清洗3次,0.25%胰蛋白酶消化细胞,每2天更换1次培养液,按每孔5×104个/mL的密度接种于96孔培养板上。
2.7 心肌细胞药物预处理、H2O2损伤及相关指标检测 将96孔板中培养24 h后的H9c2细胞更换新的培养液,分组并加药预处理方法如下。 (1)正常对照组:用培养液正常培养。(2)H2O2损伤组:加入 H2O2使其终浓度为100 μmol/L,作用于细胞2 h。(3)阳性Vc对照组:加入Vc溶液使其终质量浓度为500μg/mL。(4)空白血清组:培养液中加入空白血清。(5)含药血清组:培养液中加入含药血清。(6)高剂量茅苍术提取物作用组:加入 “2.1”项下茅苍术提取物使其终质量浓度为500μg/mL。(7)中剂量茅苍术提取物作用组:加入茅苍术提取物使其终质量浓度为250 μg/mL。(8)低剂量茅苍术提取物作用组:加入茅苍术提取物使其终质量浓度为100μg/mL。各处理组均为先加入H2O2损伤2 h,再加入药物作用24 h,然后观察细胞的形态,并收集各组培养液,检测LDH释放量、SOD活力、MDA水平及细胞活力。
3 结果
3.1 茅苍术提取物入血成分的确定 含药血清主要含有17个成分峰,与空白血清图比较,6个为血清中的固有成分峰,但部分成分在含药血清中的含有量明显增大 (峰2、6、11),其原因有待进一步研究;与茅苍术提取物图的18个峰比较,有7个成分直接进入血清 (峰1、2、4、6、11、15、18),而且含药血清峰1′、2′、3′、4′的来源可能是茅苍术提取物在大鼠体内的代谢成分,其确切来源需进一步鉴别,见图1。
3.2 茅苍术提取物及其含药血清对心肌细胞形态的影响
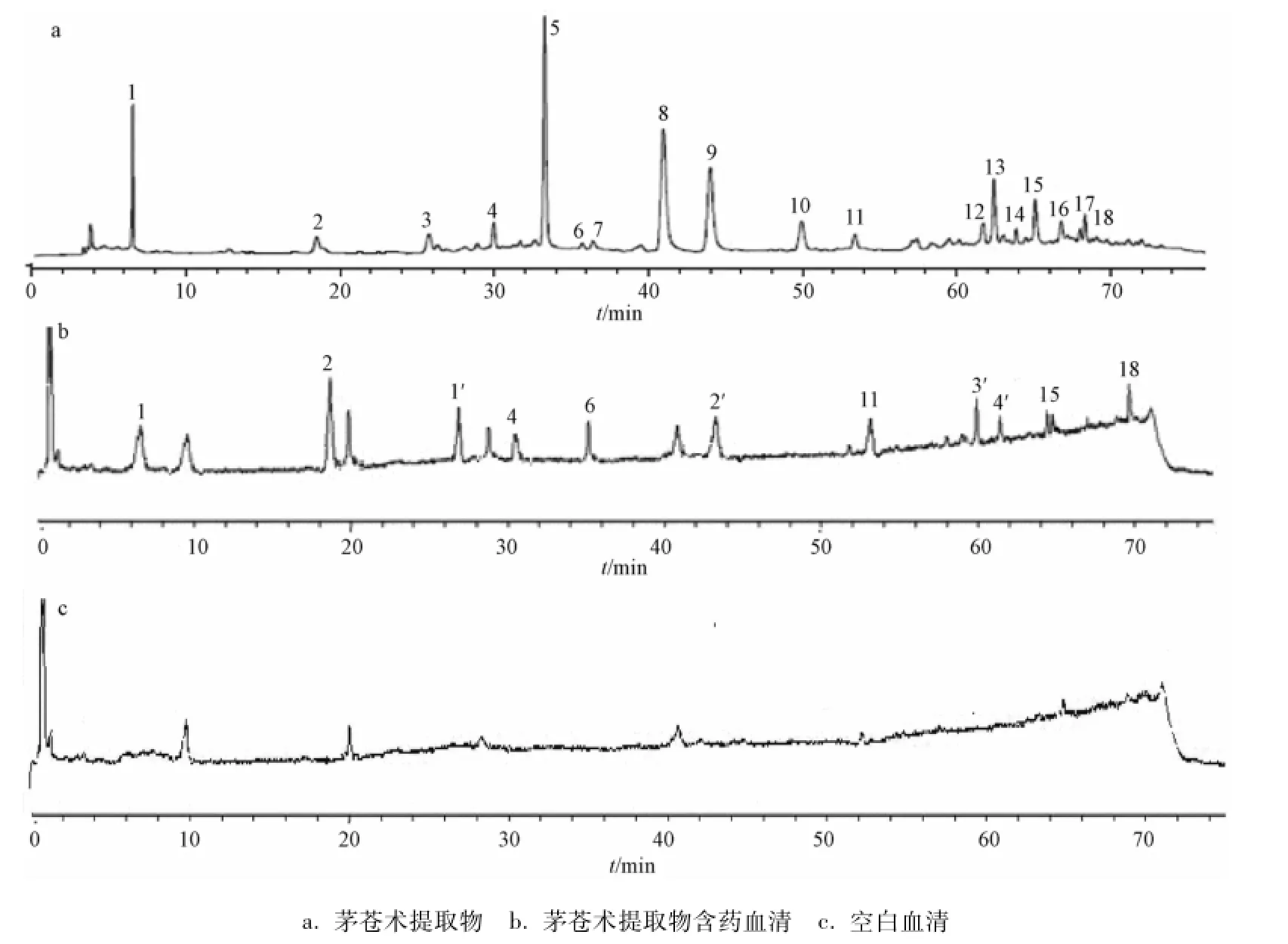
图1 空白血清、茅苍术提取物及其灌胃给药后含药血清的HPLC图
H9c2心肌细胞进行不同药物处理之后,在倒置显微镜下观察各组细胞的形态。结果发现,正常对照组的心肌细胞贴壁生长,呈梭形或不规则三角形,细胞核呈卵圆形并居中或紧贴细胞壁;H2O2损伤组和空白血清组的细胞体积均缩小,呈圆形或者椭圆形,细胞核浓缩,细胞边缘模糊,出现溶解现象;阳性Vc作用组的细胞与H2O2损伤组细胞相比,贴壁细胞数量较多,生长状态良好;含药血清组和不同剂量茅苍术提取物作用组心肌细胞的生长状态有所改善,细胞形态明显好于损伤组,且贴壁细胞数量也多于损伤组;含药血清对细胞有一定程度的保护作用,其生长状态好于空白血清组;不同剂量茅苍术提取物作用组的细胞生长状态不同,高剂量组生长较好,中剂量组次之,低剂量组较差。
3.3 茅苍术提取物及其含药血清对H9c2心肌细胞LDH释放量、SOD活力及MDA水平的影响 乳酸脱氢酶(LDH)释放量、超氧化物歧化酶 (SOD)活力测定结果及丙二醛(MDA)水平变化情况见表2。由表可知,H2O2损伤组的LDH释放量和MDA水平明显增高,分别为正常对照组的1.38倍和4.31倍,而SOD活力明显降低,为正常对照组的34%;高、中、低剂量茅苍术提取物作用组的LDH释放量和MDA水平均有不同程度降低,LDH释放量与H2O2损伤组比较,分别降低了16.01%、14.80%、8.14%,MDA与H2O2损伤组比较,分别降低了28.52%、60.70%、56.36%,显示出剂量依赖关系;3种剂量茅苍术提取物作用组的SOD活力均有不同程度升高,SOD与H2O2损伤组比较,分别升高了60.27%、48.55%、6.96%,而阳性Vc对照组LDH释放量和MDA水平明显低于损伤组,但高于茅苍术提取物作用组,并且SOD活力也明显高于损伤组,但都没有恢复至正常对照组水平;与空白血清组比较,含药血清组亦能显著升高SOD活力,降低MDA水平,但降低LDH含有量不显著。
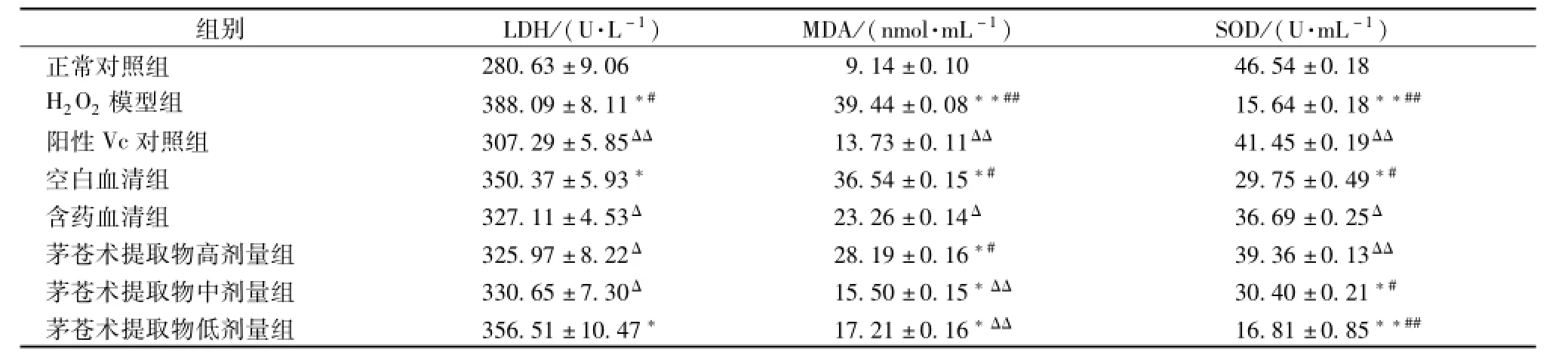
表2 茅苍术提取物含药血清对H9c2细胞H2O2损伤后LDH释放量、SOD活力及MDA水平的影响(x±s,n=8)
3.4 茅苍术提取物及其含药血清对心肌细胞凋亡的影响每个处理组细胞的相对凋亡率用MTT法初步检测判断,结果如图2。由图可知,以正常对照组的相对存活率为标准,H2O2损伤组的损伤率显著增高,为44.34%;3种剂量茅苍术提取物作用组细胞的存活率分别为72.37%、66.19%、55.44%,与茅苍术提取物浓度成明显的效应剂量关系,但低剂量组对H2O2损伤的H9c2心肌细胞的保护作用不明显;与空白血清组相比,含药血清组细胞的存活率也较高,为67.08%;与H2O2模型组比较,正常对照组、阳性Vc对照组和茅苍术提取物高剂量组均有非常显著的差异,含药血清组和茅苍术提取物中剂量组有显著性差异,其余组的差异不明显。

图2 不同处理组细胞的存活率
4 讨论
中药药效物质基础一直是困扰中药现代化研究的一个瓶颈问题,目前相关研究的主要途径是从各种中药中提取分离得到大量化合物,并对其进行一系列活性筛选,从而判断它们是否具有活性。但由于中药成分的复杂多样性,故仅依此来判断往往误差较大[8]。自从20世纪80年代末日本学者田代真一初步提出血清药理学和 “血清药物化学”(serum pharmacochemistry,SPC)的概念后,90年代我国学者王喜军教授也随之提出 “中药血清药物化学”(serum pharmacocemistry of TCM)的概念,从此,血清药理学和血清药物化学在研究中药药效物质基础方面日益凸显出其重要地位[9]。通过两者的联合应用,既可以将体外与体内实验相结合,又可以初步判定进入体内发挥药效的成分 (即入血成分),从而更确切地反映中药的药效物质基础[10]。
目前对茅苍术药效物质基础的研究较少,本实验首次将血清药理学和血清药物化学结合起来,用以研究该植物保护心肌细胞氧化损伤的物质基础。通过应用中药血清药物化学的方法,比较了茅苍术提取物及其灌胃给药前后含药和空白血清的HPLC,结果发现11个与茅苍术相关的入血成分,其中7个是原型成分,另外4个是其经过大鼠体内代谢新产生的成分 (即血中移行成分)。同时,通过应用中药血清药理学方法,并利用体外H9c2心肌细胞氧化损伤模型模拟体内氧化损伤,对茅苍术提取物及其含药血清作用H2O2处理过的H9c2心肌细胞进行研究。结果发现,两者均具有保护心肌细胞氧化损伤的药理活性,说明其保护心肌细胞氧化损伤的物质基础为入血成分,结合血清药物化学研究结果,本实验初步判断为7个茅苍术的原型成分或4个移行成分,其具体物质的鉴定尚有待于进一步研究。
实验发现,茅苍术提取物的量效关系并不明显,对各项相关指标的效应也并不平行,这可能正是中药作用相对较缓和,以及 “多成分、多靶点、多渠道”特点的集中体现。而氧化损伤的病因机制是多环节多通路的,发挥药效作用的往往不是一个有效成分,而是多个有效成分之间的相互协同、相加甚至拮抗的共同效应来发挥疗效,因此使其预防该疾病成为可能。本实验对探清茅苍术的药效物质基础及作用机制,建立多指标质量控制标准具有积极意义。
[1]Dhalla N S,ElmoselhiA B,Hata T,etal.Status ofmyocardial antioxidants in ischemia-reperfusion injury[J].Cardiovasc Res,2000,47(3):446-456.
[2]Carvajal K,El HafidiM,Baños G.Myocardial damage due to ischemia and reperfusion in hypertrigly ceridemic and hypertensive rats:Participation of free radicals and calcium overload[J].JHypertens,1999,17(11):1607-1616.
[3]黄海霞,莫晓燕.中药对心肌细胞损伤的保护作用[J].中草药,2003,34(12):1150.
[4]付梅红,朱东海,方 婧,等.苍术的化学、分子生药学和药理学研究进展[J].中国中药杂志,2009,34(20):2669-2672.
[5]詹丹丹,张 颖.浅谈苍术药理作用及质量控制的研究进展[J].黑龙江医药,2012,25(3):459.
[6]王喜军,孙文军,孙 晖,等.茵陈蒿汤不同配伍变化对大鼠血中移行成分的影响[J].中国天然药物,2008,6(1):43-47.
[7]郑延松,李 源,张珊红,等.用低浓度过氧化氢建立心肌细胞氧化损伤模型[J].第四军医大学学报,2001,22(20):1849-1851.
[8]王喜军.中药及中药复方的血清药物化学研究[J].世界科学技术-中药现代化,2002,4(2):1-4.
[9]王喜军.中药血清药物化学学科的形成及发展[J].世界科学技术-中医药现代化,2010,12(4):632-633.
[10]田友清,尚 靖,何 婷,等.基于中药血清化学及血清药理学方法探讨香青兰保护心肌细胞缺氧/复氧损伤物质基础[J].中国中药杂志,2012,37(5):620-624.
R966
:B
:1001-1528(2015)07-1585-04
10.3969/j.issn.1001-1528.2015.07.044
2014-10-06
国家工业和信息化部2013年度中药材生产建设项目 (2013018);江苏高校优势学科建设工程资助项目 (ysxk-2014);国家基本药物所需中药材种子种苗繁育基地建设项目 (2014-茅苍术)
刘菊燕 (1988—),女,硕士,从事中药资源培育与利用研究。Tel:18252067609,E-mail:niupi909@163.com
*通信作者:巢建国 (1960—),男,硕士,教授,硕士生导师,从事中药资源开发与研究。Tel:13851562488,E-mail:jgchaol016@ 163.com
