玉米须抗糖尿病活性成分的分离及其作用机制研究
2015-01-16徐华影
陈 琛, 徐华影
(天津医科大学第二医院,天津300211)
[成分分析]
玉米须抗糖尿病活性成分的分离及其作用机制研究
陈 琛, 徐华影
(天津医科大学第二医院,天津300211)
目的研究玉米须抗糖尿病的活性成分。方法65%乙醇玉米须提取物分别经硅胶、凝胶及制备液相色谱进行分离,并根据理化性质和波谱技术来鉴定所得化合物的结构。然后,对以上化合物进行3T3-L1成熟脂肪细胞葡萄糖消耗量测试,用以筛选活性化合物,Western blot法检测AMPK蛋白,油红O染色法检测活性化合物对前脂肪细胞3T3-L1分化的影响,RT-PCR法检测PPARγ、c/EBPα的相对表达量。结果从玉米须中分离鉴定了7个化合物,分别为柯伊利素-6-C-β-波伊文糖-7-O-β-葡萄糖苷 (1)、柯伊利素 (2)、香草酸 (3)、木犀草素 (4)、胡萝卜苷 (5)、棕榈酸 (6)、土槿戊酸 (7)。其中,化合物1能有效提高3T3-L1成熟脂肪细胞的葡萄糖消耗量和其AMPK的磷酸化水平,并且该作用能够被AMPK特异性抑制剂化合物C所阻断。另外,它还能显著抑制前脂肪细胞3T3-L1分化及PPARγ、c/EBPα相对基因表达。结论化合物1显示出较好的抗糖尿病活性,而且化合物4为首次从该植物中分离得到。
玉米须;柯伊利素-6-C-β-波伊文糖-7-O-β-葡萄糖苷;木犀草素;葡萄糖消耗;脂肪细胞;分化;抗糖尿病活性
玉米须是禾本科玉蜀黍植物玉米Zea mays L.的花柱和柱头,为我国传统中药,分布广泛,资源丰富,具有利尿、泄热、平肝、利胆等功效[1],目前在临床上被广泛用于治疗高血压、哮喘、鼻炎、肝炎及糖尿病等疾病。现代药理研究表明,它有着降血压、增强免疫功能、抗癌、利尿、抑菌及降血糖等作用[2-3]。
由于在我国大江南北均广泛种植栽培玉米,故玉米须的资源十分丰富。目前,国内外学者对其提取物的药理活性报道较多,但关于具体化合物的生物活性研究较少。因此,为了进一步开发利用玉米须这一药用植物资源,本实验对其进行了系统的提取分离,运用多种色谱方法从玉米须乙醇浸膏中分离鉴定了7个化合物,同时对所得化合物进行抗糖尿病活性筛选。
1 仪器与材料
37℃,5%CO2细胞培养箱 (力康生物医疗科技控股有限公司);超净工作台 (苏州净化设备有限公司);全自动酶标板分析仪(美国Bio-Rad公司);ABI 7500 RT-PCR仪(美国ABI公司);Bruker AV 400核磁共振仪,内标为TMS(德国Bruker公司);UV-3310型紫外-可见分光光度计(日本株式会社日立制作所);倒置显微镜 (日本Olympus公司);PU-2089、RI-2031、UV-2075 JASCO半制备高效液相色谱仪(Jasco日本分光株式会社);YMC-Pack ODS-A SH-343-5色谱柱(20 mm ×250 mm,5μm,日本YMC公司);H200142、H200143 Shodex A sahipak GS-20G色谱柱(20 mm×500 mm,5μm,日本Shodex公司)。
葡萄糖试剂盒 (北京中生北控生物技术股份有限公司);荧光实时定量PCR试剂盒 (瑞士罗氏公司);RNA提取试剂盒 (北京百泰克生物技术有限公司);cDNA合成试剂盒(日本Takara公司);胰岛素(美国Sigma公司);DMEM培养液(含或不含酚红)、胎牛血清(FBS)、PBS(美国Gibco公司);25%胰蛋白酶(含EDTA,以色列Bioind公司);3T3-L1细胞 (中国科学院上海细胞库);AMPK抗体 (美国CST公司);引物合成标记用试剂 (北京奥科生物技术有限责任公司);柱色谱、薄层色谱用硅胶 (青岛海洋化工有限公司)。
所用试剂均为分析纯 (国药集团化学试剂有限公司);氘代试剂(美国Sigma-Aldrich公司)。
玉米须于2012年4月采自河北省唐山市,由兰州大学生命科学学院及甘肃省食品药品检验所共同鉴定为玉米Zea mays L.的花柱和柱头,标本存放于天津医科大学第二医院药剂科中药房 (标本号D20120412)。
2 方法与结果
2.1 提取分离 取自然阴干粉碎的玉米须10 kg,65%的乙醇加热回流提取3次,每次6 h,提取液减压浓缩,得到浸膏330 g,加水混悬后依次用水饱和的石油醚、乙酸乙酯和正丁醇萃取,得到石油醚提取物142 g、乙酸乙酯提取物125 g、正丁醇提取物68 g。玉米须石油醚及乙酸乙酯提取物均经硅胶柱层析 (400 g,100~200目)分离,依次用石油醚-乙酸乙酯 (8∶1、6∶1、4∶1、3∶1、2∶1、1∶1、1∶2、1∶3、纯乙酸乙酯)、乙酸乙酯-甲醇(95∶5、90∶10、80∶20)和纯甲醇梯度洗脱,等量接收洗脱液,TLC检测合并相似组分,分别得到10个 (A~J)和12个组分 (K~V)。
组分B经Toyopeal HW-40凝胶柱层析分离,二氯甲烷-甲醇(2∶1)洗脱,得到BFr.1~BFr.5。BFr.2(859.6 mg)经制备高效液相色谱分离纯化,得到化合物5(16.5 mg)和化合物3(32.6 mg)。组分E经Toyopeal HW-40凝胶柱层析分离纯化,二氯甲烷-甲醇 (2∶1)洗脱,得到EFr.1~EFr.3。EFr.3(952.3 mg)经制备高效液相色谱及薄层色谱分离纯化,得到化合物7(14.5 mg)。组分L经Toyopeal HW-40凝胶柱层析分离纯化,二氯甲烷-甲醇(1∶1)洗脱,得到LFr.1~LFr.4。LFr.2(621.3mg)经制备高效液相色谱分离纯化,得到化合物1(22.1 mg)和化合物4(26.8 mg)。组分S经Toyopeal HW-40凝胶柱层析分离纯化,二氯甲烷-甲醇(1∶1)洗脱,得到SFr.1~SFr.4。SFr.3(523.1 mg)经制备高效液相色谱及重结晶分离纯化,得到化合物2(14.2 mg)和化合物6(21.1 mg)。
2.2 3T3-L1细胞培养及分化方法 3T3-L1前脂肪细胞常规培养,条件为37℃,5%CO2,置于含10%FBS的高糖DMEM培养基中。待细胞长到70%~80%时,接种于6孔板上继续培养,待其长满并达到相互接触抑制2 d后 (计为第0天),更换培养基(含10%FBS、0.5 mmol/L 3-异丁基-1-甲基黄嘌呤、1μmol/L地塞米松、10μg/mL胰岛素的DMEM高糖培养基),3 d后换用只含10 μg/mL胰岛素、10%FBS的DMEM高糖培养基培养3 d,然后以10%FBS的DMEM高糖培养基继续培养,隔天换液。诱导分化10~12 d的3T3-L1细胞至85%以上,并呈脂肪细胞表型时,可用于实验。测定葡萄糖消耗时,换上无血清的培养基,并加入待测样品,37℃下孵育24 h后,葡萄糖临床试剂盒检测培养基的葡萄糖量。实验时分别设置空白组、化合物处理组、空白对照组 (不铺细胞的空白孔),计算24 h后各组细胞的葡萄糖消耗量。测定的数据经SPSS 11.0统计软件进行分析,并以x±s表示,组间差异的显著性采用t检验方法。
2.3 AMPK磷酸化水平的检测 本实验采用免疫印迹法(Western blot法),方法为细胞加裂解液裂解后,取上清液,加入5X蛋白上样缓冲液,95℃下沸煮5 min,10%十二烷基硫酸钠-聚丙烯酰胺凝胶中电泳后转移至PVDF膜上,5%的脱脂牛奶封闭1 h,洗膜后分别加入AMPK和β-actin的抗体,按1∶1 000比例稀释,4℃下过夜。再次洗膜后,加入第二抗体进行反应,室温孵育1 h,洗膜后ECL显色液荧光显色和曝光,采用图像分析系统确定X线光胶片上蛋白条带的相对灰度。
2.4 油红O法观察3T3-L1前脂肪细胞的分化 油红O是脂肪特异性染色剂,能与脂肪结合,使细胞中的脂滴着色,常用于染色分化成熟的脂肪细胞,以观察3T3-L1前脂肪细胞的分化情况。
细胞分化过程中全程干预待测化合物,设置空白组和不同浓度化合物的处理组,取分化成熟的3T3-L1脂肪细胞,弃上清液,pH为7.4的PBS洗涤3次,2.7%的多聚甲醛固定液固定细胞1 h,然后PBS再洗涤3次,室温下晾干细胞,加入油红O染液,室温下密闭染色15 min后弃除染液,60%异丙醇洗涤细胞2次,除去多余的染料,去离子水再震荡洗涤3次,光镜下观察细胞形态并拍照,然后加入2 mL异丙醇于500 nm下测定吸光度。
2.5 RT-PCR检测PPARγ、c/EBPα的mRNA表达
前脂肪细胞3T3-L分化过程中全程处理药物,分化成熟后的细胞加入Trizol试剂裂解,按高纯总RNA快速提取试剂盒说明来提取总RNA,核酸蛋白分析仪检测其浓度,按照cDNA逆转录试剂盒说明来合成cDNA。PPARγ正向引物5′-GACCACTCGCATTCCTTT-3′,反向引物5′-CCACAGACTCGGCACTCA-3′;c/EBPα正向引物5′-GACGAGGACGAGGCGAAGCA-3′,反向引物5′-TCCAGCGACCCGAAACCA-3′;β-actin引物序列正向引物5′-CTAGAAGCATTTGCGGTGGA-3′,反向引物5′-GAAATCGTGCGTGACATTAAG-3′。反应条件为95℃下60 s(预变性),95℃下15 s(变性),60℃下1 h(退火和延伸),循环40次。每次延伸步骤结束后,SYBR Green与双链DNA结合,发出荧光,通过检测反应体系中SYBR Green的荧光强度来检测PCR的产物扩增情况。本实验以β-actin基因表达量为内参,用于校正目的基因表达量,ABI 7500定量仪自带软件完成数据收集,并自动计算出所有样本的Ct,以管家基因β-actin为内参,用样品待测基因的Ct值减去此样品内参的Ct值得到ΔCt,利用函数1/power(2,ΔCt)计算相对表达量,每组实验设3个复孔,并至少重复3次。
2.6 结构鉴定
化合物1:黄色无定形粉末,分子式 C28H32O14,mp 196~198℃,ESI-MS m/z 593[M+ H]+。1H-NMR(C5D5N,500 MHz)δ:7.57(1H,d,J=8.5 Hz,H-6′),7.56(1H,s,H-2′),7.45(1H,s,H-8),7.20(1H,d,J=8.5 Hz,H-5′),6.99(1H,s,H-3),6.39(1H,d,J=12.0 Hz,H-1″),5.52(1H,d,J=7.5 Hz,H-1‴),3.85(3H,s,3′-OCH3),1.54(3H,d,J=6.5 Hz,H-6″)。13CNMR(C5D5N,120 MHz)δ:165.1(C-2),105.8(C-3),184.8(C-4),160.4(C-5),115.6(C-6),165.3(C-7),95.4(C-8),158.4(C-9),107.9(C-10),123.0(C-1′),111.3(C-2′),149.7(C-3′),153.0(C-4′),117.9(C-5′),121.5(C-6′),67.8(C-1″),32.7(C-2″),70.8(C-3″),72.7(C-4″),72.8(C-5″),18.9(C-6″),104.9(C-1‴),76.7(C-2‴),78.8(C-3‴),72.9(C-4‴),80.5(C-5‴),63.5(C-6‴),57.4(3′-OCH3)。以上光谱数据与文献 [4]报道基本一致,因此鉴定化合物1为柯伊利素-6-C-β-波伊文糖-7-O-β-葡萄糖苷。
化合物2:黄色粉末,分子式C16H12O6,mp 281℃,ESI-MS m/z 301[M-H]-。1H-NMR(DMSO-d6,500 MHz)δ:12.78(1H,brs,5-OH),6.87(1H,s,H-3),6.55(1H,d,J=2.2 Hz,H-8),6.22(1H,d,J=2.2 Hz,H-6),7.65(2H,m,H-2′,6′),6.94(1H,d,J=9.0 Hz,H-5′),3.89(3H,s,3′-OCH3)。13C-NMR(DMSO-d6,125MHz)δ:165.5(C-2),103.8(C-3),184.1(C-4),159.4(C-5),100.1(C-6),165.0(C-7),94.4(C-8),159.4(C-9),106.9(C-10),122.9(C-1′),111.9(C-2′),150.7(C-3′),149.1(C-4′),117.8(C-5′),120.5(C-6′),56.2(3′-OCH3)。以上光谱数据与文献 [5]报道基本一致,因此鉴定化合物2为柯伊利素。
化合物3:黄色粉末,分子式 C8H8O4,mp 248~251℃,ESI-MS m/z 167[M-H]-。1H-NMR(DMSO-d6,300 MHz)δ:12.55(1H,s,-COOH),9.69(1H,s,4-OH),3.81(3H,s,3-OCH3),6.88(1H,d,J=6.3 Hz,H-5),7.69(1H,dd,J=6.3,2.5 Hz,H-6),7.53(1H,d,J=2.0 Hz,H-2)。13C-NMR(DMSO-d6,75 MHz)δ:167.1(-COOH),56.1(3-OCH3),122.1(C-1),112.0(C-2),148.3(C-3),151.0(C-4),114.5(C-5),123.1(C-6)。以上光谱数据与文献 [6]报道基本一致,因此鉴定化合物3为香草酸。
化合物4:黄色粉末,分子式C15H10O6,mp>300℃,ESI-MS m/z 285[M-H]-。1H-NMR(CDCl3,400MHz)δ:6.76(1H,s,H-3),6.29(1H,s,H-6),6.55(1H,s,H-8),7.45(1H,brs,H-2′),6.95(1H,d,J=8.3 Hz,H-5′),7.50(1H,dd,J=8.3,2.1 Hz,H-6′)。13C-NMR(CDCl3,100 MHz)δ:165.4(C-2),104.2(C-3),183.5(C-4),162.9(C-5),100.1(C-6),165.7(C-7),95.3(C-8),157.9(C-9),104.6(C-10),121.9(C-1′),114.0(C-2′),147.2(C-3′),150.9(C-4′),117.5(C-5′),119.9(C-6′)。以上光谱数据与文献 [7]报道基本一致,因此鉴定化合物4为木犀草素。
化合物5:白色无定形粉末,分子式C35H60O6,mp 296~298℃,ESI-MS m/z 575[MH]-。1H-NMR(C5D5N,500 MHz)δ:5.36(1H,brs,H-6),5.05(1H,d,J=7.4 Hz,H-1′),0.96(3H,d,J=5.4 Hz,H-21),0.92(3H,s,H-19),0.88(6H,d,J=6.6 Hz,H-26,27),0.65(3H,s,H-18)。13C-NMR(C5D5N,125MHz)δ:37.7(C-1),28.2(C-2),78.2(C-3),39.6(C-4),140.2(C-5),120.2(C-6),32.6(C-7),32.1(C-8),50.5(C-9),37.2(C-10),21.5(C-11),40.6(C-12),42.8(C-13),56.1(C-14),34.5(C-15),26.4(C-16),56.4(C-17),12.2(C-18),20.3(C-19),36.4(C-20),19.1(C-21),34.2(C-22),23.4(C-23),46.3(C-24),30.3(C-25),19.4(C-26),19.3(C-27),29.8(C-28),12.5(C-29),102.5(C-1′),75.9(C-2′),78.8(C-3′),71.9(C-4′),78.6(C-5′),62.2(C-6′)。以上光谱数据与文献 [8]报道基本一致,因此鉴定化合物5为胡萝卜苷。
化合物6:白色无定形粉末,分子式C16H32O2,mp 60~62℃,EI-MS m/z 256[M]+。1H-NMR(CDCl3,500 MHz)δ:2.35(2H,t,J=7.4 Hz,H-2),1.63(2H,m,H-3),1.29(2H,m,H-15),0.87(3H,t,J=7.4 Hz,H-16),1.33(20H,m,H-5~14)。13C-NMR(CDCl3,125 MHz)δ:179.8(C-1),33.2(C-2),31.6(C-4),29.6(C-6),29.4(C-7~12),29.5(C-13),29.3(C-5),29.0(C-14),22.6(C-15),14.3(C-16)。以上光谱数据与文献 [9]报道基本一致,因此鉴定化合物6为棕榈酸。
化合物7:无色针状结晶 (三氯甲烷-甲醇),分子式C20H28O4,mp 288~290℃,ESI-MS m/z 331[M-H]-。1H-NMR(DMSO-d6,500 MHz)δ:0.92(3H,s,H-20),1.13(3H,s,H-19),6.43(1H,s,H-15),2.77(1H,m,H-13),0.94(1H,brd,H-9),1.09(1H,brd,H-5)。13C-NMR(DMSO-d6,125 MHz)δ:39.1(C-1),18.6(C-2),37.7(C-3),42.2(C-4),55.7(C-5),20.5(C-6),37.2(C-7),50.5(C-8),45.2(C-9),40.2(C-10),18.2(C-11),25.2(C-12),40.9(C-13),42.5(C-14),152.6(C-15),138.5(C-16),165.2(C-17),178.5(C-18),28.8(C-19),15.2(C-20)。以上光谱数据与文献 [10]报道基本一致,因此鉴定化合物7为土槿戊酸。
2.7 各化合物对3T3-L1成熟脂肪细胞葡萄糖消耗量的影响 本实验对分离得到的黄酮苷类化合物进行了活性测定,以3T3-L1成熟脂肪细胞为体外模型,测定化合物1~7在1、5、20、50、100μmol/L 5个浓度下对其葡萄糖消耗量的影响。结果发现,化合物1~4能剂量依存性地促进3T3-L1葡萄糖消耗,其EC50值见表1。
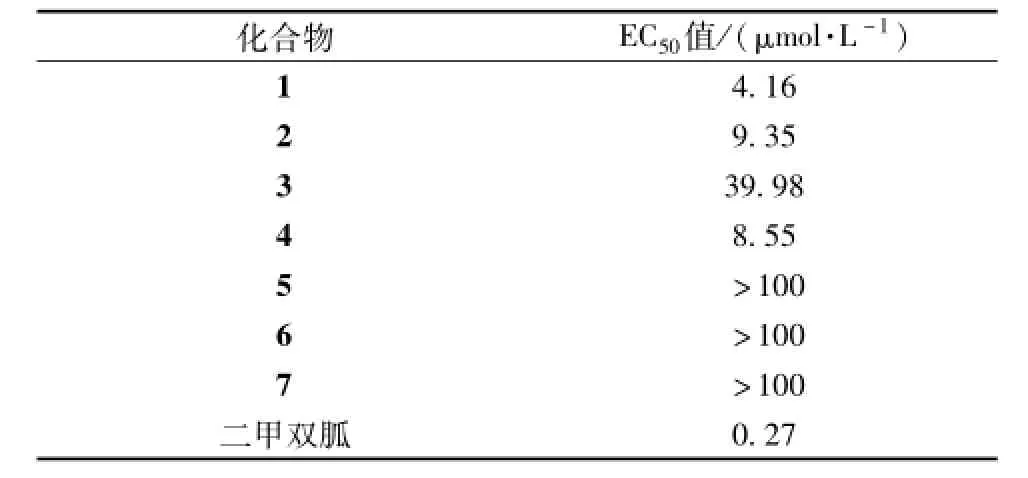
表1 化合物1~7对3T3-L1成熟脂肪细胞葡萄糖量的EC50值Tab.1 E ffects of constituents1~7 on glucose consum p tion of 3T3-L1 adipocyte and the EC50values
2.8 化合物1对3T3-L1成熟脂肪细胞AMPK磷酸化水平的影响 本实验利用3T3-L1成熟脂肪细胞模型,测定化合物1对其AMPK磷酸化水平的影响,实验结果见图1。由图可知,化合物1能显著提高3T3-L1 AMPK磷酸化水平,并呈现出剂量依赖性。

图1 化合物1对3T3-L1成熟脂肪细胞AM PK磷酸化水平的影响Fig.1 Effect of com pound 1 on phosphorylation level of AMPK of 3T3-L1 adipocyte
根据蛋白实验结果,进一步考察化合物1对AMPK的靶点作用,将AMPK特异性抑制剂化合物C与其共同作用于细胞后,测定葡萄糖消耗量,实验结果见图2。由图可知,化合物C能阻断化合物1对3T3-L1葡萄糖消耗的提高作用。
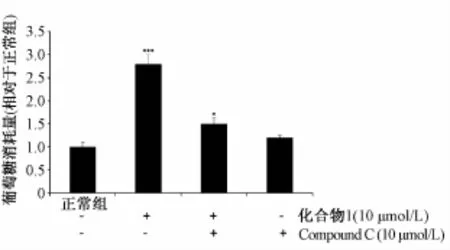
图2 化合物1和化合物C叠加对3T3-L1成熟脂肪细胞葡萄糖消耗量的影响Fig.2 Effect of compound 1 plus com pound C on glucose consum ption of 3T3-L1 adipocyte
2.9 化合物1对前脂肪细胞3T3-L1分化的影响本实验在分化过程中连续加药,之后取分化第10天的细胞进行油红染色,观察其分化程度,实验结果见图3。由图可知,化合物1在浓度为5、10、20μmol/L时均能够抑制前脂肪细胞3T3-L1的分化,分化率分别为68.2%、33.2%、2.6%。
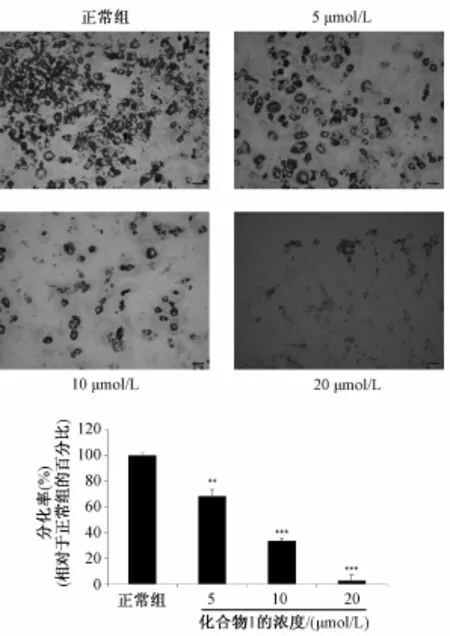
图3 化合物1对前脂肪细胞3T3-L1分化的影响Fig.3 Effect of compound 1 on the differentiation of 3T3-L1 cells
2.10 化合物1对3T3-L1成熟脂肪细胞PPARγ、c/EBPα的mRNA相对表达量的影响 本实验对分化第10天的PPARγ、c/EBPα的mRNA水平进行了测定,实验结果见图4。由图可知,其水平均比分化第0天 (未分化的3T3-L1细胞)显著升高,表明化合物1能显著抑制PPARγ、c/EBPα的mRNA水平,并有剂量依赖性。

图4 化合物1对3T3-L1成熟脂肪细胞PPARγ、c/EBPα的m RNA相对表达量的影响Fig.4 Effects of com pound 1 on them RNA level of PPARγ、c/EBPαof 3T3-L1 adipocyte
3 讨论
玉米须是 《中华人民共和国卫生部药材标准》1985版一部收录的常用药材品种,含有多种化学成分,其药理作用丰富,临床应用广泛。据记载[11],民间应用玉米须治疗糖尿病取得了较好的疗效,其发酵制剂对家兔有非常显著的降血糖作用。此外,文献 [12-13]报道,其水提物对链脲佐菌素或四氧嘧啶所致的糖尿病小鼠有较显著的治疗效果。本实验从玉米须石油醚和乙酸乙酯部位提取分离得到7个化合物 (1~7),并以3T3-L1脂肪细胞为体外细胞模型,对所得化合物进行抗糖尿病活性的初步筛选。结果显示,化合物1~4能有效提高3T3-L1成熟脂肪细胞的葡萄糖消耗量,EC50值分别为4.16、9.35、39.98、8.55μmol/L,其中黄酮苷类化合物1可显著提高3T3-L1 AMPK的磷酸化水平。另外,进一步研究证实,AMPK特异性抑制剂化合物C能阻断化合物1对3T3-L1葡萄糖消耗的影响,推测可能是通过影响AMPK的磷酸化水平所致。而且,化合物1能显著抑制前脂肪细胞3T3-L1的分化,并可剂量依赖性抑制分化过程中的重要转录因子PPARγ及c/EBPα的mRNA相对表达量,显示了确切的体外抗糖尿病作用。同时,以上实验研究为玉米须的现代临床应用也提供了实验依据。
[1]《全国中草药汇编》编写组.全国中草药汇编[M].2版.北京:人民卫生出版社,1996:166.
[2]Wang Y P,Li X G.Progress in study on chemical constituent and pharmacological activity of corn silk[J].SpecialWild Fcon Animal Plant Res,2004,26(2):42-46.
[3]Neucere H,Joseph N.Inhibition of Aspergillus flavus growth by silk extracts of resistant a susceptible corn[J].J Agric Food Chem,1996,44(8):1982-1983.
[4]刘传水,太志刚,李爱梅,等.云南产玉米须的化学成分研究[J].天然产物研究与开发,2011,23(6):1041-1044.
[5]渠桂荣,刘 健,李新新,等.裂叶苣荬菜黄酮成分的研究[J].中草药,1995,26(5):233-235.
[6]陈 泉,吴立军,阮俪军.中药淡竹叶的化学成分研究(II)[J].沈阳药科大学学报,2002,19(4):257-259.
[7]姜洪芳,张 玖,单承莺.亳菊花中黄酮类化合物的分离鉴定[J].中国野生植物资源,2008,27(5):50-52.
[8]张正付,边宝林,杨 健,等.茉莉根化学成分的研究[J].中国中药杂志,2004,29(3):237-239.
[9]袁永亮,叶丹丹,梁会娟,等.河南狭苞橐吾化学成分研究[J].中草药,2012,43(7):1270-1272.
[10]徐 燕,邹忠梅,梁敬钰.玉米须的化学成分[J].中国天然药物,2008,6(3):237-238.
[11]江苏新医学院.中药大词典:上册[M].北京:人民卫生出版社,1980:555.
[12]李 伟,陈颖莉,杨 铭,等.玉米须降血糖的实验研究[J].中草药,1995,26(6):305-306,311,335.
[13]刘 强.玉米须对正常及糖尿病模型小鼠的降血糖作用[J].中草药,1997,28(6):379.
Separation of anti-diabetic constituents from corn stigma and their mechanism of action
CHEN Chen, XU Hua-ying
(The Second Hospital of Tianjin Medical University,Tianjin 300211,China)
AIMTo study the chemical constituents from corn stigma and their anti-diabetic activity.METHODSExtracted with 65%ethyl alcohol,the constituents from corn stigmawere isolated by chromatography of silica gel,gel and preparative HPLC,and their structures were identified on the basis of the physical and chemical properties and spectral analysis.Glucose consumption assays and Western blotwere used to assay their anti-diabetic activity,while Oil red O and RT-PCR were used to assay theireffects on 3T3-L1 differentiation.RESULTSSeven compoundswere isolated from corn stigma and identified as chrysoeriol-6-C-β-boivinopyranosyl-7-O-β-glucopyranoside(1),chrysoeriol(2),vanillic acid(3),luteolin(4),daucosterol(5),palmitic acid(6),pesudolario acid(7).Among them,compound1significantly stimulated glucose consumption and phosphorylation of AMPK in 3T3-L1 adipocytes,and this function was blocked by compound C.Furthermore,it could still inhibit3T3-L1 differentiation and themRNA level of PPARγ,c/EBPα.CONCLUSIONCompound1significantly exhibits antidiabetic activity,and compound4is isolated from this plant for the first time.
corn stigma;chrysoeriol-6-C-β-boivinopyranosyl-7-O-β-glucopyranoside;luteolin;glucose consumption;adipocyte;differentiation;anti-diabetic activity
R284.1
:A
:1001-1528(2015)07-1492-06
10.3969/j.issn.1001-1528.2015.07.021
2014-09-23
陈 琛(1985—),女,药师,从事药房工作。Tel:13512204353,E-mail:chenchenjieji@126.com
