聚乙二醇维生素E琥珀酸酯修饰的姜黄素脂质体的药代动力学及在体肠吸收
2015-01-16万胜利张景勍
万胜利, 何 丹, 钟 萌, 杨 梅, 张景勍
(重庆医科大学药物高校工程研究中心 重庆400016)
聚乙二醇维生素E琥珀酸酯修饰的姜黄素脂质体的药代动力学及在体肠吸收
万胜利, 何 丹, 钟 萌, 杨 梅, 张景勍*
(重庆医科大学药物高校工程研究中心 重庆400016)
目的考察聚乙二醇维生素E琥珀酸酯 (TPGS)修饰的姜黄素脂质体的药代动力学和在体肠吸收。方法大鼠灌胃给药,高效液相色谱法测定各时间点的血药浓度,应用DAS软件处理数据;采用大鼠在体单向灌流模型,考察TPGS修饰的姜黄素脂质体在不同肠段的吸收情况。结果TPGS修饰的姜黄素脂质体的血药浓度-时间曲线下面积(AUC),最大血药浓度 (Cmax)分别为游离药物的2.13、2.61倍;其十二指肠、空肠、回肠、结肠各肠段的吸收速率常数 (Ka)相对于游离药物分别提高了0.84、1.77、1.48、4.99倍,有效渗透率 (Peff)相对于游离药物分别提高了1.56、2.06、2.82、7.17倍。结论TPGS修饰的姜黄素脂质体有良好的促吸收效果,并能提高姜黄素的生物利用度。
姜黄素;聚乙二醇维生素E琥珀酸酯;药代动力学;在体肠吸收
姜黄素(curcumin)是从姜科姜黄属植物的根茎中提取的有效成分,具有抗肿瘤、抗菌、抗炎、降血脂等多种药理作用,但姜黄素水溶性差、在体内吸收差、生物利用度低等缺点限制了其临床应用[1-3]。聚乙二醇维生素 E琥珀酸酯 (D-α-tocopherol polyethylene glycol succinate,TPGS)是一种优良的新型表面活性剂,可作为增溶剂、吸收促进剂应用到载药系统中,能增加药物在胃肠道中的吸收,提高药物的生物利用度[4]。传统脂质体易被网状内皮系统的细胞识别并摄取,而聚乙二醇维生素E琥珀酸酯修饰的脂质体可降低免疫系统对脂质体的识别和清除[5]。因此,本研究将姜黄素制备成聚乙二醇维生素E琥珀酸酯修饰的姜黄素脂质体(D-α-tocopherol polyethylene glycol succinate modified liposomes containing curcumin),以期促进姜黄素的吸收,提高药物的生物利用度。有关聚乙二醇维生素E琥珀酸酯修饰的姜黄素脂质体的药代动力学和在体肠吸收研究还未见报道,本实验对此进行了详细研究,以期为姜黄素制剂的研究与开发提供科学理论依据。
1 仪器和材料
1.1 仪器 UV-VIS3150紫外-可见分光光度计(日本岛津公司);AB204s型电子分析天平 (瑞士Mettler Toledo仪器公司);Agilent 1260液相色谱仪(美国Agilent公司);KQ2200B型超声波清洗器(昆山市超声仪器有限公司);Milli-Q超纯水系统(美国Millipore公司);RE52 AA旋转蒸发器(上海亚荣生化仪器厂);BT100-1L蠕动泵 (保定兰格恒流泵有限公司)。
1.2 试剂 姜黄素 (西安帅诺生物科技有限公司);卵磷脂 (德国Lipoid公司);胆固醇 (美国Sigma公司);聚乙二醇维生素E琥珀酸酯 (成都艾科试剂化学技术有限公司);乙腈 (上海国药集团化学试剂有限公司);甲醇 (美国天地试剂公司);冰醋酸 (成都市科龙化工试剂厂);K-R液(实验室自配)。
1.3 动物 清洁级雄性SD大鼠,体质量 (250± 20)g,由重庆医科大学实验动物中心提供,许可证号:SCXK-(渝)2012-0001。
2 方法
2.1 聚乙二醇维生素E琥珀酸酯修饰的姜黄素脂质体的制备 采用薄膜分散法制备聚乙二醇维生素E琥珀酸酯修饰的姜黄素脂质体。将处方量的姜黄素、胆固醇、卵磷脂和聚乙二醇维生素E琥珀酸酯,共溶于二氯甲烷中,减压旋转蒸发至形成均匀透明薄膜,再加入10 mL超纯水旋转水合,最后在冰浴中超声,即得聚乙二醇维生素E琥珀酸酯修饰的姜黄素脂质体混悬液[4,6]。利用葡聚糖凝胶柱色谱法测定聚乙二醇维生素E琥珀酸酯修饰的姜黄素脂质体的包封率,测得其平均包封率为91.62%,应用马尔文激光粒度仪测得聚乙二醇维生素E琥珀酸酯修饰的姜黄素脂质体的粒径为406.9 nm,Zeta电位为-1.22 mV。
2.2 药代动力学
2.2.1 生物样品的采集及处理 取0.2 mL血浆,置于加有0.1 mL内标尼群地平(5μg/mL)的离心管,加入1.0 mL乙酸乙酯,漩涡2 min,12 000 r/min离心10 min,取上层有机相至另一离心管中,氮气吹干。再用0.1 m L流动相复溶,取20 μL进样,测定各样品中姜黄素和内标的峰面积。
2.2.2 色谱条件及方法专属性[1]以5%冰醋酸溶液-乙腈 (45∶55)为流动相,伊利特C18色谱柱(250 mm×4.6 mm,5μm),柱温30℃,体积流量1 mL/s,426 nm为检测波长。姜黄素和内标能完全分离,血浆中的内源性物质不干扰姜黄素和内标的检测;姜黄素的保留时间为6.8 min,内标的保留时间为8.5 min。
2.2.3 标准曲线的建立 精密称取姜黄素对照品10.7 mg,用少量的甲醇溶解后,转移到100 mL棕色量瓶中,定容得姜黄素对照品溶液。精密称取尼群地平对照品10.0 mg,用少量的甲醇溶解后,转移到10 mL棕色量瓶中,定容后再取500μL于100 mL棕色量瓶中,定容即得尼群地平对照品溶液,4℃保存。
取0.2 mL空白血浆于离心管中,分别加入适量的姜黄素对照品溶液及0.1 mL尼群地平对照品溶液,配制成为质量浓度为26.8、53.5、107、214、428、856、1 712 ng/mL系列质量浓度的姜黄素溶液,加入1.0 mL乙酸乙酯,漩涡2 min,12 000 r/min离心10 min,取上层有机相至另一离心管中,氮气吹干。再用0.1 mL流动相复溶后进样测定。以姜黄素与内标峰面积比 (A)为纵坐标,姜黄素质量浓度 (C)为横坐标,得回归方程A=0.001 1C+0.298 6,r=0.991 1,在26.8~1 712 ng/mL范围内线性关系良好。最低定量限为14 ng/mL。
2.2.4 提取回收率 配制高、中、低 (1 712、214、26.8 ng/m L)质量浓度的姜黄素血浆样品溶液,每种质量浓度样品各5份,按 “2.2.1”项下方法处理后,进样测定,记录姜黄素峰面积为A1,尼群地平峰面积为 B1;另取 1712、214、26.8 ng/m L质量浓度的姜黄素溶液,每种质量浓度样品各5份,分别加入0.1 mL内标尼群地平 (5 μg/mL),氮气吹干后,再用0.1 mL流动相复溶,进样测定,记录姜黄素峰面积为A2,尼群地平峰面积为B2。姜黄素提取回收率可用A1/A2表示,尼群地平的提取回收率用B1/B2表示。结果显示,高、中、低质量浓度时,姜黄素的提取回收率分别为90.47%、87.72%、89.63%,尼群地平的提取回收率分别为92.27%、91.91%、91.97%,符合生物样品分析方法的测定要求。
2.2.5 精密度 高、中、低 (1 712、214、26.8 ng/m L)质量浓度的血浆样品,每种质量浓度样品各5份,1 d内,不同时间点测定,计算得日内精密度的RSD分别为2.46%、2.57%、5.63%,每天测定1次并连续测定5 d,计算得日间精密度的RSD分别为4.69%、4.51%、7.32%,符合生物样品分析方法的测定要求。
2.2.6 准确度 高、中、低 (1 712、214、26.8 ng/mL)质量浓度的血浆样品,每种质量浓度样品各5份,样品经处理后,进样测定,计算高、中、低3个质量浓度的准确度分别为 98.75%、96.88%、91.57%,符合生物样品分析方法的测定要求。
2.2.7 稳定性 高、中、低 (1 712、214、26.8 ng/m L)质量浓度的血浆样品,每种质量浓度样品各3份,分别3次冰冻解冻,考察其稳定性,高、中、低3个质量浓度的 RSD分别为8.17%、4.37%、7.42%,结果显示冻融条件对血浆样品测定没有明显影响。
2.2.8 药代动力学实验 取12只已禁食12 h的SD大鼠,随机分成A、B两组。姜黄素分散于0.5%的羧甲基纤维素纳溶液中,制成混悬液,用于A组灌胃;B组用聚乙二醇维生素E琥珀酸酯修饰的姜黄素脂质体混悬液灌胃,剂量均为50 mg/kg(以姜黄素计),给药后于不同时间点取血,分离血浆[7]。血浆样品按 “2.1.1”项下处理后,进样测定,计算各时间点的血药浓度。
2.2.9 数据处理 采用DAS-2.1.1分析处理数据。
2.3 在体肠吸收
2.3.1 姜黄素测定方法的建立 采用紫外分光光度法测定姜黄素含有量。
2.3.1.1 专属性 用50%乙醇溶液,将姜黄素对照品溶液以及含空白聚乙二醇维生素E琥珀酸酯修饰的姜黄素脂质体的肠循环液,稀释到适当浓度,并在200~800 nm波长范围内扫描。结果显示,姜黄素对照品溶液在426 nm处有最大吸收,而空白聚乙二醇维生素E琥珀酸酯修饰的姜黄素脂质体的肠循环液在此处无干扰。因此选择426 nm作为测定波长。
2.3.1.2 标准曲线 在1.05~7.35μg/mL质量浓度范围内,以质量浓度为横坐标,吸光度为纵坐标进行线性回归,得回归方程:A=0.132 5C+0.028 3,r=0.999 7,线性关系良好。
2.3.1.3 回收率 高、中、低3个质量浓度的平均回收率分别为96.16%、97.07%、95.02%。
2.3.1.4 精密度 日内精密度的RSD分别为0.78%、0.44%、0.58%;日间精密度的RSD分别为1.77%、0.80%、1.19%。
2.3.1.5 稳定性 将聚乙二醇维生素E琥珀酸酯修饰的姜黄素脂质体用空白肠循环液稀释,在37℃温水浴中孵育,分别于0、3、6 h测定溶液中姜黄素含有量。结果6 h内姜黄素含有量没有明显变化,表明聚乙二醇维生素E琥珀酸酯修饰的姜黄素脂质体在在体肠吸收实验中有较好稳定性。
2.3.2 在体肠吸收实验 取6只已禁食12 h的SD大鼠,随机分成1、2两组。姜黄素分散于0.5%的羧甲基纤维素纳溶液中,制成混悬液,用于1组大鼠在体单向肠灌流;2组用聚乙二醇维生素E琥珀酸酯修饰的姜黄素脂质体混悬液进行在体单向肠灌流。SD大鼠麻醉后固定,沿腹中线切开腹腔,分别在十二指肠、空肠、回肠、结肠四个肠段两端插管并结扎。各肠段用37℃的生理盐水冲洗干净,伤口以浸有生理盐水的脱脂棉覆盖,红外灯下保温。接上蠕动泵,以0.4 mL/min的流速,通入KR液饱和整个管道15 min。排空K-R液后,取37℃的姜黄素或聚乙二醇维生素E琥珀酸酯修饰的姜黄素脂质体混悬液以0.4 mL/min的体积流量泵入肠段,待肠段里充满混悬液后,再将体积流量调至0.2mL/min,同时开始计时,灌流1 h,收集四个肠段的流出液。收集到的流出液用50%的乙醇稀释后,测定其中姜黄素的含有量。结束后剪下肠段,测量各肠段的内径 (r)和长度 (l)[8]。
2.3.3 数据处理 按照以下公式计算药物吸收速率常数 (Ka)及有效渗透率 (Peff)[8]。
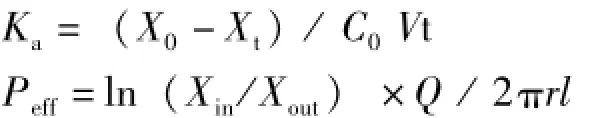
X0和Xt分别表示药物的初始量及流出液中剩余药物量,C0代表初始药物质量浓度,V代表灌注体积,t为灌流时间,Xin为开始灌流时药物的量,Xout为流出液中药物的量,Q为体积流量。
3 结果
3.1 药代动力学实验结果 血浆样品经处理后进样测定,计算各时间点的血药浓度,绘制得到聚乙二醇维生素E琥珀酸酯修饰的姜黄素脂质体和姜黄素的血药浓度-时间曲线图,如图1。由图中可以看出:(1)聚乙二醇维生素E琥珀酸酯修饰的姜黄素脂质体血药浓度-时间曲线下的面积明显比姜黄素的大,说明聚乙二醇维生素E琥珀酸酯修饰的姜黄素脂质体口服生物利用度比姜黄素好;(2)聚乙二醇维生素E琥珀酸酯修饰的姜黄素脂质体的入血速度比姜黄素快,聚乙二醇维生素E琥珀酸酯修饰的姜黄素脂质体在10 min时就达到血药浓度最大值,姜黄素在20 min才出现最大血药浓度,且聚乙二醇维生素E琥珀酸酯修饰的姜黄素脂质体的最大血药浓度远远大于姜黄素,表明聚乙二醇维生素E琥珀酸酯修饰的姜黄素脂质体口服吸收比姜黄素快。

图1 血药浓度-时间曲线(n=6)Fig.1 Plasm a concentration-tim e curve(n=6)
采用DAS-2.1.1软件处理分析血药浓度数据,得到聚乙二醇维生素E琥珀酸酯修饰的姜黄素脂质体及姜黄素的主要药动学参数,如表1。

表1 主要药动学参数(n=6)Tab.1 Pharmacokinetics param eters in the groups(n=6)
结果显示,聚乙二醇维生素E琥珀酸酯修饰的姜黄素脂质体的最大血药浓度 (Cmax)为姜黄素的2.61倍,聚乙二醇维生素E琥珀酸酯修饰的姜黄素脂质体的血药浓度-时间曲线下面积 (AUC)为姜黄素的2.13倍,表明将姜黄素制备成聚乙二醇维生素E琥珀酸酯修饰的姜黄素脂质体后,能促进其吸收,提高其生物利用度,清除率 (CL)降至游离药物的一半左右,增加了药物作用时间。
3.2 在体肠吸收实验结果 计算得吸收速率常数Ka、有效渗透率Peff,如图2、图3。聚乙二醇维生素E琥珀酸酯修饰的姜黄素脂质体十二指肠、空肠、回肠、结肠四段肠段的Ka值与姜黄素各肠段比较,分别提高了0.84、1.77、1.48、4.99倍;聚乙二醇维生素E琥珀酸酯修饰的姜黄素脂质体各肠段的Peff值与姜黄素各肠段比较,分别提高了1.56、2.06、2.82、7.17倍。说明聚乙二醇维生素E琥珀酸酯修饰的姜黄素脂质体能改善各肠段的吸收,特别是结肠的吸收。
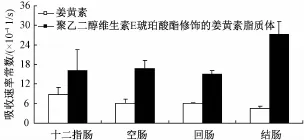
图2 大鼠各肠段的吸收速率常数(n=3)Fig.2 Kaobtained by in situ perfusion(n=3)

图3 大鼠各肠段的有效渗透率(n=3)Fig.3 Peffobtained by in situ perfusion(n=3)
药代动力学和在体肠吸收的结果都表明,聚乙二醇维生素E琥珀酸酯修饰的姜黄素脂质体能促进药物在动物体内的吸收。
4 讨论
包封率是评价脂质体质量的主要指标,本实验采用薄膜分散法制备聚乙二醇维生素E琥珀酸酯修饰的姜黄素脂质体,包封率为91.62%,许汉林等采用同样方法,所得普通姜黄素脂质体的包封率为73.25%[6]。与许汉林等所得普通姜黄素脂质体的包封率比较,本实验中脂质体包封率有明显提高,可能是因为聚乙二醇维生素E琥珀酸酯能提高包封率。本研究中,聚乙二醇维生素E琥珀酸酯修饰的姜黄素脂质体的AUC为781.64μg·h/L,是游离药物的2.13倍,是罗见春等报道的姜黄素磷脂复合物AUC的1.23倍[9]。许汉林等报道,姜黄素脂质体的相对生物利用度是游离药物的90%[10];本研究中聚乙二醇维生素E琥珀酸酯修饰的姜黄素脂质体的相对生物利用度为游离药物的213%。可见普通脂质体并不能提高姜黄素的生物利用度,而聚乙二醇维生素E琥珀酸酯修饰的姜黄素脂质体能有效地提高姜黄素的生物利用度,可能是因为:(1)聚乙二醇维生素E琥珀酸酯有良好的促吸收作用[5,11];(2)脂质体有良好的生物相容性,可提高药物的生物利用度。聚乙二醇维生素E琥珀酸酯修饰的姜黄素脂质体的血药浓度-时间图出现双峰,可能的原因有: (1)口服聚乙二醇维生素E琥珀酸酯修饰的姜黄素脂质体后,聚乙二醇维生素E琥珀酸酯修饰的姜黄素脂质体在组织中积蓄,在血药浓度下降到一定程度后,又出现二次释放入血; (2) 肝肠循环所导致[12]; (3)聚乙二醇维生素E琥珀酸酯有缓释作用,聚乙二醇维生素E琥珀酸酯修饰的姜黄素脂质体可能也有缓释作用,在体肠吸收实验中,聚乙二醇维生素E琥珀酸酯修饰的姜黄素脂质体在结肠段的吸收最好,也提示聚乙二醇维生素E琥珀酸酯修饰的姜黄素脂质体有缓释作用,速释和缓释两部分药物的释药速度不同,因此形成了双峰。
在体肠吸收实验中,聚乙二醇维生素E琥珀酸酯修饰的姜黄素脂质体各肠段的吸收都比游离药物好,聚乙二醇维生素E琥珀酸酯修饰的姜黄素脂质体能有效地改善各肠段吸收的原因可能有:(1)聚乙二醇维生素E琥珀酸酯作为促吸收剂,能有效地促进药物在肠道的吸收[5,11]; (2)脂质体具有类生物膜结构,有良好的生物相容性,能促进药物的吸收。聚乙二醇维生素E琥珀酸酯修饰的姜黄素脂质体在结肠段的吸收最好,其结肠段的Ka值为游离药物结肠段Ka值的5.99倍,为游离药物十二指肠段Ka值的3.10倍,可能是因为 (1)聚乙二醇维生素E琥珀酸酯作为有良好生物相容性的促吸收剂,能大大改善结肠段的吸收; (2)蔡启祥等学者报道,聚乙二醇类物质,能增加药物在结肠段的黏附,促进药物吸收,有结肠靶向的作用[13],聚乙二醇维生素E琥珀酸酯作为聚乙二醇类物质,可能也有结肠靶向作用,具体机制有待进一步研究。
聚乙二醇维生素E琥珀酸酯修饰的姜黄素脂质体的药代动力学及在体肠吸收的研究结果都证明聚乙二醇维生素E琥珀酸酯修饰的姜黄素脂质体对姜黄素有良好的促吸收作用,为姜黄素口服制剂开发奠定了科学基础。
[1]李 艺,杨 林,赵春景,等.姜黄素分子包合物的药代动力学研究[J].中成药,2013,35(12):2631-2634.
[2]刘会珍,陆兔林,毛春芹,等.莪术不同炮制品中倍半萜及姜黄素类成分的比较[J].中成药,2014,36(4):804-808.
[3]陈 艳,邹文静,王盛丰,等.姜黄素诱导骨髓间充质干细胞分化成肝细胞[J].中成药,2014,36(6):1124-1128.
[4]王文喜,张 楠,单伟光,等.聚乙二醇1000维生素E琥珀酸酯修饰多柔比星脂质体的制备和性质[J].中国药学杂志,2011,46(17):1340-1344.
[5]庞 鑫,翟光喜.维生素E聚乙二醇1000琥珀酸酯在药物制剂中的应用[J].中国新药与临床杂志,2014,33(4):247-251.
[6]许汉林,张 念,程光明,等.姜黄素脂质体制备工艺的研究[J].湖北中医学院学报,2009,11(1):36-39.
[7]Chen H,Wu J,Sun M,et al.N-trimethyl chitosan chloridecoated liposomes for the oral delivery of curcumin[J].J Liposome Res,2012,22(2):100-109.
[8]Dahan A,West B T,Amidon G L.Segmental-dependentmembrane permeability along the intestine following oral drug administration:Evaluation of a triple single-pass intestinal perfusion(TSPIP)approach in the rat[J].Fur JPharm Sci,2009,36(2-3):320-329.
[9]罗见春,何 丹,尹华峰,等.姜黄素磷脂复合物的药代动力学评价[J].第二军医大学学报,2014,35(7):754-757.
[10]许汉林,孙 芸,邵继征,等.姜黄素脂质体在大鼠体内药代动力学研究[J].湖北中医学院学报,2007,9(1):42-43.
[11]李一木,赵艳丽,李凌冰.紫杉醇混合胶束的制备及其大鼠在体肠吸收[J].中国药学杂志,2013,48(13):1076-1082.
[12]叶 青,霍美蓉,周建平.紫杉醇-两亲性壳聚糖胶束大鼠药代动力学和在体肠吸收[J].中国药科大学学报,2012,43(5):401-405.
[13]蔡启祥,张建祥,朱康杰.基于聚酸酐的生物黏附性载药高分子[J].浙江大学学报:工学版,2004,38(9):1222-1226.
Pharmacokinetics and intestinal absorption of D-α-tocopherol polyethylene glycol succinatemodified liposomes containing curcum in in rats
WAN Sheng-li, HE Dan, ZHONGMeng, YANGMei, ZHANG Jing-qing*
(Medicine Fngineering Research Center,Chongqing Medical University,Chongqing 400016,China)
AIMTo study the pharmacokinetics and intestinal absorption of D-α-tocopherol polyethylene glycol succinate(TPGS)modified liposomes containing curcumin in rats.METHODSPharmacokinetics parameters were determined by DAS analysis through data of blood concentrations harvested from HPLC after oral administration.The single pass intestinal perfusion method was used to investigate the absorption mechanism in different segments of the intestine.RESULTSThe AUC and Cmaxvalues ofmodified TPGS liposomes containing curcumin were 2.13 and 2.61 times that of the free drug,respectively.Their Kavalues in duodenum,jejunum,ileum and colon were 0.84,1.77,1.48,and 4.99 times higher than that of free curcumin,respectively,while their Peffvalues in duodenum,jejunum,ileum and colon were 1.56,2.06,2.82,and 7.17 times higher,respectively.CONCLUSIONTPGSmodified liposomes containing curcumin can improve the absorption and bioavailability of curcumin.
curcumin;D-α-tocopherol polyethylene glycol succinate(TPGS);pharmacokinetics;intestinal absorption
R969.1
:A
:1001-1528(2015)07-1452-05
10.3969/j.issn.1001-1528.2015.07.013
2014-08-12
重庆市教育委员会首批高等学校优秀人才资助项目 (KJ120321)
万胜利 (1991—),女,硕士生,从事药物新剂型与新技术研究。
*通信作者:张景勍 (1973—),女,教授,博士生导师,从事药物新剂型与新技术研究。Tel:13320359206,E-mail:zjqrae01@ 163.com
