pH-时滞结合型丹皮酚结肠靶向片的包衣处方考察
2015-01-16徐本亮蔡芸芸浦益琼陶建生吴佩颖
徐本亮, 蔡芸芸, 张 琦, 浦益琼, 王 冰*, 张 彤, 陶建生, 吴佩颖
(1.上海中医药大学,上海201203;2.复旦大学附属肿瘤医院闵行分院,上海200240;3.上海杏灵科技药业股份有限公司,上海201703)
[制剂]
pH-时滞结合型丹皮酚结肠靶向片的包衣处方考察
徐本亮1, 蔡芸芸2#, 张 琦1, 浦益琼1, 王 冰1*, 张 彤1, 陶建生1, 吴佩颖3*
(1.上海中医药大学,上海201203;2.复旦大学附属肿瘤医院闵行分院,上海200240;3.上海杏灵科技药业股份有限公司,上海201703)
目的对丹皮酚片进行包衣,制备pH-时滞结合型丹皮酚结肠靶向片剂。方法通过确定各包衣层增重,考察体外积累释放度。结果以美多秀E6为隔离层增重1.7%,以10%PVP苏丽丝为时滞层增重3%,以雅克宜为肠溶层增重3.5%,制得结肠靶向制剂在0.1mol/L HCl 2 h、PBS(pH 6.8)3 h释药小于10%,在PBS(pH 7.8~8.0)2 h后药物累计释放达到80%以上。结论制得的pH-时滞结合型丹皮酚结肠靶向片能够控制药物在模拟胃液pH环境中不释药或少释药,而在模拟小肠pH环境 (3 h后)和模拟结肠pH环境中大量释放,体外释放结果表明能够达到结肠定位释药目的。
丹皮酚;pH-时滞结合;结肠靶向;包衣工艺
炎症性肠病(IBD)是多见于回肠末端和临近结肠的肉芽肿结肠炎、节段性肠炎或局限性肠炎,是一种原因不明的直肠和结肠的慢性炎症性疾病[1]。现代医学普遍认为IBD发病机理的研究主要集中在感染炎症反应和免疫异常等方面[2]。丹皮酚(paeonol)是从中药徐长卿Cynanchum panic-ulatum Kitag.和牡丹Paeonia suffruticosa Andr.中提取分离出来的一种活性成分[3],具有抗炎、抗变态反应、免疫调节、抗肿瘤等多种药理作用[4-6],目前临床主要用于风湿炎症、抗过敏等[7]。因其稳定性差、水溶性低、易挥发,药动力学表明其体内半衰期短,吸收主要在小肠部位,常规口服制剂难以到达结肠部位,不适合用于IBD[8-10]。本实验根据人体胃肠道生理特点采用多层包衣的方法 (即以肠溶衣膜保护制剂安全通过胃部而不受胃不规则排空的影响,以时滞型包衣控制制剂到达结肠再大量释药)[11-13],制备pH-时滞结合型丹皮酚结肠靶向制剂,尝试开发丹皮酚结肠靶向剂型,为IBD临床用药的开发提供前期研究基础。
1 仪器与材料
1.1 仪器 Agilent1200高效液相色谱系统(Agilent公司);SK5200H超声波清洗仪 (上海科导超声仪器有限公司);RCZ-6C1型药物溶出度仪(上海黄海药检仪器厂);PHS-3C pH计 (上海精密科学仪器公司);BS124S电子天平 (塞多利斯科学仪器有限公司);BYW型无极调速包衣机 (宝鸡建华制药机械有限公司);ZB-0.10/B-F30空气压缩机 (上海捷豹压缩机制造有限公司);HT-833远红外线测温仪 (宏诚集业电子科技有限公司);TGL-20B高速离心机 (上海安亭科学仪器厂)。
1.2 材料 丹皮酚片芯 (自制,含丹皮酚80 mg/片);丹皮酚对照品 (0708-9704,中国食品药品检定研究院);Methocel E6 LV(美多秀E6,上海卡乐康包衣技术有限公司);水性乙基纤维素分散体(苏丽丝Surelease,上海卡乐康包衣技术有限公司);水性丙烯酸树脂肠溶系统 (雅克宜93O,上海卡乐康包衣技术有限公司);聚维酮 K30(PVP K30,ISP公司);甲醇为色谱纯;水为纯化水;其余试剂均为分析纯。
2 方法
2.1 丹皮酚测定方法
2.1.1 色谱条件[10]迪马Diamonsil C18色谱柱(5μm,4.6 mm×250 mm);流动相为甲醇-水(65 ∶35);柱温为25℃;体积流量为 1.0 mL/min;检测波长为274 nm。理论塔板数按丹皮酚峰计算应不低于5 000。
2.1.2 标准曲线制备 称取丹皮酚对照品10 mg 3份,精密称定,分别置于50 mL量瓶中,加15 m L甲醇溶解完全,再以0.1 mol/L HCl、磷酸盐缓冲液(PBS pH 6.8、7.8~8.0)定容得对照品母液。精密移取 0.125、0.625、1.25、2.5、5、7.5、10 mL置25 mL量瓶中,分别加0.1 mol/L HCl、PBS(pH 6.8)、PBS(pH 7.8~8.0)稀释至刻度,配制成系列浓度溶液,摇匀,微孔滤膜过滤,作为对照品溶液,精密吸取上述对照品溶液各20μL分别注入高效液相色谱仪,记录峰面积,以质量浓度 (μg/mL)为横坐标,峰面积为纵坐标绘制标准曲线,计算得0.1 mol/L HCl回归方程Y=97.938X+20.199,r=0.999 9,线性范围为1.035~82.8μg/mL;PBS(pH 6.8)回归方程Y= 95.566X+45.086,r=0.999 6,线性范围为1.035~82.8μg/mL;PBS(pH 7.8~8.0)回归方程Y=94.749X+21.78,r=0.999 8,线性范围为1.093~87.44μg/mL。
2.2 累积释放度测定方法 释放度测定介质为0.1 mol/L HCl、PBS(pH 6.8)、PBS(pH 7.8~8.0)(模拟胃液、小肠液、结肠液的pH环境),浆法转速100 r/min,温度(37±0.5)℃,以模拟包衣片在胃肠道pH环境中的释药行为。具体各包衣层释放度测定方法见表1。设定取样时间取样,每次取样1 mL,用微孔滤膜滤过,HPLC法测定,计算丹皮酚的体外累积释放度。不同溶出介质更换应于5 min内完成,每次取样后补充相同温度、体积的新鲜介质。

表1 累积释放度考察方法Tab.1 In vitro conditions for release test
根据实验设计,隔离层应在小肠下端、盲肠或结肠部位开始溶蚀,隔离层包衣所使用材料溶解不受pH影响,故使用PBS(pH 6.8)做溶出介质;时滞层应在进入小肠后开始暴露,其材料主要是水不溶性的乙基纤维素 (EC),同样不受pH影响,因此也使用PBS(pH 6.8)做溶出介质;肠溶衣是经胃进入小肠后开始溶蚀,其考察方法为先在0.1 mol/L HCl释放2h,再置PBS(pH 6.8)考察;完整复合包衣片应模拟人体胃肠道pH环境,先后在0.1 mol/L HCl 2h、PBS(pH 6.8)3 h和PBS(pH 7.8-8.0)3 h进行考察。
表1中隔离层为在片芯基础上包以胃溶型美多秀衣膜,时滞层为在隔离层基础上包以苏丽丝衣膜,肠溶层为隔离层基础上包以雅克宜肠溶衣膜,时滞-肠溶结合为在隔离层基础上先包以时滞层再包上肠溶层衣膜。
2.3 包衣方法 本实验采用多层包衣的方法制备结肠靶向片,将片芯由内至外先后包上隔离层、时滞层和肠溶层。首先将素片芯使用水溶性包衣材料包覆一层保护隔离衣,然后将包有隔离层的药片包以时滞层和肠溶层,考察在PBS(pH 6.8)中药物缓释3.5 h左右所需的时滞层增重和0.1 mol/L HCl中不释药所需的肠溶层增重。在考察达到肠溶效果所需的肠溶衣厚度时,为了避免缓释层的影响(有缓释层的药片在0.1 mol/L HCl中2 h内也只少量释药),采用包有隔离层的片芯直接包上肠溶衣膜方法考察肠溶层增重。考虑到完整包衣时,时滞层可能和肠溶层会相互影响,最后根据隔离层、时滞层、肠溶层考察结果,制备复合包衣片,考察药物释放以优化包衣处方。
包衣过程中包衣锅45°倾角,转速 40~50 r/min,压缩空气压力0.3~0.4 MPa,喷枪口径为1.5 mm。
2.3.1 隔离层包衣方法 将美多秀E6粉末分散于无水乙醇中,在不断搅拌条件下缓慢滴加蒸馏水,使乙醇∶水为6∶4,继续搅拌至完全溶解呈透明溶液,浓度6%(m/V)。
将片芯置包衣锅中,开动包衣锅,充分打磨片芯30 min,去除不合格的片芯,冷风吹去细粉尘,称定质量,包衣锅内预热,喷入包衣液,调节喷雾流量、包衣锅转速达到较佳的包衣效果,片床温度保持在30~35℃。
2.3.2 时滞层包衣方法 苏丽丝是卡乐康公司开发上市的乙基纤维素水分散体,其不受酸、碱度影响,依靠包衣厚度来控制释药时间,其含固量为25%的乙基纤维素水分散体,较黏稠,应根据其一般配制方法将其稀释至含固量为8%~15%。
15%苏丽丝配制:在不断搅拌条件下,缓慢滴加蒸馏水稀释,使其含固量为15%。
10%PVP K30-苏丽丝配制:称取相当于所需苏丽丝含固量10%的PVP K30,溶于蒸馏水后,在不断搅拌条件下缓慢滴加至苏丽丝原液中,稀释至总固质量分数为15%。
取包有隔离层片芯置包衣锅中,包衣锅内预热,喷入包衣液,调节喷雾流量、包衣锅转速达到较佳的包衣效果,片床温度保持在40℃。
2.3.3 肠溶层包衣方法 雅克宜是卡乐康公司开发的完全配方的全水肠溶包衣材料,可以快速分散在水溶剂中,使用方便,无需另外添加增塑剂,肠溶效果持久稳定。
在不断搅拌蒸馏水条件下,加入雅克宜粉末,使其含固量为20%(m/m),继续搅拌30 min,使其均匀分散。
取包有隔离层片芯或时滞层片芯置包衣锅中,包衣锅内预热,喷入包衣液,调节喷雾流量、包衣锅转速达到较佳的包衣效果,片床温度保持在30℃。
3 结果
3.1 隔离层包衣增重考察结果 因本层仅为起隔离作用,增重不需很大,经考察当增重达到1%以上时,片芯不会因40℃高温长时间加热而使丹皮酚含有量下降,能够保持片芯光滑完整,且包美多秀E6时片芯不易粘连,说明可以起到很好的隔离作用,对片芯能够起到很好的包覆作用,因此确定隔离层增重为1%~2%。同时考察隔离层对药物释放的影响,结果见图1。

图1 片芯与隔离层包衣片释放曲线比较 (n=6)Fig.1 Cumulative paeonol-release curves of different tablet cores and shielded-layers(n=6)
从图1中可以看出,美多秀E6的隔离层包衣对药物释放影响较小,与片芯相比释药稍慢,但在30~40 min内也可以将药物释放达到80%以上,基本可以认为隔离层对丹皮酚的释放不构成太大影响。
3.2 时滞层包衣增重考察结果 苏丽丝为乙基纤维素的水分散体,单纯包以苏丽丝能够达到缓控释作用,但通过预试验发现单纯以苏丽丝包衣较难以控制药物释放,可能由于片芯较大,较小的包衣增重变化对药物释放的延迟影响较大。如图2所示,单纯包苏丽丝当增重2.6%与3%时两者溶出释放曲线比较,可见当苏丽丝包衣增重2.6%基本无缓释作用,而增重3%时12 h释放仍未达到15%。因此,加入适量致孔剂能够更易于控制药物释放。常用致孔剂有HPMC、PVP、乳糖等,HPMC与苏丽丝相容性不是很好,一般多用PVP K30作致孔剂。本研究中采用PVP K30常用剂量,即相当于苏丽丝固含量的10%。
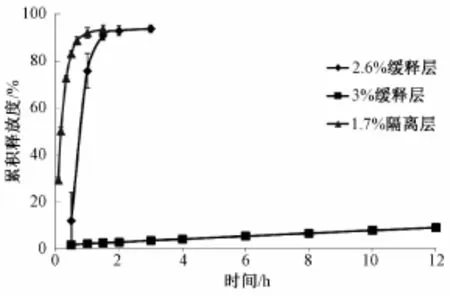
图2 不含致孔剂缓释层增重对丹皮酚释放度影响(n=6)Fig.2 Cumulative paeonol-release curves of different sustained-release coating layers w ithou t porogen (n=6)
考察含10%PVP时滞层包衣不同增重:当包衣增重2%、2.7%、3.1%、3.3%、4%时考察包衣片在PBS(pH 6.8)中的药物释放情况。药物释放结果见图3。

图3 含10%PVP不同缓释层增重对丹皮酚释放度影响(n=6)Fig.3 Cumulative paeonol-release curves of different weight gains of sustained-release coating layers w ith 10%PVP(n=6)
由上图可知,当包衣增重越大时,药物释放时间延长,即时滞性越好,当包衣增重2%,释药时滞仅为0.5 h,增重2.7%时约为1 h,增重达到3.1%时大量释药约在2 h之后,3.3%时约为3.5 h,而增重达到4%时包衣膜较难破裂而无法大量释药。原设计时滞时间在3.5 h左右,因此这里选用时滞层增重为3.3%。
3.3 肠溶层包衣增重考察结果 当肠溶衣包衣增重3.5%、7%、10%时,考察包衣片在0.1 moL/L HCl中2 h及PBS(pH6.8)中药物释放情况。药物释放结果见图4。
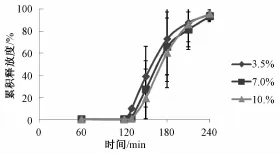
图4 不同肠溶包衣增重对丹皮酚释放度影响 (n=6)Fig.4 Cumulative paeonol-release curves of different weight gains of enterosoluble coating levels (n=6)
由上图可知,当包衣增3.5%以上时,0.1 mol/LHCl中2 h,药物释放度基本没有药物释放,在PBS(pH 6.8)中10 min药片就开始崩解,1.5 h累积释放都能达到80%以上,2 h达到95%以上。就单纯肠溶包衣,只要达到一定厚度后,增重大小对释放曲线影响不大,增重3.5%以上时就能保障药片在0.1 mol/L HCl中不释药,而较大增重时,由于片芯本身崩解快的原因,虽然肠溶衣膜没有完全溶蚀掉,包衣片也能较快崩解,药物也能较快释放,因此考虑到再包上时滞层后肠溶层不能快速溶蚀,肠溶层不宜包衣太厚。从3.5%肠溶层在0.1 mol/L HCl中情况看,时间达到3~4 h后,虽无药物释放但有肠溶层鼓起情况出现,因此肠溶层也不能太薄。综合考虑,这里选用肠溶层增重4%。
3.4 包衣工艺验证及优化 根据包衣工艺考察结果,制备两批双层包衣片,处方1时滞层增重3.2%、肠溶层增重4.4%,处方2时滞层增重3%、肠溶层增重3.5%,分别在0.1 mol/L HCl溶液2 h、PBS(pH 6.8)3 h、PBS(pH 7.8~8.0)至结束测定丹皮酚释放度。结果发现包衣片在pH 6.8以上溶液中时滞时间约为4.5 h以上,缓释时间略长于设计,因此调整时滞层及肠溶层包衣增重为3%、3.5%,释放结果见图5。

图5 包衣工艺优化(n=6)Fig.5 Cumulative paeonol-release curve of coated tablets (n=6)
从图5中可以看出,按处方1、2包衣方案两者都能保证在0.1 mol/L HCl中不释药,处方1在 pH 6.8以上PBS中时滞约为4.5 h以上,而处方2时滞约为3.5 h,因此确定采用处方2的包衣工艺,即时滞层增重3%,肠溶层增重3.5%。
4 讨论
随着包衣材料的研究和包衣技术的发展,包衣工艺越来越成熟,应用更方便。尤其是包衣材料水分散体的开发和应用,更有利于劳动保护和生产使用[14],本实验所采用的苏丽丝和雅克宜均为水分散体。
丹皮酚性质不稳定,易挥发[15],本实验采用美多秀做隔离层,较少的增重就能很好防止丹皮酚在包苏丽丝时大量挥发,又可以防止片芯粘连,但隔离层对药物溶出也有一定的影响,增重不宜过大。
苏丽丝为乙基纤维素的水分散体,文献报道,以乙基纤维素为主要成分的薄膜衣控制药物释放,对片芯要求较高,片芯具有良好的崩解性能的同时,崩解时限也不能相差太多[16],否则包衣片药物释放差异较大。苏丽丝虽然是很好的缓释包衣材料,但直接包衣较难控制药物释放,加入10% PVP作为致孔剂后可以改善包衣可操控性。但从溶出曲线可以看到丹皮酚前期几乎很少或没有释放,且增重较小的差异对溶出影响很大,原因一方面可能是由于药片较大 (Φ8 mm),较小的增重衣膜厚度已增加不少,阻滞药物溶出,这样的工艺在小试实验研究时尚能控制,但大量包衣工艺可能还需要进一步研究;另一方面,可能由于丹皮酚水溶性差,在药片完整状态时溶出速度较慢。随着水分子通过膜孔进入内部,片芯吸水膨胀致使衣膜破裂,从而药物大量释放,这也是本实验时滞设计的原理,但包衣片衣膜破裂片芯崩解时间有一定的差异性,这一问题还有待进一步研究。
雅克宜作为全配方肠溶包衣材料,包衣温度、工艺要求都很低,对于普通肠溶制剂只要达到一定范围就能达到肠溶效果,但与时滞包衣结合时就要严格控制增重范围,包衣太少衣膜层薄水易渗透,达不到隔水效果,太厚则肠溶层不能快速溶蚀,水分子不能及时渗透过时滞层造成时滞过长。
[1]杨志红,邓彤斌,王梦明,等.炎症性肠病的病因学和药物治疗研究进展[J].中国药师,2013,16(6):905-907.
[2]谢 睿,李全朋,缪 林.炎症性肠病免疫发病机制研究进展[J].医学研究生学报,2013,26(2):206-210.
[3]张荣发.丹皮酚的研究进展[J].中国医药指南,2008,6(18):110,112.
[4]刘雁丽,韦柳成,沈振国.丹皮酚的药理作用、提取及含量测定方法研究进展[J].安徽医药,2012,47(1):72-76.
[5]李 明,谭诗云.丹皮酚对结肠癌细胞系LoVo细胞增殖、凋亡的影响及其机制[J].中国医药导报,2014,11(7):23-27.
[6]杨正生,彭振辉,姚青海,等.丹皮酚的药理作用研究进展[J].中国药物与临床,2011,11(5):545-547.
[7]唐海燕,杨 石,王见宾.丹皮酚制备工艺、剂型改革及临床应用概述[J].江苏中医药,2004,25(2):58-80.
[8]郭 琳,郭伟英.丹皮酚制剂不同给药途径在家兔体内的药动学研究[J].辽宁医学院学报,2007,28(4):4-8.
[9]马丽焱,缪剑华,许旭东,等.丹皮酚在清醒大鼠体内的药动学和绝对生物利用度[J].时珍国医国药,2009,20(2):413-414.
[10]徐本亮,王 冰,浦益琼,等.丹皮酚平衡溶解度与油水分配系数测定及大鼠在体肠吸收研究[J].中成药,2012,34(10):1892-1896.
[11]詹璐璐,尹东东,王杏林,等.结肠靶向给药制备技术的研究进展[J].中国新药杂志,2014,23(16):1868-1874.
[12]李小芳,王 娇,李 珂,等.pH-时滞型苦参结肠靶向微丸包衣工艺研究及体外评价[J].中成药,2009,31(12):1841-1844.
[13]王玉蓉,邹海艳,周洪伟,等.复方小檗碱结肠定位片制备工艺和体内外释药评价研究[J].中医药信息,2010,27(4):71-74.
[14]李 静,毕殿洲.乙基纤维素水分散体与有机溶剂包衣方法的比较[J].中国药科大学学报,2002,33:290-294.
[15]王通艳,崔启华,曹青日,等.丹皮酚-β-环糊精包合物结肠定位释药片剂的制备[J].中国中药杂志,2011,36(21):2956-2959.
[16]徐本亮,王 冰,浦益琼,等.星点设计-效应面法优化丹皮酚片剂处方[J].中国实验方剂学杂志,2012,18(17):56-59.
Study on coating pH-tim e process for colonal delayed-release Paeonol Tablets
XU Ben-liang1, CAIYun-yun2#, ZHANG Qi1, PU Yi-qiong1, WANG Bing1*, ZHANG Tong1,TAO Jian-sheng1, WU Pei-ying3*
(1.Shanghai University of Traditional ChineseMedicine,Shanghai201203,China;2.Minhang Branch of Shanghai Tumor Hospital Affiliated to Fudan University,Shanghai 200240,China;3.Shanghai Xingling Science and Technology Pharmaceutical Co.,Ltd,Shanghai 201703,China)
AIMTo develop satisfactory Paeonol Tablets coatwith pH-time for its delayed release in the colon.METHODSTo find the optimal procedure through investigation on the co-relationship between coatingmaterials,the weight-gain of every coating layer,and the cumulative release rates in vitro.RESULTSWith the use of Methocel E6 LV(1.7%weightgain)as shielded layer,Surelease(3%weightgain)as colonaldelayed-release layer and Acryl-EZE(3.5%weightgain)as enterosoluble layer,the release rate of the tabletwas less than 10% in 0.1 mol/L HCl(within 2 h)and in PBS(pH 6.8)(within 3 h).However,more than 80%of release achieved in PBS(pH 7.8-8.0)(within 2 h).CONCLUSIONAn optimal pH-time(0.1 mol/L HCl)coating process for Paeonol Tablets delayed-release in colon can restrain the active ingredient from releasing effectively,while in an environmentof PBS(pH 6.8,within 3 h)and PBS(pH 7.8-8.0),most colonal release can be expected
paeonol;pH-time delayed;colon-targeting;coating procedure
R944
:A
:1001-1528(2015)07-1447-05
10.3969/j.issn.1001-1528.2015.07.012
2014-11-10
国家自然科学基金 (81303233),上海市教委知识服务平台项目,上海市教委预算内项目 (2014YSN28)
徐本亮 (1983—),男,助理研究员,从事中药口服靶向制剂研究。E-mail:xbl2004000@126.com #并列第一作者:蔡芸芸 (1984—),女,在职硕士,从事中西医结合临床。E-mail:14231230032@fudan.edu.cn
*通信作者:王 冰,女,副教授,从事中药纳米给药系统研究。E-mail:annabel_cn@163.com吴佩颖,男,教授,从事中药制药新技术研究及其产业化。E-mail:wupeiyingsh@163.com
