复元胶囊对骨关节炎软骨细胞凋亡中JNK/Bax信号通路的影响
2015-01-16周凌云张玉笛李荣亨
周凌云, 钟 玉, 张玉笛, 李荣亨
(重庆医科大学附属第一医院中西医结合科,重庆400016)
复元胶囊对骨关节炎软骨细胞凋亡中JNK/Bax信号通路的影响
周凌云, 钟 玉, 张玉笛, 李荣亨*
(重庆医科大学附属第一医院中西医结合科,重庆400016)
目的探讨复元胶囊对实验性骨关节炎软骨细胞凋亡影响的作用机制。方法体外培养人软骨肉瘤细胞(SW1353),给予白细胞介素-1β(interleukin-1 beta,IL-1β)刺激,复元胶囊含药血清和c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)的特异抑制剂SP600125干预,随机分为正常组、模型组、抑制剂组、复元胶囊组、复元胶囊+抑制剂组,流式细胞仪分别检测细胞周期百分率和细胞凋亡率,蛋白质印迹法 (Western blot)检测细胞信号因子磷酸化c-Jun氨基末端活化蛋白激酶(p-JNK)和Bax的蛋白表达。结果IL-1β诱导SW1353后,模型组G1期的百分比增加,S期及G2期的百分比减少,细胞凋亡率显著增高 (P<0.01);抑制剂组、复元胶囊组和复元胶囊+抑制剂组G1期的百分比减少,S期及G2期的百分比增加,细胞凋亡率显著降低,p-JNK和Bax表达明显减少 (P<0.05或P<0.01),其中以复元胶囊+抑制剂组的各项指标变化最显著 (与模型组比较,P<0.01)。结论复元胶囊可抑制骨关节炎软骨细胞中p-JNK及下游信号因子Bax的活化和表达,抑制细胞凋亡并促进增殖,可用于防治骨关节炎。
复元胶囊;骨关节炎;JNK;Bax;凋亡
关节软骨退行性病变是骨关节炎(Osteoarthritis,OA)发病的关键环节。研究表明[1],随着年龄增长,软骨细胞凋亡增加,其数量与骨关节炎呈正相关。复元胶囊是治疗骨关节炎的中药复方制剂,具有补益肝肾、益气活血之功效,但其作用机制尚不清楚。本实验采用流式细胞仪和蛋白质印迹法观察复元胶囊含药血清对IL-1β诱导的体外SW 1353细胞周期、细胞凋亡以及细胞信号因子p-JNK和Bax蛋白表达的影响,探讨其防治骨关节炎可能的作用机制。
1 实验材料
1.1 主要仪器 倒置相差显微镜(日本Olympus公司);CO2细胞培养箱(美国Thermo Scientific公司);超净工作台(日本Airtech公司);电子天平(瑞士Mettler Toledo公司);流式细胞仪(美国Bekman Coulter公司);常温高速离心机、冷冻高速离心机 (长沙湘仪离心机仪器有限公司);低温冰箱 (青岛海尔股份有限公司);电泳仪、凝胶成像仪(美国Bio-Rad公司)。
1.2 药物与试剂 复元胶囊为自制 (重庆希尔安药业有限责任公司,批号090312);重组人白介素-1β(美国PeproTech公司);JNK特异抑制剂SP600125(上海碧云天生物技术有限公司);一抗4668P Phospho-SAPK/JNK(Thr183/Tyr185)、2772s Bax Antibody(美国CST公司);二抗ABLP1001A HRP羊抗兔IgG(美国Abgent公司);内参Anti GAPDH pAb(南京钟鼎生物技术有限公司)。
1.3 动物与细胞 新西兰大白兔3只,体质量(1.9±0.1)kg,重庆医科大学实验动物中心提供,动物许可证号SYXK(渝)2012-0001;人软骨肉瘤细胞 (SW1353),购于中国科学院上海生命科学研究院细胞资源中心。
2 实验方法
2.1 细胞的培养与传代 在37℃下5%CO2培养箱中,用含10%胎牛血清(FBS)和1%青霉素-链霉素(PS)的高糖DMEM培养液培养SW1353,倒置显微镜观察细胞生长状态,当细胞长满80%后,开始传代培养。
2.2 含药血清的制备 新西兰大白兔3只,购自重庆医科大学实验动物中心,体质量 (1.9+0.1)kg,随机分为给药组和对照组。给药组2只,体质量分别为1.8和1.9 kg;对照组1只,体质量2.0 kg。给药组按Meeh-Rubner公式灌胃给予等效剂量10倍量的药物 (之前充分溶于生理盐水);对照组灌胃给予等剂量的生理盐水,每日2次,连续5 d。末次灌胃2 h后,兔颈总动脉插管取血,4℃下过夜,3 000 r/min离心15 min,取上清液,0.22μm滤器除菌,分装备用,-20℃下贮藏。
2.3 实验分组 将细胞以1.5×106个/mL的密度接种于6 cm培养皿中,培养24 h,细胞贴壁后用复元胶囊最佳含药血清浓度 (15%)[2]和SP600125干预细胞进行分组实验,待稳定1 h后,再加入IL-1β(10 ng/mL)刺激细胞。然后,分为正常组(15%空白血清+DMEM培养基)、模型组 (10 ng/m L IL-1β+15%空白血清+DMEM培养基)、抑制剂组(10 ng/mL IL-1β+SP600125+15%空白血清+DMEM培养基)、复元胶囊组(10 ng/mL IL-1β+15%含药血清+DMEM培养基)、复元胶囊+抑制剂组(10 ng/m L IL-1β+SP600125+15%含药血清+DMEM培养基)。在37℃下5%CO2培养箱中培养48 h后,收集细胞。
2.4 流式细胞仪测细胞周期 按一定细胞数接种细胞后,无血清DMEM培养基培养24 h,用于同步化细胞周期。按实验分组加药处理方法培养48 h后收集细胞,300μL PBS加以重悬,逐滴加入预冷的无水乙醇700μL,标记后将标本送往重庆医科大学生命科学研究院流式细胞室检测,实验重复3次。
2.5 流式细胞仪测细胞凋亡 按一定细胞数接种细胞24 h后,按实验分组加药处理方法培养48 h,收集上清液后标记,中和胰酶消化,离心5 min(1 000 r/min),弃上清液,1 mL PBS重悬细胞,再移至5个EP管中,标记后将标本送往重庆医科大学生命科学研究院流式细胞室检测,实验重复3次。
2.6 蛋白印迹法检测细胞信号因子p-JNK和Bax的蛋白表达 细胞培养及分组处理方法同前。继续培养48 h后,分组提取总蛋白,考马斯亮蓝法测定蛋白浓度。40μg蛋白/泳道上样,SDS-PAGE电泳分离条带,常规转膜,封闭,TBS-T洗膜,再加入1∶1 000稀释的一抗,4℃下反应过夜,洗膜,二抗室温下孵育1~2 h,洗膜,然后加入ECL化学发光试剂,在BIO-RAD凝胶成像仪下曝光显影,凝胶图像处理系统分析每个条带的灰度值,计算p-JNK/GAPDH、Bax/GAPDH值,重复3次。
3 统计学处理
采用SPSS 19.0统计软件分析,数据用均数±标准差 (x±s)表示,组间比较采用单因素方差分析(One-Way ANOVA),P<0.05为有统计学意义。
4 结果
4.1 复元胶囊对IL-1β诱导的SW1353细胞周期的影响 与正常组比较,模型组G0/G1期的百分比增加,S期及G2/M期的百分比减少,细胞增殖指数 (PI)减少,差异具有统计学意义 (P<0.01);与模型组比较,抑制剂组、复元胶囊组及复元胶囊+抑制剂组的G0/G1期的百分比减少,S期及G2/M期的百分比增加,PI增加,差异有统计学意义 (P<0.01或P<0.05),其中复元胶囊组与复元胶囊+抑制剂组作用更为明显 (P<0.01),且后者的PI大于前者 (P<0.01),见表1。

表1 复元胶囊对IL-1β诱导的SW 1353细胞周期的影响(x±s)Tab.1 Effects of Fuyuan Capsules on the cell cycle in JL-1 beta induced SW 1353(x±s)
4.2 复元胶囊对IL-1β诱导的SW1353细胞凋亡的影响 与正常组比较,IL-1β诱导模型组的细胞凋亡率显著增高 (P<0.01);含药血清及抑制剂干预后,与模型组比较,抑制剂组、复元胶囊组、复元胶囊+抑制剂组的细胞凋亡率均显著降低,差异有统计学意义 (P<0.01)。其中,复元胶囊组细胞凋亡率低于抑制剂组,而复元胶囊+抑制剂组细胞凋亡率低于复元胶囊组,差异有统计学意义(P<0.01),见表2。
4.3 复元胶囊对IL-1β诱导的SW1353细胞信号因子p-JNK和Bax蛋白表达的影响 与正常组比较,模型组的p-JNK和Bax蛋白表达均明显增加(P<0.01);与模型组比较,干预组的p-JNK和Bax蛋白表达均明显减少 (P<0.01);复元胶囊组与抑制剂组比较,p-JNK的表达显著增加(P<0.01),Bax的表达显著减少 (P<0.01);复元胶囊+抑制剂组与抑制剂组比较,p-JNK的表达无明显差异(P>0.05),而Bax的表达明显减少(P<0.01);复元胶囊+抑制剂组与复元胶囊组比较,p-JNK和Bax的表达均显著减少(P<0.01),见图1和表3。

表2 复元胶囊对IL-1β诱导的SW 1353细胞凋亡的影响(x±s)Tab.2 Effects of Fuyuan Capsules on the apoptosis rate in IL-1 beta induced SW 1353

图1 磷酸化JNK蛋白与Bax蛋白的W estern Blot检测结果Fig.1 Results of p-JNK and Bax datected by W estern blot
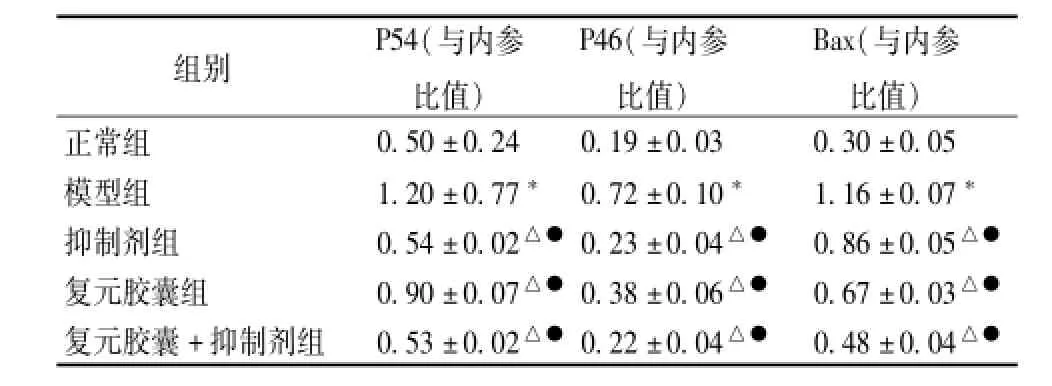
表3 复元胶囊对IL-1β诱导的SW 1353细胞信号因子p-JNK和Bax蛋白表达的影响 (x±s)Tab.3 E ffects of Fuyuan Capsules on the expression of p-JNK and Bax in IL-1 beta induced SW 1353(x± s)
5 讨论
骨关节炎(Osteoarthritis)的病理基础是关节软骨退变,而软骨细胞是关节软骨中唯一的细胞[3],在软骨形成、代谢以及修复中起着极其重要的作用。凋亡细胞如果不能有效地从软骨中被清除,其产物便可引起病理性的软骨降解,因此以抗凋亡为靶点的干预正逐渐成为治疗骨关节炎的重要方法。骨关节炎在祖国医学中属于 “骨痹”的范畴,气虚血瘀、肝血不足、肾元亏虚是导致发病的根本内因。本实验所用的复元胶囊中含有黄芪、生晒参、丹参、川芎等药用于益气活血化瘀,配以淫羊藿、鹿茸、续断、枸杞子等药用于补益肝肾。前期研究已证实,复元胶囊可通过调节软骨中P38[4]、ERK1/2[5]通路,抑制下游相关凋亡基因如P53、Caspase-3等表达或活化,减少细胞凋亡,降低骨关节炎软骨的退变。
复元胶囊为口服给药,其有效物质需以血液为介质,输送到靶点来产生作用,因而给药后的血清才是真正起作用的 “制剂”,并且血清中含有的成分才是药物在体内起直接作用的物质[6]。故本实验根据血清药理学方法,选用复元胶囊制成含药血清,干预体外培养的SW1353。由于原代软骨细胞培养难度大,易去分化,且涉及伦理学问题,而SW1353与正常人软骨细胞相似,具有良好的软骨细胞表型和功能,体外长期培养表型稳定,故采用SW 1353代替人软骨细胞进行研究[7]。
IL-1β是一种促炎细胞因子,在骨关节炎的病理过程中起着重要作用,故本实验选用IL-1β刺激体外培养细胞来模拟骨关节炎的微环境。JNK家族是一类丝氨酸/苏氨酸蛋白激酶,与P38和ERK同是哺乳动物体内丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)超家族的一员[8]。JNK信号通路能被生长因子、细胞因子 (TNF-α、IL-1)等激活[9]而形成p-JNK,直接调节胞质内靶蛋白的活性(如Bax、Bim等)而介导线粒体途径的细胞凋亡[10]。故本实验从复元胶囊对细胞周期、细胞凋亡及JNK信号通路的角度进一步探讨其防治骨关节炎可能的作用机制。
细胞的周期分布能够反映细胞增殖的具体过程,PI与S期百分比是反映细胞增殖的重要指标[11]。本实验结果显示,用IL-1β刺激SW1353后,细胞增殖情况减弱,用含药血清及抑制剂干预后,PI增加,其中以复元胶囊组及复元胶囊+抑制剂组作用最为明显。由此可知,复元胶囊能调节细胞周期分布,促进细胞增殖。
在骨关节炎病变过程中,软骨细胞凋亡率显著上升[12]。本实验发现,JNK信号通路被IL-1β激活时,其下游基因Bax表达同步增加,而应用复元胶囊含药血清后,p-JNK蛋白表达显著降低,Bax表达和细胞凋亡率也均明显下降,提示复元胶囊能抑制IL-1β诱导的SW1353中p-JNK和Bax的活化和表达,进而抑制IL-1β诱导的细胞凋亡。然而,当用SP600125阻断JNK信号通路后,复元胶囊+抑制剂组与抑制剂组比较,p-JNK表达无明显变化,而Bax表达仍然减少,细胞凋亡率显著降低,推测复元胶囊还可能通过其它信号通路 (如Wnt、NF-κB等)来抑制IL-1β诱导的细胞凋亡,发挥自身独特的多靶点效应。关于复元胶囊是否通过这几条通路共同作用或相互作用,则尚需作进一步研究。
另外实验还表明,复元胶囊抑制IL-1β诱导的细胞凋亡可能是通过抑制p-JNK的活化和表达,进而抑制其信号通路下游凋亡基因Bax的表达,由此减少细胞凋亡,同时促进其增殖,这可能也是复元胶囊防治骨关节炎的作用机制之一。
[1]Hashimoto S,Ochs R L,Rosen F,et al.Chondrocyte-derivedapoptotic bodies and calcification of articular cartilage[J].Proc Natl Acad Sci U SA,1998,95(6):3094-3099.
[2]王泽明.复元胶囊通过MAPKs通路调节OPG-RANKLRANK系统防治骨关节炎的实验研究[D].重庆:重庆医科大学,2014.
[3]Archer CW,Francis-West P.The chondrocyte[J].Int JBiochem Cell Biol,2003,35(4):401-404.
[4]周小莉,李荣亨.复元胶囊对软骨细胞凋亡P38丝裂原活化蛋白激酶信号传导通路的影响[J].第四军医大学学报,2008,29(12):1092-1095.
[5]周小莉,李荣亨.复元胶囊对软骨细胞凋亡细胞外信号调节蛋白激酶1/2信号通路的作用研究[J].中国老年学杂志,2008,28(4):329-331.
[6]房 方,李 祥,陈建伟.中药血清药物化学的研究进展[J].亚太传统医药,2009,5(1):143-145.
[7]Jia P,Chen G,Zhou G,etal.Fuyuan Decoction inhibits nitric oxide production via inactivation ofnuclear factor-κB in SW1353 chondrosarcoma cells[J].J Fthnopharmacol,2013,146(3):853-858.
[8]Hibi M,Lin A,Smeal T,et al.Identification of an oncoprotein-and UV-responsive protein kinase that binds and potentiates the c-Jun activation domain[J].Genes Dev,1993,7(11):2135-2148.
[9]Lu Y,Jiang B C,Cao D L,et al.TRAF6 upregulation in spinal astrocytesmaintains neuropathic pain by integrating TNF-α and IL-1βsignaling[J].Pain,2014,155(12):2618-2629.
[10]Zhang Y,Li H Y,Zhang Z H,et al.Garlic-derived compound S-allylmercaptocysteine inhibits cell growth and induces apoptosis via the JNK and p38 pathways in human colorectal carcinoma cells[J].Oncol Lett,2014,8(6):2591-2596.
[11]陈鸿雁,王 驰,舒 艳,等.苦参碱与3种抗肿瘤药物联合作用对KBV200耐药细胞株细胞周期的影响[J].中国药房,2006,17(7):500-501.
[12]Kim H T,Lo M Y,Pillarisetty R.Chondrocyte apoptosis following intraarticular fracture in humans[J].OsteoarthritisCartilage,2002,10(9):747-749.
Effects of Fuyuan Capsules on the apoptosis of experimental osteoarthritis chondrocyte in JNK/Bax signaling pathway
ZHOU Ling-yun, ZHONG Yu, ZHANG Yu-di, LIRong-heng*
(Department of Integration of Traditional Chinese and Western Medicine,The First Affiliated Hospital of Chongqing Medical University,Chongqing 400016,China)
ABSTRACT:AIMTo investigate themechanism of Fuyuan Capsules on the inhibition apoptosis of experimental osteoarthritis chondrocytes.METHODSHuman chondrosarcoma cellswere cultured and divided into five groups randomly:normal group,model group,inhibitor group,Fuyuan Capsules group,Fuyuan Capsules+inhibitor group.The percentage of cell cycle and apoptosis index were detected by Flow cytometry.The expression of cell signaling factor of p-JNK and Bax were determined by Western blot.RESULTSFuyuan Capsules serum could decrease the percentage of G0/G1phase,but increase the percentage of S phase and G2/M phase in human SW 1353 chondrosarcoma cells IL-1 beta-induced(P<0.01).The apoptotic index decreased significantly(P<0.01).The levels of p-JNK and Bax were abated significantly(P<0.01).CONCLUSIONFuyuan Capsules can decrease the apoptosis index and promote the proliferation associated with p-JNK and Bax in osteoarthritis chondrocyte.Thismay be one of themechanisms about prevention of Fuyuan Capsules in osteoarthritis.
Fuyuan Capsules;osteoarthritis;JNK;Bax;apoptosis
R285.5
:A
:1001-1528(2015)07-1422-05
10.3969/j.issn.1001-1528.2015.07.007
2014-12-12
重庆市卫生局资助项目 (2008-2-35)
周凌云 (1988—),女,硕士,研究方向为风湿病和老年病学。Tel:15922761851,E-mail:421615271@qq.com
*通信作者:李荣亨 (1945—),男,教授,博士生导师,研究方向为中西医结合防治风湿病和老年病。Tel:13320337836,E-mail:Lrongheng1231@163.com
