新辅助化疗联合高强度聚焦超声用于治疗乳腺癌的疗效评价
2015-01-16江苏省阜宁县人民医院224400
周 玲 江苏省阜宁县人民医院 224400
新辅助化疗联合高强度聚焦超声用于治疗乳腺癌的疗效评价
周 玲 江苏省阜宁县人民医院 224400
目的:探讨新辅助化疗联合高强度聚焦超声治疗乳腺癌的临床疗效。方法:将80例乳腺癌患者随机分为观察组和对照组各40例,对照组患者实施新辅助化疗,观察组在对照组治疗基础上,实施高强度聚焦超声治疗,比较两组患者的治疗效果。结果:观察组治疗后的肿瘤面积、肿瘤体积均明显小于对照组,TNM分期Ⅲ期降为Ⅱ期、Ⅱ期降为Ⅰ期者所占比例均显著高于对照组(P<0.05)。结论:新辅助化疗联合高强度聚焦超声治疗乳腺癌可缩小肿瘤体积,减小肿瘤病灶面积,降低肿瘤临床分期,临床疗效确切。
新辅助化疗 高强度聚焦超声 乳腺癌
近年来,新辅助化疗(即术前化疗)在乳腺癌外科治疗中的应用越来越广泛。高强度聚焦超声(HIFU)技术是一种新型的非侵入性肿瘤治疗技术,大量的临床应用实践显示,其在多种恶性肿瘤的临床治疗中都具有显著效果[1]。我院在乳腺癌临床治疗中,联合应用了新辅助化疗和HIFU,并取得了较好的效果,现报道如下。
1 资料与方法
1.1 一般资料 选取我院在2013年3月-2014年3月收治的80例乳腺癌患者作为观察对象,均为女性,所有患者均经病理检查明确诊断为原发性乳腺癌,且愿参与本次观察并签署了知情同意书。使用随机数字表法将80例患者分为观察组和对照组各40例。观察组患者年龄30~69岁,平均年龄(45.6±6.7)岁;肿瘤部位:乳晕区5例,内上象限6例,外上象限29例;肿瘤直径2.2~6.4cm,平均肿瘤直径(3.82± 1.01)cm。对照组患者年龄33~67岁,平均年龄(46.7± 7.0)岁;肿瘤部位:乳晕区6例,内上象限7例,外上象限27例;肿瘤直径2.6~5.9cm,平均肿瘤直径(3.77±1.24)cm。两组患者的一般资料比较,差异无统计学意义(P>0.05),具有可比性。
1.2 方法 对照组患者在术前实施新辅助化疗,观察组在对照组治疗基础上,实施HIFU治疗。
1.2.1 新辅助化疗:化疗方案选用CEF方案、CMF方案或者TE方案。CEF方案:环磷酰胺剂量600mgm2、5-FU剂量500mgm2、表阿霉素剂量60mgm2;CMF方案:环磷酰胺剂量500mgm2、5-FU剂量500mgm2、甲氨蝶呤剂量30mgm2;TE方案:表阿霉素剂量60mgm2、艾素120mgm2。三种化疗方案均以21d为1个疗程,术前共化疗3个周期。
1.2.2 HIFU治疗:仪器选用上海爱申公司生产的NIT 9 000高强度聚焦超声肿瘤消融机。仪器参数:声强0~2 000Wcm2,频率1.0MHz,焦域3cm×3cm×8cm,焦距16.5cm,发射间隔时间0.3s,发射时间0.15s,换能器功率60%。患者取仰卧位,使用超声外探头扫查定位,并在体表做好标记。在治疗部位涂抹耦合剂,使用激光灯,配合治疗床移动进行定位,使用内探头进行精确定位,然后开始治疗。治疗范围要覆盖整个肿瘤组织,在进行HIFU治疗时,静脉滴注化疗药物。
1.3 观察指标 两组患者治疗前、后均进行肝肾功能、血常规检查。治疗期间,密切观察两组患者的化疗药物毒副反应及肿瘤大小变化。
1.4 统计学方法 本文数据应用统计学软件SPSS19.0进行处理,计数、计量资料比较分别进行χ2检验和t检验,P<0.05为差异有统计学意义。
2 结果
2.1 肿瘤大小 两组患者治疗前的肿瘤面积、肿瘤体积比较差异均无统计学意义(P>0.05);治疗后,两组患者的肿瘤面积及体积值均较治疗前显著降低,观察组治疗后的肿瘤面积、肿瘤体积均明显小于对照组,P<0.05,差异均具有统计学意义。见表1。
表1 两组患者治疗前后的肿瘤大小比较(±s)

表1 两组患者治疗前后的肿瘤大小比较(±s)
)肿瘤体积(cm3组别n肿瘤面积(cm2)治疗后观察组40 10.52±3.81 2.03±1.52 25.69±2.74治疗前治疗后治疗前3.39±2.76对照组40 10.68±4.01 3.77±2.41 24.97±2.30 5.48±4.68 t 0.194 3.862 1.273 2.433 P>0.05<0.05>0.05<0.05
2.2 临床分期 治疗后,观察组有10例(25.00%)TNM分期Ⅲ期者降为Ⅱ期,13例(32.50%)Ⅱ期降为Ⅰ期;对照组治疗后2例(5.00%)Ⅲ期降至Ⅱ期,7例(17.50%)Ⅱ期降至Ⅰ期。组间比较差异有统计学意义(P<0.05,χ2=12.686、6.000)。
2.3 不良反应 两组患者的骨髓抑制、肝肾功能损害、脱发、恶心呕吐发生率比较,差异均无统计学意义(P>0.05)。见表2。
3 讨论
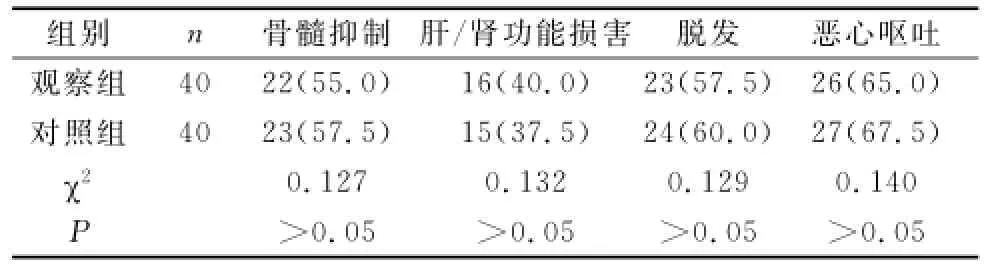
表2 两组患者的不良反应比较〔n(%)〕
HIUF作为一种无创外科技术,其主要通过聚焦超声波,使之瞬间升温,通过高温效应使靶区内组织迅速变性、坏死,以达到杀灭肿瘤细胞的目的[2]。此外,HIUF的各种非热效应机制,如声化学效应、机械效应、空化效应等也能有效杀伤癌细胞。乳腺癌患者的肿瘤位置普遍表浅,故难以体现HIUF超声波的穿透性优势,同时该项技术仅能对原发肿瘤产生作用,并无法替代腋窝淋巴结清扫术,所以临床上目前尚未广泛开展该项技术[3]。
据相关研究显示[4,5],对恶性肿瘤进行长时间的低声强超声波辐射,会产生温热效应,此时靶区组织温度尚未达到致死温度,故靶区内组织不会明显坏死,但其细胞膜通透性会明显改变。在此情况下,配合化疗,有助于药物的充分渗透与吸收,同时靶区温度偏高也会加快药物吸收速度和反应速度,提高化疗效果[6]。本文结果显示,观察组化疗后的肿瘤体积、面积均显著小于对照组,TNF分期改善程度也显著优于对照组(P<0.05);并且两组患者的不良反应发生率比较,差异无统计学意义(P>0.05)。这说明新辅助化疗联合高强度聚焦超声治疗乳腺癌可缩小肿瘤体积,减小肿瘤病灶面积,降低肿瘤临床分期,提高临床疗效,同时不会增加不良反应,是一种安全、有效的乳腺癌治疗方法,值得推广应用。
[1]徐玲,刘荫华,叶京明,等.乳腺癌组织Ki67表达与蒽环类联合紫杉类新辅助化疗效果的相关性〔J〕.中华外科杂志,2010,48(6):450-453.
[2]吴家豪,何劲松,倪勇,等.乳腺癌新辅助化疗疗效评价方法进展〔J〕.癌症,2010,29(2):240-244.
[3]胡芸,金朝林,王翔,等.乳腺癌的磁共振强化方式与新辅助化疗后退缩模式间的相关性及其临床意义〔J〕.中国肿瘤临床,2014,41(22):1446-1449.
[4]丁炎,夏纪筑,贺雪梅,等.高强度聚焦超声对兔VX2乳腺癌杀伤效应的实验研究〔J〕.中国超声医学杂志,2010,26(5):388-391.
[5]牛陵川,邹文兵,张炼,等.乳腺癌高强度聚焦超声消融后残留肿瘤增殖能力的变化〔J〕.上海交通大学学报:医学版,2010,30(2):200-203,207.
[6]卫刚,戚晓东,马静,等.乳腺癌高强度聚焦超声治疗后病理形态学观察〔J〕.诊断病理学杂志,2014,21(5):290-292.
(编辑羽飞)
R737.9
B
1001-7585(2015)19-2662-02
2015-01-06
