关于凝固点降低测定物质摩尔质量实验的误差分析与改进
2015-01-15聂仁峰曹红燕
文/聂仁峰 曹红燕
凝固点降低法测定摩尔质量是物理化学中的经典实验[1]。该方法是不仅操作简便、结果较为准确,而且对学生理解热力学基本原理具有重要意义。通过较长时间的观察和实验,发现在实践教学中该实验始终存在不少问题,作者对此进行了探讨和改进。
1. 凝固点降低法测定溶质摩尔质量实验的基本原理
凝固点降低是理想稀溶液的依数性质之一。当稀溶液凝固析出纯固体溶剂时,则溶液的凝固点低于纯溶剂的凝固点,其降低值与溶液组成之间的关系为:ΔTf=Tf* -Tf=KfmB,式中,ΔTf 为凝固点降低值,Tf* 为溶剂的凝固点,Tf 为溶液的凝固点,Kf 为凝固点降低常数,mB 为溶质的质量摩尔浓度[2]。
若称取一定量的溶质m (B)和溶剂m (A),配成稀溶液,则此溶液的质量摩尔浓度为:mB = m (B)/ (m (A)MB),式中,MB 为溶质的分子量。将一定量的溶剂A 和溶质B 组成理想稀溶液,分别测定纯溶剂和溶液的凝固点,求得ΔTf,再查得溶剂的凝固点降低常数,代入上述公式,即可计算溶质的相对摩尔质量。
2. 实验中存在的问题
作者认为有以下几点问题会困扰实验的进行:
(1)该实验对操作技术要求较高,学生初次实验往往不易掌握。比如:(a)学生常常为了达到较好的搅拌效果,把转速调至最高,结果导致磁子在内管中抖动,未能充分搅拌液体。(b)在用贝克曼温度计检测液体温度时,常常忽视热电偶触碰到磁子,导致磁子旋转受干扰,无法搅拌液体。(c)寒剂温度调整不到位,过冷程度难以控制。
(2)对于纯溶剂而言,凝固点在一定时间内固定不变。但对于溶液,样品首先在样品界面的管壁上结晶,溶液析出品体后使平衡浓度比原溶液浓度高。因此,凝固点不一定是一个恒定值,往往算出的摩尔质量比理论值偏低[3]。
(3)实验中使用的苯-萘或环己烷-萘不仅会给环境造成严重的污染和给师生健康造成危害,而且受环境影响较大,误差明显[4]。比如:(a)气温太高时,环己烷、苯等溶剂容易挥发,导致测量值偏小。(b)湿度太大时,纯环己烷会吸收水蒸气,可能干扰实验[5]。
3. 实验的改进及解决方法
为了解决上述问题,作者认为可以对实验作如下改进:
(1)将搅拌速率控制在恒定的值,无需太大,避免磁子抖动而起不到充分搅拌的效果;调整热电偶的高度,使之高于磁子半厘米,让磁子自由搅动。
(2)以环己烷-萘体系为例,为了控制好冰浴的温度,可以预先将冰浴温度调节至2. 5 ~3. 0oC。为防止测定仪内冰浴温度波动,可事先配置好0oC 冰水浴,取其中的冷水缓慢滴加,并不断搅拌,保持测定仪内冰浴温度的恒定。

图1 实验装置的改进
(3)以环己烷-萘体系为例,可以在塞子上设计一个药匙(图1),在里边装入已准确称量的萘,然后塞到装有环己烷的内管上,先对纯溶剂进行测量;结束后,可将药匙下推至溶剂中,搅拌即可形成溶液。避免原始方法中加萘导致的溶剂挥发或滴漏,造成溶液浓度发生变化。还可以避免加萘时,萘附着到内管壁上,造成溶液浓度的误差。
(4)对于溶液,以前通常把回升到最高点的温度作为凝固点,由于这时已有溶剂晶体析出,所以溶液浓度已不是起始浓度,该凝固点也已不是原浓度的凝固点。由图2 (右)可以看出,这时的凝固点比实际凝固点要低,以此数值计算出的ΔTf 要大于真值,最后计算出的摩尔质量要小于真值。建议测出步冷曲线,按图2 (右)所示方法外推至Tf 校正[6]。
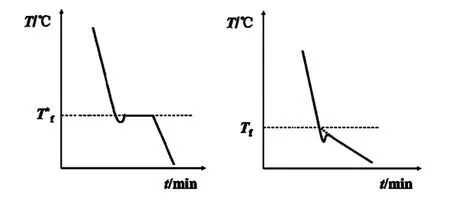
图2 冷却曲线(左)纯溶剂,(右)溶液
(5)考虑到苯-萘或环己烷-萘给环境和师生健康造成危害,可以水作为溶剂,尿素、葡萄糖作为溶质,并调整实验条件,使该实验符合绿色环保的要求。
4. 结论
凝固点下降法测定摩尔质量的影响因素依次为搅拌速率、寒剂温度和溶剂的挥发等,只要适当的控制这些因素就可以得到满意的测量结果。另外,发展以水作为溶剂,尿素、葡萄糖作为溶质的测量体系,可使该实验成为绿色、环保的物理化学实验。
[1]复旦大学. 物理化学实验. 第3 版. 北京:高等教育出版社,2004.
[2] 董超,李建平,物理化学实验. 北京:化学工业出版社,2010
[3]张连庆,麻英. 步冷曲线法——对凝固点降低测定摩尔质量的改进,大学化学,2006,21 (2):54.
[4]朱思俐,何佑秋,古启蓉等. 凝固点降低法测定摩尔质量实验的改进. 大学化学,2006,21 (1):49.
