响应面法优化高雄山虫草菌丝体中腺苷的超声提取工艺
2015-01-13石贝杰张慧敏
葛 飞, 石贝杰, 龚 倩, 张慧敏, 桂 琳
(1.安徽工程大学生物与化学工程学院,安徽 芜湖241000;2.皖南医学院微生物与免疫学教研室,安徽芜湖241000)
响应面法优化高雄山虫草菌丝体中腺苷的超声提取工艺
葛 飞, 石贝杰1, 龚 倩1, 张慧敏1, 桂 琳2*
(1.安徽工程大学生物与化学工程学院,安徽 芜湖241000;2.皖南医学院微生物与免疫学教研室,安徽芜湖241000)
目的利用响应面分析法优化高雄山虫草菌丝体中腺苷的超声提取工艺。方法在单因素试验基础上,选取超声功率、提取时间、提取温度和65%乙醇用量 (料液比)为影响因素,以菌丝体中腺苷提取率为响应值进行响应面分析。结果高雄山虫草菌丝体中腺苷的最佳超声提取条件为:超声功率433W,提取时间31 min,提取温度41℃,65%乙醇用量34 mL即料液比1∶34 g/mL。在此条件下,高雄山虫草菌丝体中腺苷提取率可达1.608 5 mg/g。结论
高雄山虫草;腺苷;超声提取;响应面分析法
细脚拟青霉Paecilomyces tenuipes(Peck)Samson是高雄山虫草Cordyceps takaomontana Yakushiji et Kumazaw的无性型[1],是一种分布广泛的、重要的昆虫病原真菌[2]。腺苷是细脚拟青霉发酵菌丝体的主要有效成分之一[3]。相关研究表明,细脚拟青霉代谢产物具有多种药理活性和生物学功能,被认为是天然虫草的有效替代品之一[4-8]。
查阅相关文献资料发现,国内外学者对细脚拟青霉及其代谢产物的药理作用、发酵条件、有效成分含量分析等方面开展了广泛的研究。李宝剑等从细胞水平初步探讨了细脚拟青霉多糖对乙型肝炎病毒的抑制作用及其机制[9]。葛飞等研究了中药大黄对细脚拟青霉液态发酵菌体生长及产胞内腺苷的影响[10]。刘慧娟等对细脚拟青霉液体栽培及氨基酸成分分析进行了研究[11]。陈安徽等以冬虫夏草生药为对照品对细脚拟青霉发酵菌丝体中核苷类化学成分进行了分析;同时,利用DPPH法对其发酵液和菌丝体的自由基清除活性进行了研究[12-13]。但有关高雄山虫草液态发酵菌丝体中腺苷的提取工艺研究未见相关文献报道。超声波提取是利用超声波具有的机械效应、空化效应及热效应,通过增大介质分子的运动速度,增大介质的穿透力以提取天然产物有效成分的方法,具有设备简单,操作方便,提取时间短,提取率高,成本低廉等优点,受到越来越多的重视[14-16]。本研究利用响应面法对高雄山虫草无性型——细脚拟青霉液态发酵菌丝体中腺苷的超声提取工艺进行了优化,为该菌株的进一步开发利用提供了实验数据和科学依据。
1 材料与方法
1.1 材料与试剂 高雄山虫草菌丝体由其无性型菌株细脚拟青霉进行液态发酵获取,细脚拟青霉菌株由安徽农业大学樊美珍教授馈赠,安徽工程大学微生物发酵安徽省工程技术研究中心保藏。甲醇为色谱纯,磷酸盐为国产分析纯。腺苷对照品购自美国Sigma公司。
1.2 仪器与设备 BIOTECH-10JSA 3L-10L发酵罐(上海保兴生物设备工程有限公司);Waters1525高效液相色谱仪(美国Waters公司);QHZ-123B组合式全温度振荡培养箱(江苏省太仓市华美生化仪器厂);HN-30AL型超声波清洗仪(上海汗诺仪器有限公司);FreeZone12冷冻干燥系统(美国LABCONCO公司);L550型台式离心机(湖南湘仪实验室仪器开发有限公司);WK-600A高速粉碎机 (青州市精诚医药装备制造有限公司);AL204型分析天平 (梅特勒-托利多 (上海)仪器有限公司)。
1.3 方法
1.3.1 菌丝体预处理 将液体深层发酵获得的高雄山虫草菌丝体经真空冷冻干燥后,粉碎,过60目筛,封口袋保存备用。
1.3.2 对照品溶液的制备 准确称取腺苷0.010 0 g置于10mL量瓶,用65%乙醇溶液溶解定容,分别配置成质量浓度为0.100 0、0.200 0、0.400 0、0.600 0、0.800 0、1.000 mg/ML腺苷溶液,作为对照品溶液。
1.3.3 菌丝体中腺苷的超声提取方法 准确称取1.000 0 g经预处理后的菌丝体,在40 kHz的超声频率下按试验设定条件提取胞内腺苷,提取液过滤后,滤液用65%乙醇定容,再经0.45μm微孔滤膜过滤后,所得滤液即为菌丝体中腺苷粗提液,稀释后进行HPLC分析。
1.3.4 腺苷的测定方法 根据 《中国药典》2010年版中介绍的方法,利用HPLC法测定高雄山虫草菌丝体中腺苷的含有量[17]。流动相为pH6.5的磷酸盐缓冲液-甲醇 (体积比85∶15);色谱柱为C18,体积流量1mL/min,检测波长260 nm,柱温35℃,进样量20μL。
1.3.5 菌丝体中腺苷提取率的计算 腺苷提取率=腺苷质量(mg)/菌丝体质量 (g)
1.3.6 单因素提取试验设计 分别以不同的超声功率、提取时间、提取温度和65%乙醇用量 (即料液比)作为单因素试验影响因子,考察各单因素对高雄山虫草菌丝体中腺苷提取率的影响。
1.3.7 Box-Behnken试验因素水平设计 在单因素试验结果的基础上,采用BBD-RSM法设计优化高雄山虫草菌丝体中腺苷的超声提取工艺参数。设计因素水平见表1。
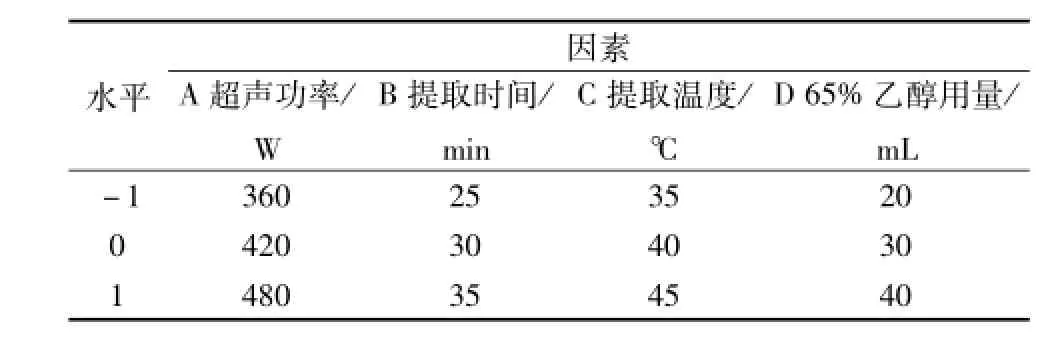
表1 试验因素水平
2 结果与分析
2.1 单因素试验结果
2.1.1 超声功率对高雄山虫草菌丝体中腺苷提取率的影响
选择提取时间为25 min,提取温度45℃,料液比为1∶30(高雄山虫草菌丝体:65%乙醇溶液,g/mL),分别用180、240、300、360、420、480和540 W的超声功率提取高雄山虫草菌丝体中腺苷,考察超声功率对胞内腺苷提取率的影响,结果如图1所示。
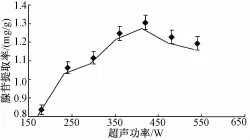
图1 超声功率对高雄山虫草菌丝体中腺苷提取率的影响
由图1可见,当超声功率在180~420W的区间范围内时,腺苷提取率随超声功率的增大而增加。但超声功率超过420W时,提取率反而下降,可能是由于超声波的强烈空化效应使腺苷结构破坏,导致提取率降低。因此,超声功率为420 W时,较有利于高雄山虫草菌丝体中腺苷的提取。
2.1.2 提取时间对高雄山虫草菌丝体中腺苷提取率的影响
选择超声功率为420W,提取温度45℃,料液比为1∶30(高雄山虫草菌丝体:65%乙醇溶液,g/mL),分别提取10、15、20、25、30、35和40 min,考察提取时间对胞内腺苷提取率的影响,结果如图2所示。
从图2可以看出,提取时间对菌丝体腺苷提取效果有较大影响。提取时间在10~30 min范围内,随提取时间的延长,腺苷提取率增加明显;但30 min后,随提取时间的延长,腺苷提取率反而略有下降。因此,确定较佳提取时间为30 Min。
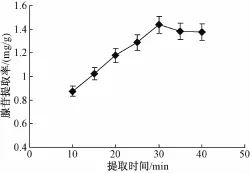
图2 提取时间对高雄山虫草菌丝体中腺苷提取率的影响
2.1.3 提取温度对高雄山虫草菌丝体中腺苷提取率的影响
选择超声功率为420W,提取时间30min,料液比为1∶30(高雄山虫草菌丝体:65%乙醇溶液,g/mL),分别在25、30、35、40、45和50℃条件下,进行胞内腺苷的提取,考察提取温度对胞内腺苷提取效果的影响,结果如图3所示。
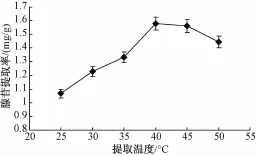
图3 提取温度对高雄山虫草菌丝体中腺苷提取率的影响
由图3可见,在25~40℃范围内时,随温度升高高雄山虫草菌丝体中腺苷提取率逐步提高,当温度高于40℃时,提取率反而减小。因此,确定较佳提取温度为40℃。2.1.4 料液比对高雄山虫草菌丝体中腺苷提取率的影响选择超声功率为420W,提取时间30 min,提取温度40℃,分别在料液比 (高雄山虫草菌丝体:65%乙醇溶液,g/mL)为1∶10、1∶20、1∶30、1∶40和1∶50条件下,进行胞内腺苷的提取,考察料液比对胞内腺苷提取率的影响,结果如图4所示。
由图4可知,在料液比小于1∶30时,随料液比的增加,腺苷提取率增加明显;在料液比大于1∶30时,腺苷提取率反而下降。因此,料液比以1∶30较为适宜。
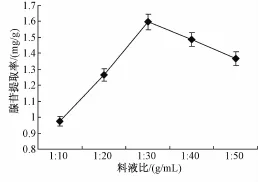
图4 料液比对高雄山虫草菌丝体中腺苷提取率的影响
2.2 Box-Behnken试验设计及分析 以腺苷提取率(mg/g)为响应值,用Design-Expert 8.0.6.1软件对获得的实验结果进行统计分析,可得如下二次回归方程:Y= 1.59+0.069A+0.044B+0.036C+0.085D+0.041AB-0.040AC-0.00525AD+0.018BC+0.0035BD-0.024CD-0.16A2-0.14B2-0.15C2-0.10D2,结果见表2。对二次回归方程进行方差分析,结果见表3。
由表3可知,回归模型达到极显著水平P<0.000 1,而误差项不显著,说明回归方程与实际情况吻合得较好,试验误差小。因此可用该回归方程代替试验真实点对试验结果进行分析。回归模型各项的方差分析还表明,A、B、C、D、A2、B2、C2、D2的置信度均在95%水平以上,说明这些因素在本试验设计中均为显著项,即超声功率(A)、提取时间 (B)、提取温度 (C)和65%乙醇用量(D)均对实验结果具有较大影响。从各变量F值的大小,可以看出影响高雄山虫草菌丝体中腺苷提取效果的各因素按大小排序依次为65%乙醇用量 (即料液比) >微波功率>提取时间>提取温度。

表2 Box-Behnken响应面实验设计及结果

表3 Box-Behnken Design响应面实验方差分析
2.3 响应面分析 经响应面软件分析,可得到超声功率(A)、提取时间 (B)、提取温度 (C)和65%乙醇用量(D)四个因素两两之间相互影响的显著程度,结果表明,超声功率、提取时间、提取温度和65%乙醇用量4个因素彼此之间的交互作用不显著。
为确定各因素的最佳取值,用Design-Expert 8.0.6.1软件进行数值优化分析,得出回归模型存在最大值点,即最佳试验条件。经分析,最佳提取条件为超声功率433.07 W、萃取时间30.98 min、提取温度40.36℃和65%乙醇用量34.00 mL。在此条件下,高雄山虫草菌丝体腺苷提取率为1.617 27mg/g。考虑实验的可操作性,将各提取工艺参数修正为超声功率433 W、萃取时间31 min、提取温度41℃和65%乙醇用量34 mL(即料液比34∶1 mL/g)。依据响应面分析获取修正后的最优工艺参数进行3次验证试验,结果腺苷平均提取率为1.608 5 mg/g,实测平均值与理论值的误差在1%以内,说明实验值与理论值有较好的拟合性,获取的最佳工艺参数具有实际应用价值。
3 结论
在单因素试验的基础上,采用响应面分析法对高雄山虫草菌丝体中腺苷的超声提取工艺条件进行了优化。结果表明,超声功率、提取时间、提取温度和料液比对高雄山虫草菌丝体中腺苷提取率均有显著影响,最佳工艺条件为:超声功率433W,提取时间31 min,提取温度41℃,65%乙醇用量34 mL即料液比1∶34 g/mL。验证实验结果表明,高雄山虫草菌丝体中腺苷提取率为1.608 5 mg/g,回归模型拟合度高,可用于优化高雄山虫草菌丝体中腺苷的提取工艺条件,具有实际应用价值。超声提取方法简单,具有提取效率高,操作简单,时间短等优点,是一种较理想的提取高雄山虫草菌丝体中腺苷的方法。
[1]Shimizu D.Color iconography of vegetable wasps and plant worms[M].Tokyo:Seibundo Shikosha,1994:230.
[2]荣跃文,徐 莉,汪小艳,等.高雄山虫草无性型细脚拟青霉的核型分析[J].菌物学报,2010,29(1):31-36.
[3]Nilanonta C,Isaka M,Kittakoop P,et al.Antimycobacterial and antip lasmodial cyclodepsipeptides froMthe insectpathogenic fungus Paecilomyces tenuipes BCC 1614[J].Planta Med,2000,66(8):756-758.
[4]Shin K H,LiMSS,Lee SH,etal.Antioxidant and immunostimulating activities of the fruiting bodies of Paecilomyces japonica,a new type of Cordyceps sp[J].Ann N Y Acad Sci, 2001,928:261-273.
[5]Chung E J,Choi K,KiMH W,et al.Analysis of cell cycle gene expression responding to acetoxyscirpendiol isolated froMPaecilomyces tenuipes[J].Biol PharMBull,2003,26(1):32-36.
[6]Kikuchi H,Miyagawa Y,Sahashi Y,et al.Novel spirocyclic trichothecanes,spirotenuipesine A and B,isolated froMentomopathogenic fungus,Paecilomyces tenuipes[J].JOrg Chem,2004,69(2):352-356.
[7]Takano F,Yahagi N,Yahagi R,et al.The liquid culture filtrates of Paecilomyces tenuipes(Peck)Samson(=Isaria japonica Yasuda)and Paecilomyces cicadae(Miquel)Samson(= Isaria sinclairii(Berk.)Llond)regulate Th1 and Th2 cytokine response in murine Peyerˊs patch cells in vitro and ex vivo[J]. Int J Immunopharmacol,2005,5(5):903-916.
[8]Li CR,Li Z Z,Fan MZ,etal.The composition of Hirsutella sinensis,anamorph of Cordycepssinensis[J].JFood Compos Anal,2006,19(8):800-805.
[9]李宝剑,金丽琴,左江成.细脚拟青霉多糖抗乙型肝炎病毒的体外实验研究[J].中药材,2007,30(2):200-202.
[10]葛 飞,高樱萍,桂 琳,等.中药大黄对细脚拟青霉液态发酵菌体生长及产胞内腺苷的影响[J].中药材,2012,35(7):1025-2028.
[11]刘慧娟,郑永标,陈丹霞,等.细脚拟青霉液体栽培及氨基酸成分分析[J].安徽农业科学,2013,41(1):21-22.
[12]陈安徽,邵 颖,樊美珍,等.细脚拟青霉深层发酵菌丝体核苷类成分分析[J].食品科学,2009,30(6):235-237.
[13]陈安徽,陈宏伟,邵 颖,等.细脚拟青霉活性成分分析及清除自由基活性研究[J].食品科学,2009,30(13):25-28.
[14]石恩慧,李 红,谷明灿,等.响应面法优化超声提取板栗总苞多酚工艺条件[J].中国食品学报,2013,13(5):69-76.
[15]林志娟,陈 永,尤 丽,等.响应面法优化超声辅助提取太子参多糖工艺研究[J].天然产物研究与开发,2013,25(6):846-850.
[16]王 宇,张 生,王少明,等.响应面分析法优化泽兰中桦木酸的超声辅助提取工艺[J].中成药,2013,35(11):2541-2545.
[17]国家药典委员会.中华人民共和国药典:2010年版一部[S].北京:中国医药科技出版社,2010:106.
R284.2
:B
:1001-1528(2015)05-1123-04
10.3969/j.issn.1001-1528.2015.05.046
2014-07-18
安徽省高等学校优秀青年人才基金项目 (2011SQRL079);安徽省高等学校省级自然科学研究重点项目 (KJ2013A049)作者简介:葛 飞(1978—),男,博士,副教授,研究方向为微生物资源开发与利用。E-mail:gerrylin@126.com
*通信作者:桂 琳(1980—),女,副教授,研究方向为应用微生物学。E-mail:gerrylinlin@126.com
超声提取高雄山虫草菌丝体中腺苷提取效率较高,时间较短,本实验确定的超声提取工艺可用于高雄山虫草菌丝体中腺苷的提取。
