原发灶消退的转移性黏液型黑素瘤一例临床病理分析
2015-01-12张熔熔朱小红
张熔熔 朱小红
黏液型恶性黑素瘤是恶性黑素瘤的特殊亚型,临床罕见,伴原发病灶消退更加罕见[1]。我们报道1例并结合文献对其临床病理学特点、诊断与鉴别诊断及预后和治疗进行总结。
临床资料
患者男,69岁,2个月前发现左大腿根部可扪及一肿块,无压痛,可推动。1个月前自觉肿块开始增大,稍影响腿部运动。为进一步诊治于2014年10月18日收住我院。体检:生命体征平稳,神清,心肺腹检查未见明显异常。左大腿根部可扪及一肿块,约3 cm×2 cm×2 cm,质韧,无皮肤红肿、破损,无压痛,可推动,境界清。B超提示左大腿根部有一37 mm×20 mm低回声团块,境界清。血常规白细胞10.9×109/L,中性粒细胞 0.80,淋巴细胞 0.12,血细胞沉降率120mm/1h。肝肾功能正常。于2014年10月22日全麻下行左大腿根部肿块切除术。术中见肿块质硬,界限清,约5 cm×4 cm×3 cm,包膜完整。术后病理诊断:左腹股沟淋巴结转移性黏液型黑素瘤,建议临床在同侧下肢找原发灶。临床仔细查找后在左小腿内侧皮肤上见多个着色斑,其中一个较大的不规则色斑为2 cm×2 cm(图1),边缘不规则,色素沉着不均匀。追问病史,左小腿内侧色斑20余年,3年前明显增大伴反复糜烂、结痂,后自行愈合。2014年11月28日在局麻下行左小腿内侧色斑处病变皮肤切除术。

图1 患者左小腿内侧皮损表现 见多个色斑,其中一个较大,边缘不规则,表面平坦
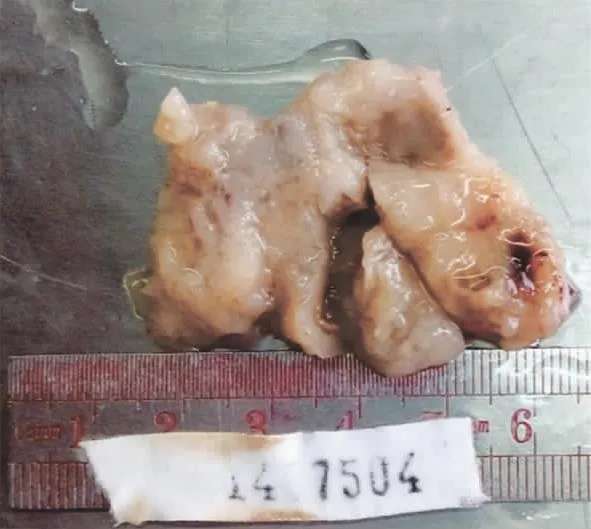
图2 切除完整的左大腿根部肿块 呈球形,有不完整包膜,切面质脆,见大量黏液
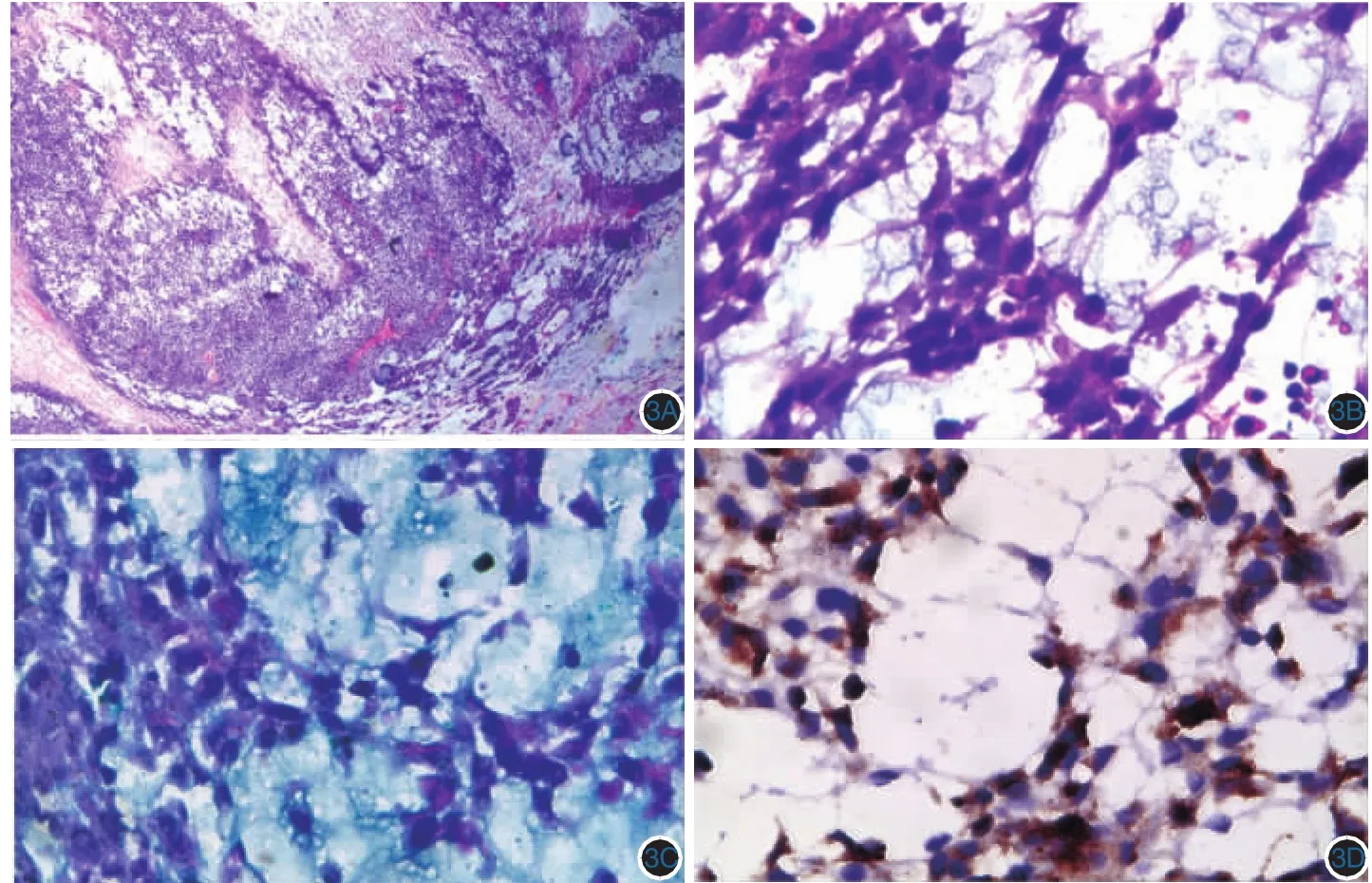
图3 左大腿根部肿块组织病理 肿瘤细胞呈多边形、小圆形,短梭形,间质为大片黏液湖。3A:HE×40;3B:HE×400;3C:肿瘤细胞黏液染色阳性(AB-PAS×400);3D:免疫组化染色肿瘤细胞Melan-A阳性表达(SP×400)

图4 左小腿内侧皮肤色斑组织病理 真皮内大量噬黑素细胞及胶原纤维,未见明确的恶性肿瘤细胞。4A:HE×40;4B:HE×400;4C:黏液染色阴性(AB-PAS×400);4D:免疫组化染色病变处Melan-A阳性表达(SP×400)
组织病理检查
1.左大腿根部肿块:肿块呈球形,4.5 cm×4 cm×2.5 cm大小,有不完整包膜,表面附有脂肪组织,切面质脆,中央有一直径0.8 cm囊腔形成,囊内及肿块表面见大量黏液(图2)。HE染色(图 3A、3B):肿瘤细胞呈多边形、小圆形和短梭形混杂,弥漫分布,小血管增生,细胞明显异形,核深染,核分裂易见,间质为大片黏液湖,肿瘤边缘见少量残存的淋巴组织,仔细查找可见窦结构;AB-PAS染色:肿瘤细胞阳性(图3C)。免疫组化染色:肿瘤细胞波形蛋白、Melan-A阳性表达(图3D);S100阳性表达,肌动蛋白、结蛋白、肌调节蛋白(MyoD1)、CD56、上皮膜抗原(EMA)、细胞角蛋白、白细胞共同抗原抗体(LCA)、CD99、神经元特异性烯醇化酶(NSE)、嗜铬蛋白A(CgA)、突触囊泡蛋白均为阴性表达。诊断:腹股沟淋巴结转移性黏液型黑素瘤。
2.左小腿内侧皮肤:皮肤上见多个色斑,深浅不均,其中一个较大,边缘不规则,表面平坦,切面灰白色,质韧,真皮内散在灰褐色小灶。HE染色(图4A、4B):表面覆盖鳞状上皮,上皮细胞无异形,表面无破溃,真皮内见分布不均的噬黑素细胞,纤维组织增生伴胶原化,皮肤附件明显减少,少量炎症细胞浸润;AB-PAS染色阴性(图4C)。免疫组化染色:波形蛋白、Melan-A阳性表达(图4D)。诊断:真皮纤维结缔组织增生伴胶原化,散在噬黑素细胞残留。
结合临床及两次病理检查结果综合诊断:伴左小腿原发灶消退的左腹股沟淋巴结转移性黏液型黑素瘤。术后予以干扰素治疗,具体为:干扰素18×106IU/d每周连用5 d,共4周,其后9×106IU/d每周3次,治疗11个月。患者已完成干扰素等治疗。随访至2015年3月仍存活。
讨 论
本例患者左大腿根部肿块术后组织病理学特征没有特异性,仅能诊断为黏液型恶性肿瘤。肿瘤边缘见少量残存的淋巴组织,提示为淋巴结,仔细查找见少量窦结构,故病理倾向是淋巴结转移性肿瘤。镜下细胞内找不到黑素颗粒,间质富于黏液,从组织学诊断黑素瘤很难,与其他黏液性肿瘤难以鉴别。免疫组化染色,左大腿根部肿块肿瘤细胞波形蛋白、S100、Melan-A阳性表达,肌动蛋白、结蛋白、MyoD1、CD56、EMA、细胞角蛋白、LCA、CD99、NSE、CgA、突触囊泡蛋白阴性表达,病理诊断为腹股沟淋巴结转移性恶黑。患者平素体健,未曾留意左小腿皮肤上的不规则色斑,对患者进行全身检查,没有发现原发灶,根据3年前左小腿色斑增大伴反复糜烂结痂病史,高度怀疑该处为原发灶。手术切除病变皮肤见真皮内大量噬黑素细胞,纤维结缔组织增生伴胶原变性,未见明确的恶性肿瘤细胞。查阅文献,曾报道过1例右上臂原发灶消退伴右腋窝淋巴结转移性黏液型黑素瘤[1],与本例极其相似,给我们这例诊断为伴左小腿原发灶消退的左腹股沟淋巴结转移性黏液型黑素瘤提供了佐证。
黏液型恶性黑素瘤临床罕见[2]。由于转移灶镜下可见大量黏液基质且缺乏黑色素沉着,确诊较困难[3]。黏液型黑素瘤的特征之一是转移灶为黏液而原发灶常为非黏液性。黏液样物质存在于细胞外基质内是本病的显著性特征。这种黏液样物质的来源目前未能明确,特殊染色显示细胞外黏液基质阿新蓝染色阳性,但在肿瘤细胞内未发现,因此有人推测这种物质可能是某种连接组织,这种连接组织可能来自增生的纤维组织而不是肿瘤组织本身[4]。因其临床发生频率较低,目前尚无文献就其生物学行为与黏液基质的相关性进行报道。本文罕见之处在于其原发病灶的消退及就诊时远处淋巴结的转移,给疾病的诊断带来困难。
临床上,腹股沟转移性黏液型恶性黑素瘤主要需与以下肿瘤鉴别:①黏液性恶性纤维组织细胞瘤:肿瘤灰白色,半透明或胶冻状,大多位于皮下,呈多发结节,黏液区细胞稀少,排列松散,肿瘤细胞S100、Melan-A阴性表达,溶菌酶和CD68阳性表达;②黏液性神经鞘瘤:肿瘤位于真皮和皮下,少数病例发生在深部软组织,大体表现类似黏液瘤,镜下纤维结缔组织分割肿瘤,形成轮廓清楚的小叶,地图状排列,结节状;小叶基质为透明质酸黏液和硫酸黏液构成的黏液瘤样物质,瘤细胞无明显异形性,免疫酶标肿瘤细胞Melan-A阴性表达,波形蛋白、S100、NSE阳性表达;③黏液性软骨肉瘤:小叶状的生长方式为软骨肉瘤的恒定表现,切面呈现蓝灰色或白色透明状,可见含有黏液样物质区域,波形蛋白、S100阳性表达,Melan-A阴性表达;④黏液性横纹肌肉瘤:横纹肌肉瘤形态多种多样,由不同分化阶段横纹肌母细胞组成,基本上重演了横纹肌胚胎发育过程中各个阶段的细胞,横纹肌肉瘤病理图像复杂,但免疫酶标肿瘤细胞肌动蛋白、结蛋白、MyoD1均有不同程度表达,Melan-A、S100阴性表达。
临床预后指征相关的临床参数包括年龄、性别和肿瘤的原发部位。年长患者比年轻患者预后差,男性患者比女性患者预后差,患者发生于上背部、上臂部、颈部和头皮(BANS)预后较四肢差,女性的预后与部位、肿瘤厚度无关[2],形态学指征包括肿瘤厚度、浸润速度、有丝核分裂速度、淋巴管血管受侵袭、神经周围浸润、自行消退及微卫星结节形成、表面溃疡形成、结节形成,均是预后不良指征[5-6]。目前临床已发现许多能自行消退的恶性黑素瘤,其中10%~35%为原发病灶消退,0.2%为转移灶消退[7]。以往认为黑素细胞的自行消退、尤其是浅表病变部位的消退是预后不良的特征,如今则认为其消退与预后的关系仍存在争论[8]。
[1]Inoue T,Misago N,Narisawa Y,et al.Metastatic myxoid melanoma with partial regression of the primary lesion [J].J Cutan Pathol,2007,34(6):508-512.
[2]Bhuta S,Mirra JM,Cochran AJ.Myxoid malignant melanoma.A previously undescribed histologic pattern noted in metastatic lesions and a report of four cases[J].Am J Surg Pathol,1986,10(3):203-211.
[3]Patel P,Levin K,Waltz K,et al.Myxoid melanoma:immunohistochemical studies and a review of the literature [J].J Am Acad Dermatol,2002,46(2):264-270.
[4]Subesinghe M,Marples M,Scarsbrook AF,et al.Clinical impact of(18)F-FDG PET-CT in recurrent stage III/IV melanoma:a tertiary centre Specialist Skin Cancer Multidisciplinary Team(SSMDT)experience[J].Insights Imaging,2013,4(5):701-709.
[5]Homsi J,Kashani-Sabet M,Messina JL,et al.Cutaneous melanoma:prognostic factors[J].Cancer Control,2005,12(4):223-229.
[6]Balch CM,Buzaid AC,Soong SJ,et al.Final version of the American Joint Committee on Cancer staging system for cutaneous melanoma[J].J Clin Oncol,2001,19(16):3635-3648.
[7]Awad MM,Sullivan RJ.Dabrafenib in combination with trametinib for the treatment of metastatic melanoma [J].Expert Rev Clin Pharmacol,2015,8(1):25-33.
[8]Calvani M,Pelon F,Comito G,et al.Norepinephrine promotes tumor microenvironment reactivity through β3-adrenoreceptors during melanoma progression[J].Oncotarget,2015,6(7):4615-4632.
