响应面法优化茶多酚乙酰化工艺条件
2015-01-11张雪松黄小忠
朱 媛,张雪松,黄小忠
1 南京晓庄学院,南京 210017;2 江苏农林职业技术学院,句容 212400
自由基是机体氧化反应中产生的有害化合物,具有强氧化性,可损害机体的组织和细胞,进而引起慢性疾病及衰老效应。而DPPH 自由基在实验室研究中用于抗氧化成分的体外抗氧化性评价。由于化学合成的抗氧化剂存在致癌、毒副作用等安全问题因而,天然抗氧化剂是减轻细胞氧化损伤、预防相关疾病和延缓衰老的最有效措施[1]。茶多酚是一种从茶叶中提取的天然抗氧化剂,已经得到许多领域的应用。儿茶素类是茶多酚的主要功能物质,此类物质脂溶性较差,如果直接添加到油相中,会出现凝聚和沉淀现象,会降低茶多酚的抗氧化性能[2,3]。
目前,分子修饰是国内外改造物质性质的重要途径,是改变物质生物学活性的重要手段。一般常用的改性方法有溶剂法、乳化法、分子修饰法等[4-7]。通过茶多酚改性,一方面可以提高物质的原有特性使其作用效果更高更好,另一方面通过引入各种功能集团而赋予其新的生理活性,从而扩大其应用范围。本文以乙酸酐为酰化剂,对茶多酚进行乙酰化改性研究。利用响应面分析法,以衡量产物抗氧化能力的DPPH(1,1-二苯基苦基苯肼)自由基抑制率为参数,优化茶多酚乙酰化工艺条件。
1 材料与仪器
1.1 材料
大豆油:起始过氧化物值(POV)为3.04 mmol/kg。
1.2 仪器与试剂
RE-5203 旋转蒸发仪(上海亚荣),WFG7200 分光光度计(上海尤尼柯),DZG-6050SA 真空干燥箱(上海森信),KQ3200E 超声波振荡仪(昆山超声仪器有限公司)。茶多酚(>98%,上海惠诚),乙酸酐、乙酸乙酯(AR,江苏强盛)、吡啶、氯仿(AR,上海凌峰)。
2 实验方法
2.1 茶多酚乙酰化合成工艺及精制
乙酸酐为酰化剂,乙酸乙酯为溶剂、吡啶为催化剂,回流加热。反应结束后,用少量水洗涤,静止分层,取乙酸乙酯层,经减压蒸馏、真空干燥后获得产品。
2.1.1 单因素实验
依次改变原料液料比、吡啶用量、反应时间及反应温度四个因素,测定乙酰化产物的DPPH 自由基抑制率值。
2.1.2 响应面法优化
综合单因素实验结果,采用Design-Expert V8.0进行实验设计,响应面实验因素水平如表1 所示。液料比、催化剂吡啶用量、反应温度、反应时间分别对应实验中因素的A、B、C、D,DPPH 自由基抑制率为衡量指标。
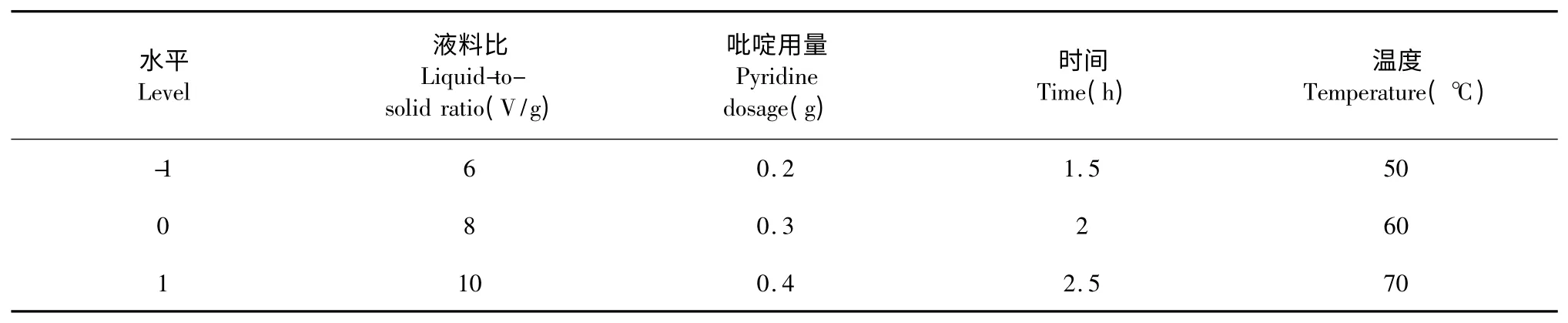
表1 茶多酚乙酰化响应面实验因素水平表Table 1 Factor level of acetylated tea polyphenols
2.2 DPPH 自由基抑制率测定[8]
将待测样品用无水乙醇配置成1 g/L,再用乙醇稀释成一定浓度,作为待测定样品溶液。
测定:样品溶液+DPPH 溶液各2 mL 为Ai(为样品抑制吸收值);样品溶液+无水乙醇2 mL 为Ac(为样品对照);DPPH 溶液+无水乙醇各2 mL 为Aj(为无抑制吸收值);4 mL 无水乙醇为无抑制吸收值对照。分别充分振荡混匀,室温静止30 min 后在517 nm 处测定吸收值(每个测定设两个重复)。DPPH 自由基抑制率按以下公式计算:抑制率=(Aj-Ai)/Aj。
2.3 产物脂溶性的测定
称取10 mg 干燥后的产品,溶于10 mL 氯仿中,超声10 min 使其溶解,配成浓度为1g/L 的溶液或悬液,震荡器上震荡混匀后用紫外分光光度计测定溶液或悬液800 nm 下的透光率。
2.4 油脂抗氧化测定
按GB/T5538-2005/ISO3960-2001 进行油脂过氧化值(POV)测定,将样品按GB2760-2007《食品添加剂使用标准》的最大允许量溶于无抗氧化剂大豆油中,在63 ℃下每隔24h 测定POV 值,测定样品抗氧化值[8]。按食用油卫生标准规定,油脂中POV 达到11.8mmol/kg 时所需时间为诱导时间,即活性氧法(active oxygen method,AOM)值,计算保护系数(PF):PF=添加抗氧化剂的AOM 值/未添加抗氧化剂的AOM 值。
3 结果与分析
3.1 单因素实验结果
料液比(A)、吡啶用量(B)、反应时间(C)及反应温度(D)对产物DPPH 自由基抑制率的影响见图1(A~D)。由图可知,经过改性之后的产物DPPH自由基抑制率优于未改性的茶多酚。随着料液比、吡啶用量、反应时间以及反应温度的增加,反应产物DPPH 自由基抑制率均先升高后降低。当料液比、吡啶用量、反应时间以及反应温度分别为1∶8,0.3 g,2 h 以及60 ℃时,DPPH 自由基抑制率达到最大。
3.2 响应面实验优化茶多酚乙酰化工艺条件
3.2.1 响应面实验设计及结果
茶多酚乙酰化响应面实验设计及结果见表2。
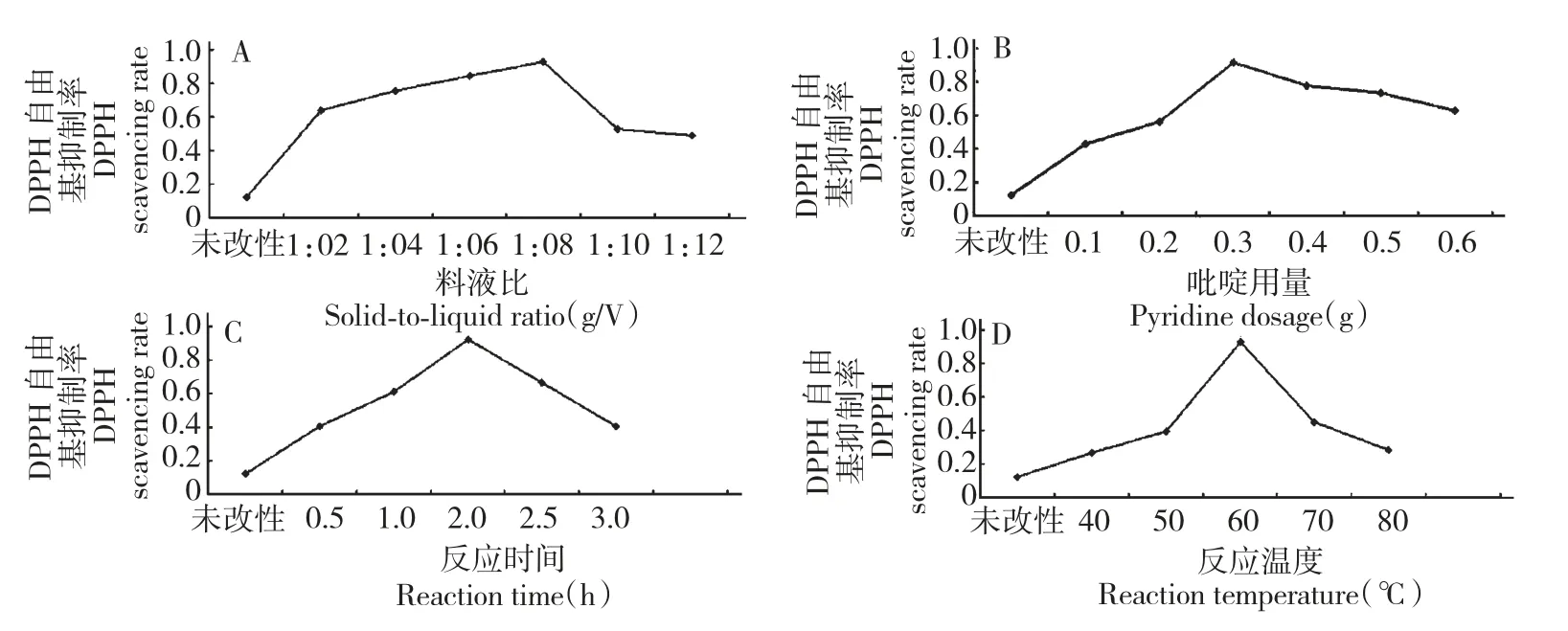
图1 料液比(A)、吡啶用量(B)、反应时间(C)及反应温度(D)对产物DPPH 自由基抑制率的影响Fig.1 Effects of solid-to-liquid ratio(A),pyridine dosage(B),reaction time(C)and temperature(D)on DPPH free radical scavenging rates of the synthesized compound
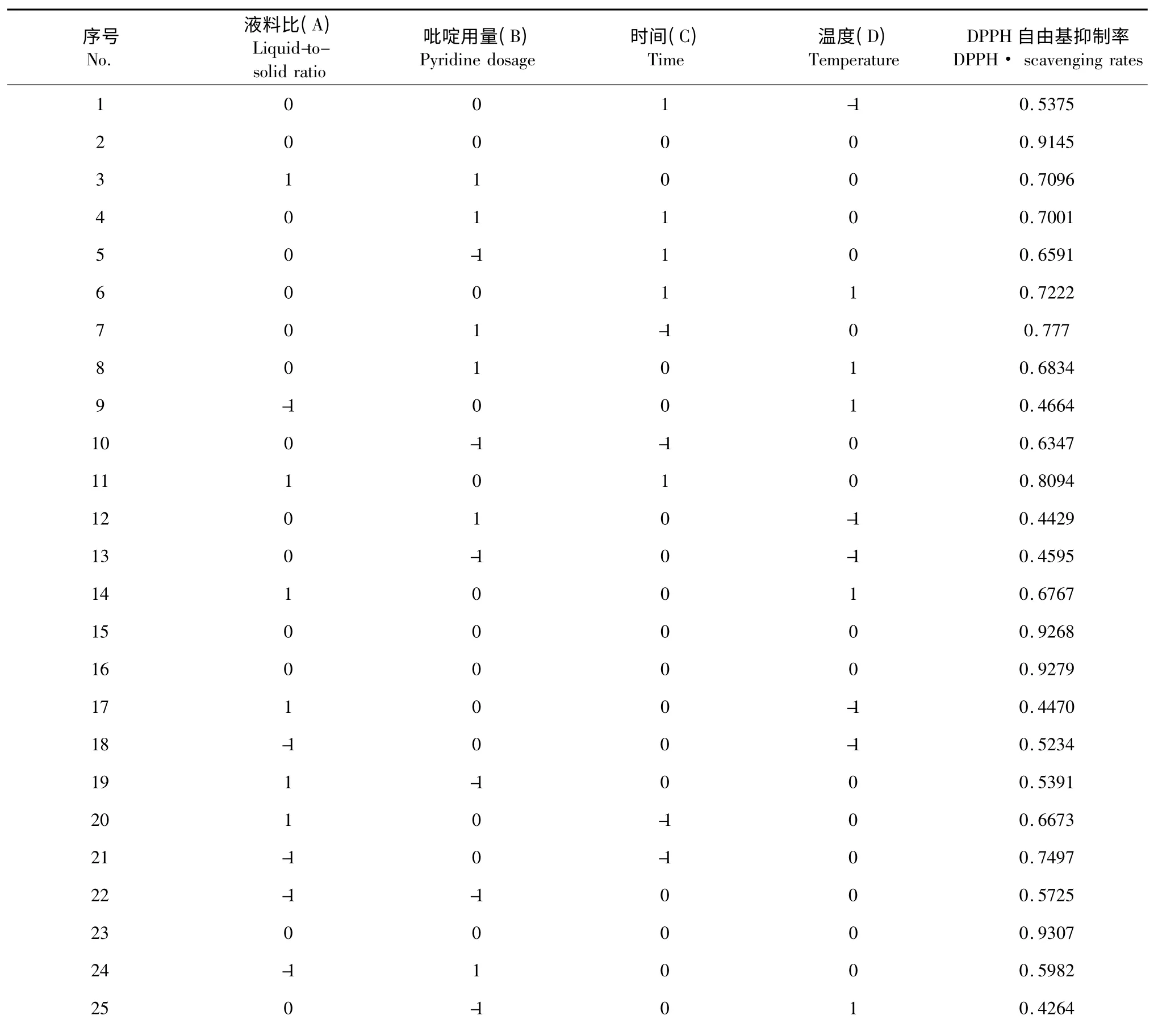
表2 响应面实验设计结果Table 2 Response surface experimental results of acetylated tea polyphenols

3.2.2 方差分析
对表2 数据运用Design-Expert V8.0 软件进行方差分析,结果见表3、表4。
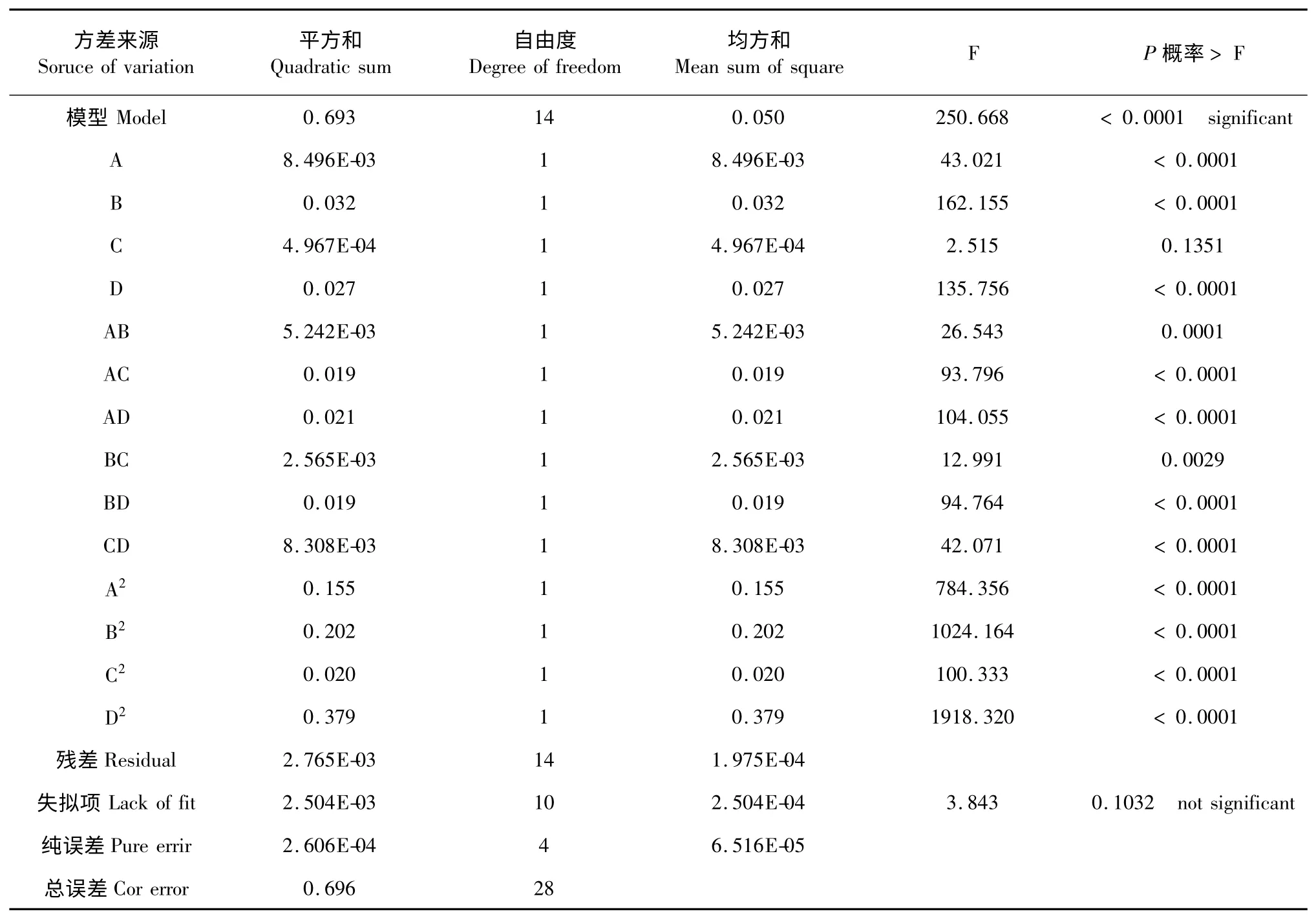
表3 模型方差分析Table 3 Analysis of variance for the regression model
P<0.05,说明对应的因素对响应值影响显著。从方差分析来看由于所选择模型显著,失拟项不显著,即所选择的模型可靠。在液料比、吡啶用量、反应时间以及温度四个因素中,液料比、吡啶用量和反应温度的影响显著。此外,四个因素对改性产物DPPH 自由基抑制率的影响也不是简单的线性关系,诸因素之间的交互影响也较为显著。
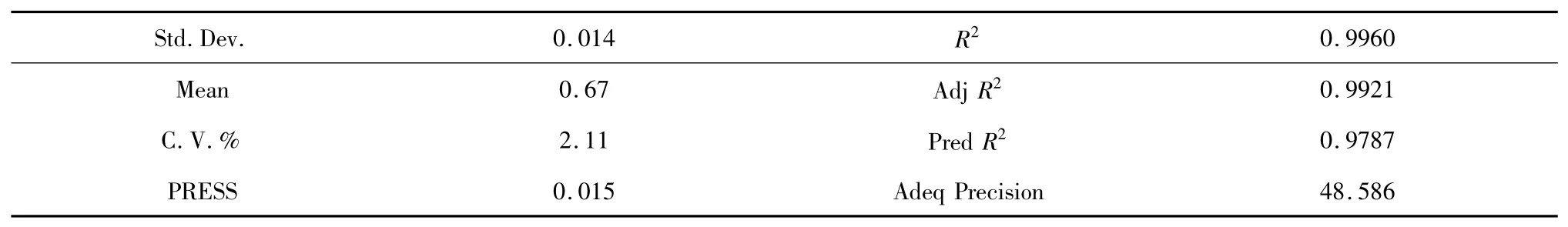
表4 R2 综合分析表Table 4 Analysis of R2
从表4 可以看出,模型的R2=0.9960,R2校正=0.9921,R2预测与R2校正较为接近,信躁比为48.586(>4)可知回归方程拟合度和可信度均很高,试验误差较小,故可用此模型对乙酰化茶多酚的工艺条件进行优化与预测。
利用Design Expert V8.0 软件对表2 所得实验数据进行多元回归拟合分析,获得微波提取茶多酚的多元二次回归方程模型:DPPH 自由基抑制率=-7.97363+0.22601×A+6.57248×B-0.067910×C+0.22731×D+0.18100×A×B+0.068050×A×C+3.58375E-003×A×D-0.50650×B×C+0.068400×B×D+9.11500E-003×C×D-0.038633×A2-17.65817×B2-0.22108×C2-2.41669E-003×D2。
3.2.3 响应曲面图及其等高线图
根据回归方程,获得响应曲面图及等高线图,考察液料比、吡啶用量、反应时间、反应温度以及交互作用对DPPH 自由基抑制率的影响,如图2~7 所示。
3.2.3.1 液料比和吡啶用量对DPPH 自由基抑制率的交互影响
图2 为吡啶用量和液料比对改性产物DPPH 自由基抑制率的响应曲面和等高线图。当反应时间与温度为最佳值时,随着吡啶用量以及液料比的增加,产物的DPPH 自由基抑制率均出现显著的变化,抑制能力先增大后减小。由图2 可以确定最佳水平范围吡啶用量0.27~0.36 g,料液比为1∶7.3~1∶9.1。
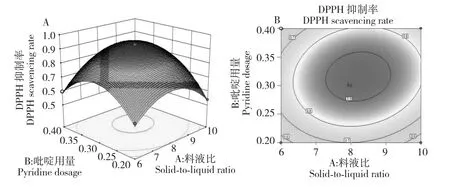
图2 液料比和吡啶用量对DPPH 自由基抑制率响应曲面图(A)与等高线图(B)Fig.2 Response surface plot(A)and contour plot(B)showing mutual influences of liquid-to-solid ratio and pyridine dosage on DPPH·scavenging rates of the synthesized compound
3.2.3.2 时间和液料比对DPPH 自由基抑制率的交互影响
图3 为时间和液料比对改性产物DPPH 自由基抑制率的响应曲面和等高线图。当温度与吡啶用量为最佳值时,随着时间及液料比的增加,改性产物对DPPH 自由基抑制率均呈现出先增大后减小的现象。由图3 可以确定最佳水平范围时间为1.58~2.38 h,液料比为7.23~9.08。
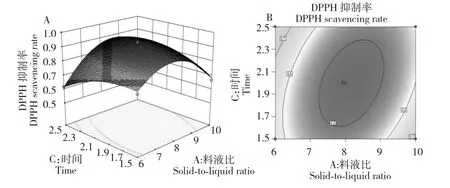
图3 时间和液料比对DPPH 自由基抑制率响应曲面图(A)与等高线图(B)Fig.3 T Response surface plot(A)and contour plot(B)showing mutual influences of reaction time and liquid-to-solid ratio on DPPH·scavenging rates of the synthesized compound
3.2.3.3 温度和液料比对DPPH 自由基抑制率的交互影响
图4 为温度和液料比对DPPH 自由基抑制率影响的响应曲面和等高线图。当时间与催化剂用量为最佳值时,随着温度和液料比的增加,改性产物的DPPH 自由基抑制率均先增大后减小。由图4 可以确定最佳水平范围温度为52~65 ℃,液料比为7.3~9.1。
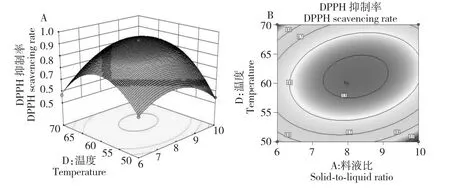
图4 温度和液料比对DPPH 自由基抑制率响应曲面图(A)与等高线图(B)Fig.4 Response surface plot(A)and contour plot(B)showing mutual influences of reaction temperature and liquid-to-solid ratio on DPPH·scavenging rates of the synthesized compound
3.2.3.4 时间和吡啶用量对DPPH 自由基抑制率的交互影响
图5 为时间和吡啶用量对改性产物DPPH 自由基抑制率的响应曲面和等高线图。当温度与液料比为最佳值时,随着吡啶用量的变化,改性产物DPPH自由基抑制率先增大后减小。而当时间改变时,产物的DPPH 自由基抑制率同样是先增大后减小,但变化相对不是很显著。由图5 可以确定最佳水平范围时间为1.58~2.34 h,催化剂用量为0.27~0.36 g。
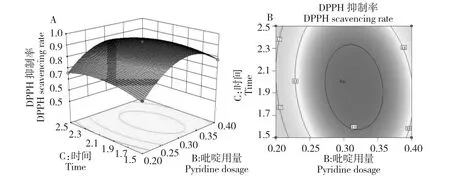
图5 时间和吡啶用量对DPPH 自由基抑制率响应曲面图(A)与等高线图(B)Fig.5 Response surface plot(A)and contour plot(B)showing mutual influences of reaction time and pyridine dosage on DPPH·scavenging rates of the synthesized compound
3.2.3.5 吡啶用量与温度对DPPH 自由基抑制率的交互影响
图6 为吡啶用量和温度对改性产物DPPH 自由基抑制率的响应曲面和等高线图。当时间与液料比为最佳值时,随着吡啶用量以及温度的增加,改性产物DPPH 自由基抑制率均先增大后减小。由图6 可以确定最佳水平范围温度为57.5~65 ℃,催化剂用量为0.27~0.36 g。
3.2.3.6 温度和时间对DPPH 自由基抑制率的交互影响
图7 为时间和温度对DPPH 自由基抑制率影响的响应曲面和等高线图。当吡啶用量与液料比为最佳值时,随着温度的升高、时间的延长,改性产物DPPH 自由基抑制率均先变大后减少。由图可以确定最佳水平范围温度为57.5~64.8 ℃,时间为1.62~2.37 h。

图6 吡啶用量和温度对DPPH 自由基抑制率响应曲面图(A)与等高线图(B)Fig.6 Response surface plot(A)and contour plot(B)showing mutual influences of pyridine dosage and reaction temperature on DPPH·scavenging rates of the synthesized compound
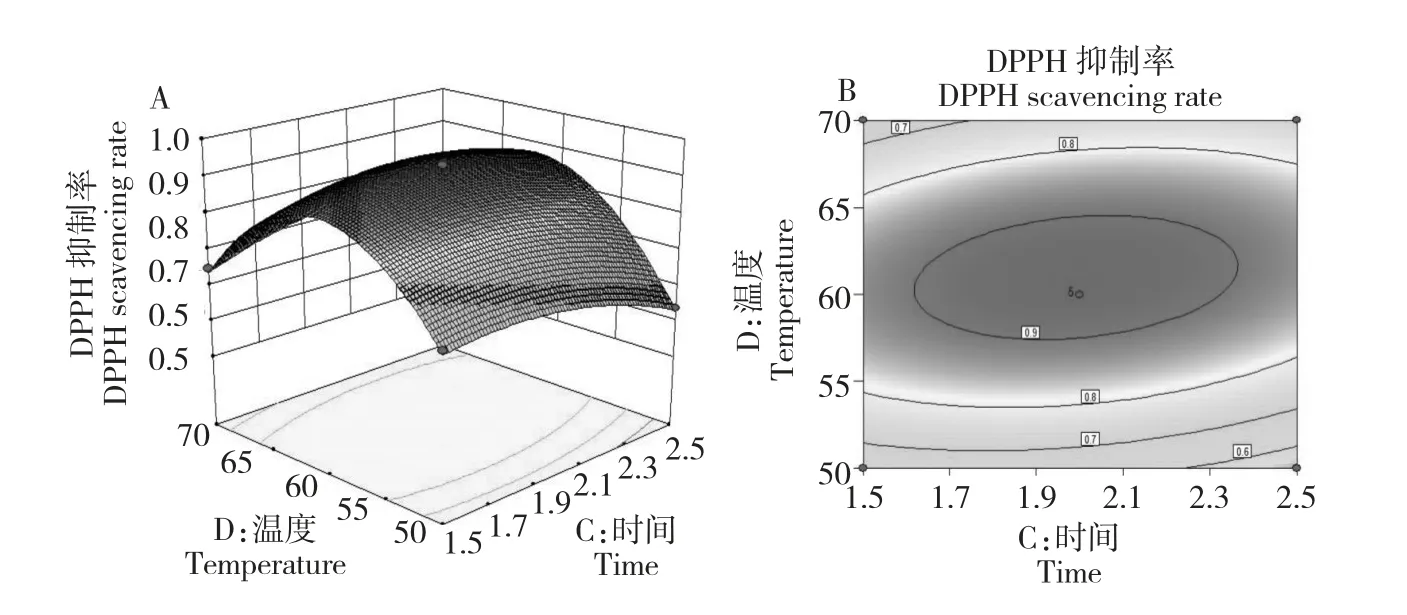
图7 温度和时间对DPPH 自由基抑制率响应曲面图(A)与等高线图(B)Fig.7 Response surface plot(A)and contour plot(B)showing mutual influences of reaction temperature and time on DPPH·scavenging rates of the synthesized compound
3.2.4 最优条件及验证实验
通过软件对数据进一步分析可得模型理论最佳条件为液料比8.31、催化剂用量0.32 g、在61.5 ℃下回流反应2.03 h,模型预测改性茶多酚DPPH 自由基抑制率为0.9376。按最优条件进行实验验证,所得改性茶多酚DPPH 自由基抑制率为0.9318,相对误差为-0.64%,说明此模型预测可靠。
3.3 茶多酚乙酰化性能比较
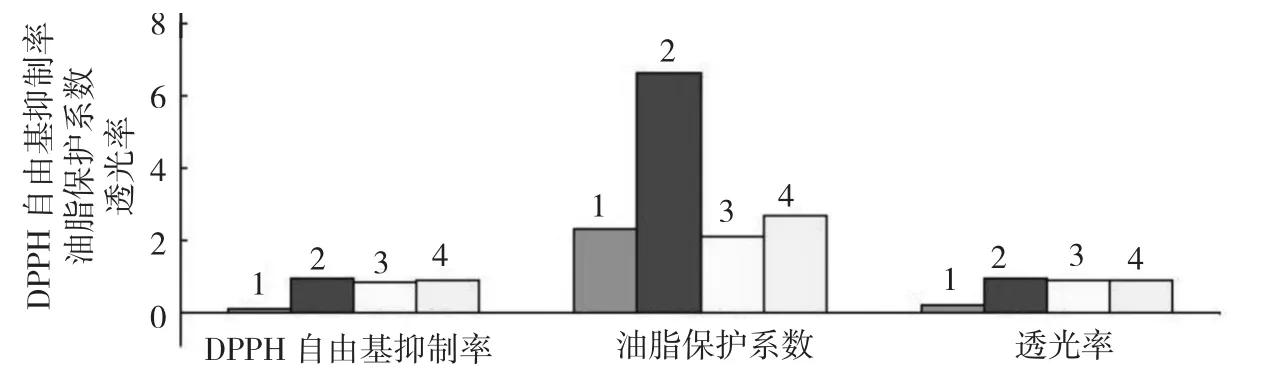
图8 改性茶多酚与几种抗氧化剂性能比较Fig.8 Comparison of DPPH·scavenging rates,fat protection index and light transmittance among modified tea polyphenol and other antioxidants
丁基羟基茴香醚(BHA)与特丁基对苯二酚(TBHQ)是两种常见的抗氧化剂。茶多酚乙酰化改性产物与这两种常见抗氧化剂性能比较见图8。从图中可以看出,与未改性茶多酚相比,改性茶多酚的抗氧化能力得到了较大的提高。DPPH 自由基清除率从0.1220 提高到0.9318,比改性前提高了7.64倍;脂溶性也大大提高,透光率从0.225 提高到0.926,溶解性比改性前提高了4.12 倍;而衡量油脂抗氧化能力的保护系数从2.300 提高到6.612,提高了2.87 倍。乙酰化后的改性茶多酚抗氧化能力优于BHA 以及TBHQ 这两种常见抗氧化剂,DPPH 自由基清除率是特丁基对苯二酚的1.1 倍,保护系数是特丁基对苯二酚的2.48 倍。
4 结论
本文采用乙酸酐对茶多酚进行改性,从四个因素(液料比、吡啶用量、反应时间、反应温度)考察了改性产品对DPPH 自由基抑制率的影响。利用响应面法设计正交实验,建立了四因素相互作用的回归模型,预测最佳乙酰化条件为料液比1∶8.31、催化剂用量0.32 g、反应温度61.5 ℃、反应时间2.03 h,实验所得改性茶多酚DPPH 自由基抑制率为0.9318,与模型预测值非常接近,比改性前提高了7.64 倍。此条件下产物脂溶性良好,透光率为0.926,与未改性产品相比,溶解性提高了4.12 倍。抗氧化性能实验显示改性产物的抗氧化能力优于BHA 和TBHQ 这两种常见抗氧化剂。
1 Wang XY(王雪艳),Chen FH(陈发河),Wu GB(吴光斌),et al.Study on free-radical scavenging activities of polysaccharide extracts from Longan.J Jimei Univ,Nat Sci(集美大学学报,自科版),2010,15:109-114.
2 Li QL(李清禄),Lin XH(林新华).Preparation of synergic fat-soluble tea polyphenols solution and antioxidative properties in edible plant oils.J Fujian Agric Univ,Nat Sci(福建农林大学学报,自科版),2001,30:244-249.
3 Liu XH(刘晓辉),Jiang HY(江和源),Zhang JY(张建勇),et al.Study on preparation of acetylated EGCG.J Anhui Agric Sci(安徽农业科学),2009,37:11360-11363.
4 Mei XG(梅兴国),Dong YL(董妍玲),Pan XW(潘学武).The synthesis of liposoluble tea polyphenols(LTP)and its resistance to autoxidation of oil.Nat Prod Res Dev(天然产物研究与开发),2001,13(4):12-15.
5 Gao M(高汨),Xu H(徐徽).Preparation and antioxidant performance of oil-soluble type tea-polyphenol.Guangzhou Food Sci Technol(广州食品工业科技),2001,17(2):20-21.
6 Zeng L(曾磊),Tang HJ(唐怀建),Zhang YJ(张玉军).Preparation and antioxidative activity of lipid-soluble tea polyphenols.China Oils Fats(中国油脂),2004,29(11):54-57.
7 Zhang Y(张怡),Fang SH(房诗宏).Study on solubility modification of tea polyphenols.Food Sci(食品科学),2001,22(2):88-92.
8 Lu CC(卢聪聪),Shao WL(邵卫梁),Hang XM(杭晓敏),et al.Two kinds of chemical modification on tea polyphenols and study on the antioxidant activity of the lipid-soluble teapolyphenols.Anhui Med Pharm J(安徽医药),2008,12:201-204.
