天然抗补体活性物质研究进展
2015-01-11徐小娜陈亮宇赵心清
徐小娜,陈亮宇,赵心清
大连理工大学生命科学与技术学院,大连 116023
补体(Complement)是存在于正常人和动物血清与组织液中的一组经活化后具有酶活性的蛋白质,可辅助和补充特异性抗体,介导免疫溶菌、溶血作用,故称为补体[1]。补体激活途径主要有三条:经典途径(Classical pathway)、旁路途径(Alternative pathway)和凝集素(MBL)途径(Terminal pathway)。一般抗补体物质活性检测一般用经典途径和旁路途经的抗补体活性达到50% 的抑制浓度(CH50和AP50)来检测,通常用肝素作为阳性对照。然而,补体异常活化会引起许多疾病如风湿性关节炎、老年痴呆症等[1-3],此外,补体过度激活也会对一些组织造成实质性的损伤,如血管[4]、肾脏[5]、关节[6]和红细胞[7]等。因此,具有抗补体活性药物的研发引起了人们广泛的关注。
化学合成的抗补体抑制剂具有成本高、选择性差、长期使用会降低人体防御机能,并能产生多种副作用等缺点,而天然产物来源的中的抗补体活性成分开发成本低,并可以直接在体内被消化吸收[3,8]。因此,天然产物来源的抗补体活性物质引起了国内外学者的普遍关注[3]。近年来,天然产物来源的抗补体活性物质不断被发现,显示出了较好的抗补体活性应用前景。本文对近年来天然产物来源的抗补体成分进行了综述,并对抗补体活性天然产物的应用前景进行了展望。
1 抗补体化合物
自然界广泛存在着具有抗补体活性的物质。迄今为止,已经报道从众多动植物及微生物代谢产物中分离出黄酮、多糖、甾体和萜类等具有抗补体激活作用的成分。
1.1 多糖类化合物
多糖类化合物在抗肿瘤、抗炎、抗病毒等方面发挥着重要的生物活性作用。抗补体活性作为多糖研究领域的一大热点课题,其中,糖基化蛋白和多聚糖化合物研究占大多数[9-11]。从天然产物中分离得到的具有抗补体活性的多糖成分主要包括硫酸化多糖、酸性多糖和中性多糖,其中具有抗补体活性的大多是酸性多糖。但其它类型的多糖也具有抗补体活性,如水溶性多糖APS-W1、薏苡仁精多糖和新型杂多糖RBPS2a[12-14]。表1 是近年来具有抗补体活性多糖的研究概况。

表1 一些活性多糖的来源和抗补体活性Table 1 Sources and anti-complementary activities of some active polysaccharides
1.2 黄酮类化合物
大量研究发现黄酮类化合物具有广泛的药理活性,其抗补体活性研究也是近年来的药物研发热点之一。从女贞(Ligustrum vulgare)、宽叶菲利(Phillyrea latifolia)和野马追(Eupatorium lindleyanum DC)中分离得到具有抗补体活性的黄酮类化合物,其中从野马追中分离得到的棕矢车菊素抗补体活性最强,其经典途径中50% 溶血所需棕矢车菊素的浓度(CP50)为112 μM[22,23]。
从木姜粳稻(Litsea japonica)叶的提取物中分离得到具有抗补体活性的黄酮类化合物,分别是化合物1(afzelin)、2(quercitrin)、3(tiliroside)(图1)[24]。其中化合物3 的CP50浓度为101 μM。
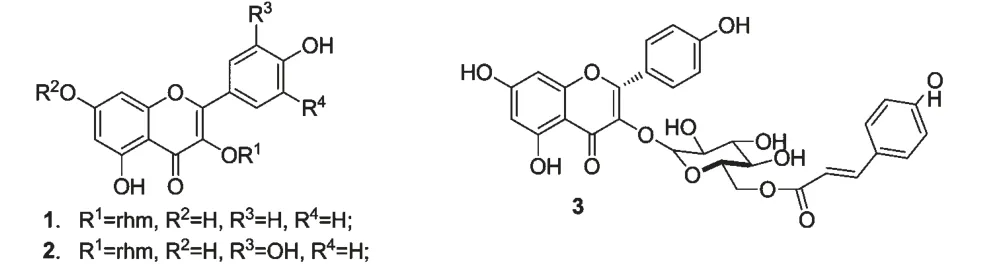
图1 木姜粳稻中黄酮类化合物的结构Fig.1 Chemical structures of flavonoids in Litsea japonica
豆科槐属植物苦参(Sophora flavescens)的乙酸乙酯相提取分离得到两个黄酮类化合物,分别为7,4'-二羟基黄酮(4)和降脱水淫羊藿素(5),化合物4对补体系统的经典途径和旁路途径有抑制作用,其CH50和AP50分别为470±80 μM 和1770±197 μM,而化合物5 对补体系统的经典途径有抑制作用,CH50为950±81 μM[22]。从广藿香中分离得到化合物5,4'-二羟基-3,7,3'-三甲氧基黄酮对经典和旁路途径的补体激活均有抑制作用,其CH50为210~3140 μM,AP50为1130~1420 μM[25]。
1.3 甾体类化合物
甾体类化合物是广泛存在于自然界中的一类天然化学成分,甾体具有很多种分类,但其共同结构特点是都含有环戊烷骈多氢菲的甾体母核。从升麻(Cimicifuga foetida)中分离得到作用于经典途径的抗补体活性的3 个化合物,发现化合物6 抗补体活性最强,其经典途径中50%溶血样品所需的最小浓度(IC50)为28.6 μM[26](图2)。
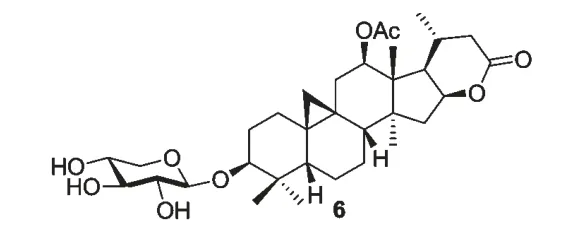
图2 升麻中甾体类化合物的结构Fig.2 Chemical structure of steroids in Cimicifuga foetida
南瓜(Cucurbita Moschata)的氯仿和乙酸乙酯萃取物中分离得到3 个植物甾醇类化合物,在经典途径的抗补体系统中均表现出显著的抗补体活性,这三个化合物的总的IC50为0.74 mg/mL[27]。
从五味子(Schizandra chinensis)果实中分离得到化合物citrostadienol(7),在经典途径的抗补体系统中具有显著的抗补体活性,其IC50为0.046 μM[28](图3)。
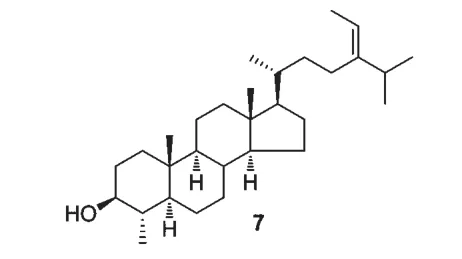
图3 化合物citrostadienol 的结构Fig.3 Chemical structure of citrostadienol
1.4 皂苷类化合物
皂苷主要分布于陆生高等植物中,也有少量存在于海洋生物中。从中药人参总皂苷中分离到12个化合物8~19(图4),通过经典途径抗补体实验发现,化合物9、16、17 和19 有较好的抗补体活性,其CH50分别为200、156、138 和74 μM。进一步对化合物9、12、19 进行靶点作用的研究,结果表明,化合物9 作用靶点是C1、C2、C4、C5,而化合物12 和19的作用靶点是C1、C2、C3、C4 和C5,这一结果揭示了抗补体系统的作用机理,为下一步天然来源的补体抑制剂的研究与开发提供了理论依据[29]。
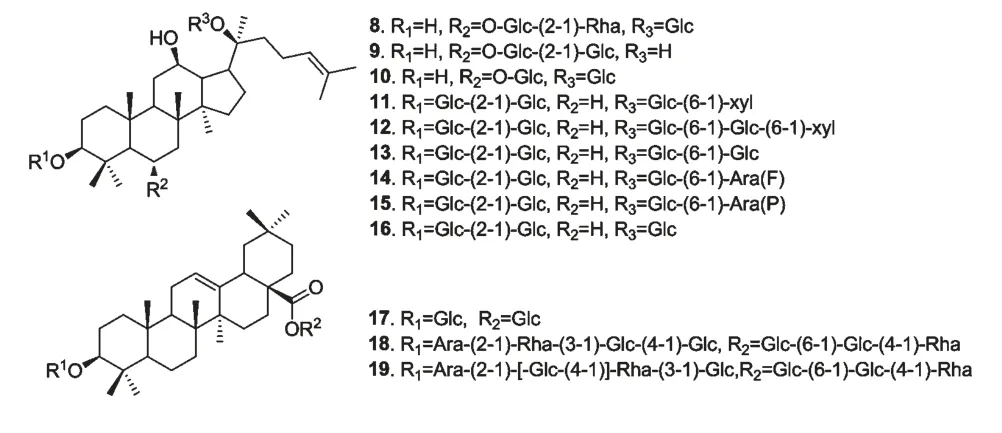
图4 人参中皂苷类化合物的结构Fig.4 Chemical structures of saponins in the ginseng
1.5 萜类化合物
萜类化合物是由异戊二烯或异戊烷以不同方式连接而成的一类天然化合物,萜类化合物是挥发油的主要成分。从酸枣(Zizyphus jujuba)果实中分离得到3 个具有抗补体活性的三萜类化合物,其中IC50分别为101.4、143.9 和163.4 μM[30]。
从单叶升麻(Beesia calthaefolia)中分离得到5个化合物20~24,其中化合物20~22 为新型环阿屯烷型四环三萜化合物,化合物23~24 为已知化合物,通过经典途径的抗补体实验发现化合物23 具有较强的抑制活性,其IC50为136.7 μM,而阳性对照迷迭香酸的IC50为181.8 μM。化合物20 和21 结构中-OH 键在C-12、C-18 和C-15 位对于经典途径的抗补体活性有影响[31](图5)。
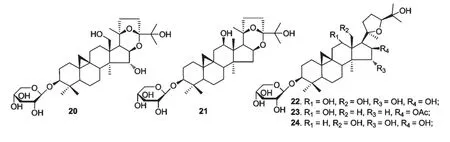
图5 单叶升麻中萜类化合物的结构Fig.5 Chemical structures of terpene in Beesia calthaefolia
1.6 酶、肽类化合物
已报道的具有抗补体活性的酶、肽类化合物大多来源于蛇毒提取物。研究发现烙铁头蛇(Trimeresurus mucrosquamatus)蛇毒的蛋白组分具有抗补体活性[32]。从该蛇毒中分离得到的一种金属蛋白酶TMAC-1,能够抑制补体经典途径和替代途径的溶血,其CH50和AP50分别为0.4 mg/L 和29 mg/L[33]。从中华眼镜蛇蛇毒中分离得到的抗补体蛋白atrase B,在体外能明显抑制补体激活,引起的血小板膜P-选择素和GPIIb/IIIa 的表达[34]。对眼镜蛇毒因子(cobra venom factor,CVF)抑制补体对创伤大鼠深静脉血栓研究发现,CVF 对创伤后大鼠体内补体进行抑制,能够改善大鼠创伤后血凝状态,降低创伤后深静脉血栓的发生率[35]。从原矛头蝮蛇蛇毒中分离得到一个酸性纤溶酶PMSP-A,当浓度为0.075 mg/mL 时,其补体经典途径溶血抑制率为55.59%[36]。
牡蛎的牡蛎糖原(oyster glycogen,OG)中分离得到的牡蛎糖原组分OG11 具有较强的抗补体活性,当浓度为5.0 mg/mL 时补体抑制率可达到77.38%[37]。
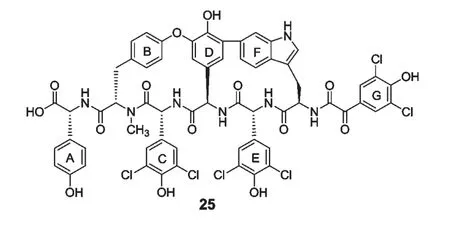
图6 化合物complestatin 的结构Fig.6 Chemical structure of complestatin
肽类化合物广泛存在于天然产物中,特别是海洋微生物次生代谢产物中含有大量具有生物活性的肽类化合物。从链霉菌属菌种Streptomyces lavendulae SANK 60477 的菌丝体和Streptomyces sp.MA7234的发酵液中分离得到具有抗补体活性的化合物complestatin(25),其CH50和AP50分别为0.3 μM 和0.53 μM。该化合物可以通过阻断过敏毒素产生的抗原(C3a 和C5a)来抑制全身过敏性休克[38,39](图6)。在对大连地区海洋放线菌活性物质进行研究的过程中,本课题组发现了很多独特的海洋链霉菌,并鉴定了一株新的海洋放线菌,命名为星海链霉菌[40-42],基因组序列分析表明,该菌种具有与糖肽类抗生素complestatin 生物合成基因簇的类似基因序列,因此我们开展了抗补体活性检测,发现其发酵液具有明显的抗补体活性,并对其活性物质的结构进行了研究(未发表资料)。目前来自微生物的抗补体物质研究得还比较少,是值得关注的研究方向。
1.7 其它类化合物
除了以上重点介绍的几类,还有很多特殊结构的化合物,如木质素类、酚类、脂类、酸类等。下表是其他类化合物的研究概况(表2)。
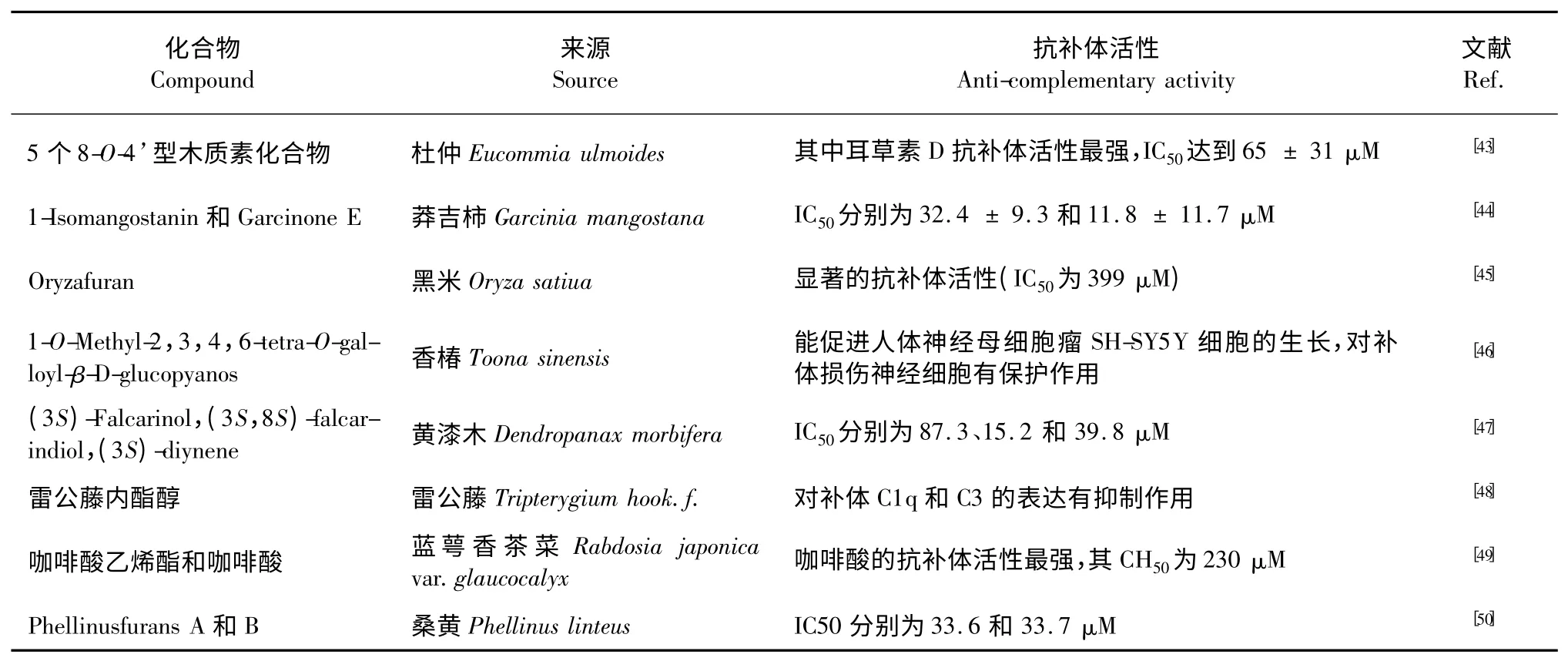
表2 其它抗补体化合物的来源和抗补体活性Table 2 The anti-complementary activities of other anti-complement compounds
2 展望
来自植物、动物和微生物的天然产物中广泛存在着抗补体活性成分。相比植物资源的生长周期长、产量低、质量控制困难等限制,微生物具有其独特的优势,如生长繁殖快、易培养、生长过程可控、产量高、适合工业化生产,同时微生物的次生代谢产物种类繁多。此外,微生物容易进行遗传操作,可以利用组合生物合成等方法获得大量的类似物,更容易进行结构和药效的研究以及改善活性。因此,开发微生物来源的抗补体活性物质对于保护有限的植物资源和物种多样性具有重要的意义,同时在大量生产方面具有巨大的应用开发前景。
目前对于天然产物来源的抗补体活性物质的研究仍然处于初级阶段,还有许多问题尚待解决,如许多天然产物中分离得到的具有抗补体活性成分结构不明确、作用靶点和毒副作用未知等。当前临床上对新型补体抑制剂的需求日益迫切,因此需要加强对天然产物中抗补体活性成分的基础研究,尤其是对微生物来源的抗补体活性成分的开发。
1 Min B,et al.Anti-complement activity of constituents from the stem-bark of Juglans mandshurica.Biol Pharm Bull,2003,26:1042-1044.
2 Gomes GI,et al.The functional state of the complement system in leprosy.Am J Trop Med Hyg,2008,78:605-610.
3 Xu H(徐晗),et al.Anti-complementary agents from natural products.Chin J Nat Med(中国天然药物),2007,5:322-332.
4 Alper CA,Balavitch D.Cobra venom factor:evidence for its being altered cobra C3(the third component of complement).Science,1976,191:1275-1276.
5 Cooper NR.Formation and function of a complex of the C3 proactivator with a protein from cobra venom.J Exp Med,1973,137:451-460.
6 Holden C.Flurry over venom.Science,1980,207:161.
7 Caldwell JR.Venoms,copper,and zinc in the treatment of arthritis.Rheum Dis Clin N Am,1999,25:919-928.
8 Xie YP(谢予朋),et al.Advance research on the inhibition of active components of Chinese herbs to complement system.Chin Med Her(中国医药导报),2013,10(33):28-33.
9 Lee SM,et al.Anti-complementary activity of protostane-type triterpenes from Alismatis rhizoma.Arch Pharm Res,2003,26:463-465.
10 Park B,et al.Isolation and anticomplement activity of compounds from Dendropanax morbifera.J Ethnopharmacol,2004,90:403-408.
11 Pieroni A,et al.Studies on anti-complementary activity of extracts and isolated flavones from Ligustrum vulgare and Phillyrea latifolia leaves(Oleaceae).J Ethnopharmacol,2000,70:213-217.
12 Wang L,et al.Purification and identification of a novel heteropolysaccharide RBPS2a with anti-complementary activity from defatted rice bran.Food Chem,2008,110:150-155.
13 Fan H,et al.Structure of a homofructosan from Saussurea costus and anti-complementary activity of its sulfated derivatives.Carbohyd Polym,2014,105:152-160.
14 Chen Y(陈燕).Extraction and separation of effective components from Coix lacryma-jobi L.kernel.Guiyang:Guiyang Univ(贵州大学),PhD.2010.
15 Zhang XJ(张学俊),et al.Isolation,anti-complement activities,and chemical structures of polysaccharide from Eucommia ulmoides Leaves.Nat Prod Ret Dev(天然产物研究与开发),2011,23:606-611.
16 Shen N(沈楠),et al.Research on the anti-complement activity for Swordlike Atractylodes Rhizoma and Pepperweed seed of polysaccharides in different solvent extraction.Guide Chia Med(中国医药指南),2013,11:458-459.
17 Wu Y(吴彦),Wu GL(吴甘霖).Studies on anti-complementary activity of the polysaccharide from Herba Scutellariae Barbatae.Chin J Exp Tradit Med Form(中国实验方剂学杂志),2009(5):49-52.
18 Wang WP(王文平),et al.Isolation,Purification and anticomplement activity of water-soluble polysaccharides from Chaenomeles cathayensis.Food Sci(食品科学),2008,29:120-124.
19 Guo L(郭立).Effect of Bupleurum smithii on complement and rat acute lung injury.Shanghai:Fudan Univ(复旦大学),PhD.2008.
20 Xu H,et al.Isolation and characterization of an anti-complementary polysaccharide D3-S1 from the roots of Bupleurum smithii.Int Immunopharmacol,2007,7:175-182.
21 Lin JW(李进伟),Ding XL(丁霄霖).Study on biological vitality for ZiZyphus Jujuba cv.Jinsixiaozao polysaccharides.J Food Sci Biotechnol(食品与生物技术学报),2006,25:103-106.
22 He CM(何常明),Chen DF(陈道峰).Application of flavonoids in the preparation of anti-complement drugs.CN200910201362.6,2011-06-22.
23 Wu SQ(吴双庆).Studies on the constituents from Eupatorium lindleyanum DC.Suzhou:Suzhou Univ(苏州大学),PhD.2012.
24 Lee SY,et al.Flavonoids from the leaves of Litsea japonica and their anti-complement activity.Phytother Res,2005,19:273-276.
25 Ruan SN(阮姝楠),et al.Anti-complementary constituents of Pogostemon cablin.Chin J Chin Mater Med(中国中药杂志),2013,38:2129-2135.
26 Qiu M,et al.Anticomplement activity of cycloartane glycosides from the rhizome of Cimicifuga foetida.Phytother Res,2006,20:945-948.
27 Yang JO,et al.Isolation of anticomplementary substances from Cucurbita moschata Duch.J Food Sci,2002,67:1348-1351.
28 Lee IS,et al.Anticomplementary activity and complete13C NMR assignment of citrostadienol from Schizandra chinensis.Int J Pharmacogn,1997,35,358.
29 Gao HW(高红伟).The study of anticomplement activity of Aster ageratoides and Panax ginseng.Suzhou:Suzhou Univ(苏州大学),PhD.2013.
30 Lee S,et al.Anti-complementary activity of triterpenoides from fruits of Zizyphus jujuba.Biol Pharm Bull,2004,27:1883-1886.
31 Mu L,et al.Cycloartane Triterpenes from Beesia calthaefolia(Maxim.).Fitoterapia,2014,92:41-45.
32 Cui H(崔昊),Sun QY(孙黔云).Study on biological activity of extracts from Trimeresurus mucrosquamatus venom.J Guiyang Coll Tradit Chin Med(贵阳中医学院学报),2008,30(3):9-13.
33 Yan YP(闫银萍),Sun QY(孙黔云).Purification and characterization of a metallopteinase with anticomplementary activity from Trimeresurus mucrosquamatus venom.Chin Pharmacol Bull(中国药理学通报),2010,26:1220-1225.
34 Wang CE(王彩娥),et al.Inhibitory effect of anticomplementary protein atrasa B from cobra venom on platelet aggregation induced by activated complement.Chin Pharmacol Bull(中国药理学通报),2009,25:1205-1209.
35 Deng JJ(邓晋京),et al.Influence on thrombosis formation by inhibiting complement activation with cobra venmon factor in the rats after trauma.Chin J Crit Care Med(中国急救医学),2011,31:607-609.
36 Ji ES(季仁升),et al.Purification and characterization of a novel double-stranded serine protease from Protobothrops mucrosquamatus venom.Chin Pharmacol Bull(中国药理学通报),2011,27:818-823.
37 Song SY(宋荪阳),et al.Isolation and complement activity of glycogen from oyster glycogen.J Dalian Poly Univ(大连工业大学学报),2011,30:353-356.
38 Isao K,et al.T Complestatin,a potent anti-complement substance produced by Streptomyces lavendulae.I.Fermentation,isolation and biological characterization.J Antibiot,1989,42:236-241.
39 Singh SB,et al.The complestatins as HIV-1 integrase inhibitors.Efficient isolation,structure elucidation,and inhibitory activities of isocomplestatin,chloropeptin I,new complestatins,A and B,and acid-hydrolysis products of chloropeptin I.J Nat Prod,2001,64:874-882.
40 Zhao XQ,et al.Screening and identification of actinobacteria from marine sediments:Investigation of potential producers for antimicrobial agents and type I polyketides.World J Microb Biot,2009,25:859-866.
41 Zhao XQ,et al.Streptomyces xinghaiensis sp.nov.,isolated from marine sediment.Int J Syst Evol Micr,2009,59:2870-2874.
42 Zhao XQ(赵心清),et al.Studies on the five marine-derived actionmycete isolates from the sediment samples of dalian sea area.Amino Acids Biotic Resources(氨基酸和生物资源),2008,30(3):1-4.
43 Zhu HW(朱红薇).Anti-complementary constituents of Eucommia ulmoides and Arnebia euchroma.Shanhai:Fudan University(复旦大学),PhD.2008.
44 Quan GH,et al.Xanthone constituents of the fruits of Garcinia mangostana with anticomplement activity.Phytother Res,2010,24:1575-1577.
45 Moon HI,et al.Inhibitory effects of isolated compounds from black coloured rice bran on the complement classical pathway.Phytother Res,2011,25:1418-1420.
46 Zhao Q(赵琼),et al.Effects of an anticomplementary polyphenol from the seed of Toona sinensis on complement-injured SH-SY5Y cells.Chin Pharmacol Bull(中国药理学通报),2011,27:1086-1090.
47 Chung IM,et al.Anticomplement activity of polyacetylenes from leaves of Dendropanax morbifera Leveille.Phytother Res,2011,25:784-786.
48 Lv C(吕诚),et al.Effects of triptolide on the expressions of C1q and C3 after microinjection of beta-amyloid protein into cerebral cortex in rats.Chin J Gerontol(中国老年学杂志),2011,31:800-803.
49 Yao S(姚士),et al.Chemical constituents of Rabdosia japonica var.glaucocalyx and their anti-complementary activity.Chin J Chin Mater Med(中国中药杂志),2013,38:199-203.
50 Min B,et al.Two novel furan derivatives from Phellinus linteus with anti-complement activity.Bioorg Med Chem Lett,2006,16:3255-3257.
