马齿苋多糖对细胞存活率的影响及其毒性测定方法的比较研究
2015-01-11吴光杰李玉萍姚丽华王晨曦陈美琴
韩 笑,吴光杰,李玉萍*,姚丽华,王晨曦,陈美琴
1 江西科技师范大学生命科学学院;2 江西省生物加工过程重点实验室,南昌 330013
随着社会经济的快速发展和人类生活水平的提高,肥胖症的发病率也随之增高。与之密切相关的胰岛素抵抗、高脂血症、II 型糖尿病、心血管疾病等代谢性疾病已成为威胁人类健康的重要因素,有关降脂减肥功能性食品或药物的研发也因此越来越受到全社会的关注。研究表明,肥胖是由于脂肪细胞的数目增殖和分化异常,导致脂肪过度沉积所引起的一种病理改变;脂肪合成过程包括前脂肪细胞增殖和分化为成熟的脂肪细胞,而细胞的增殖是必需条件;抑制前脂肪细胞的增殖和分化可减少机体脂肪的沉积,是预防和治疗肥胖症的策略之一。因此,以脂肪细胞的增殖与分化为观测靶点,对筛选具有降脂减肥功能的活性成分以及开发功能性食品或药物都具有重要意义[1,2]。但由于动物实验耗时,耗力,难以满足不同浓度多糖的毒性实验,而体外细胞实验用时短,且重复性较好。3T3-L1 前脂肪细胞来源于小鼠胚胎成纤维细胞,在适当诱导条件下可分化成脂肪细胞,且在形态学变化、细胞生长、脂质积聚及脂肪代谢相关酶的表达等方面都能充分展示体脂肪细胞的特点[3],被广泛用于体外筛选和评价调脂减肥功能性成分的模式细胞。
马齿苋(Portulaca oleracea L.)是药食同源植物,马齿苋多糖(Portulaca oleracea L.polysaccharides,POPs)是马齿苋中主要功能因子之一,具有抗菌消炎、降糖、调脂、抗氧化等多种功效,具有开发成调脂降糖功能食品或减肥药物的潜力[4]。但用于细胞学的体外研究细胞存活的方法很多,而MTT 是最早报道且应用最广泛的方法。中性红检测方法受外界条件影响较小,因中性红可以滞留溶酶体内而不被细胞洗涤液洗脱。乳酸脱氢酶检测方法分析灵敏、方便、精确,适用于许多种细胞毒性分析。本研究从体外以3T3-L1 前脂肪细胞和POP 为研究对象,对比四甲基偶氮唑盐(methl thiazolyl tetrazolium,MTT)比色法、中性红染料摄取(neutral red uptake,NRU)法和乳酸脱氢酶(lactate dehydrogenase,LDH)释放法,从细胞的细胞器、膜完整性、代谢能力等方面评价POP 抑制3T3-L1 前脂肪细胞增殖的敏感性,为体外快速筛选调脂减肥多糖活性成分提供方法参考,并为探讨POP 改善与肥胖相关的糖尿病、胰岛素抵抗等疾病的作用机制提供基础理论依据,尚未见马齿苋多糖对细胞毒性方面的相关报道。
1 材料与方法
1.1 材料与试剂
新鲜的野生马齿苋购于南昌市农贸市场,经江西科技师范大学药学院药理学教研室鉴定;3T3-L1前脂肪细胞系由江西省天然产物与功能食品重点实验室郑国栋博士友好赠送;胰蛋白酶、中性红细胞增殖及细胞毒性检测试剂盒、乳酸脱氢酶细胞毒性检测试剂盒和青霉素-链霉素溶液均购于碧云天公司;Dulbecco’s modified Eagle’s medium(DMEM)干粉购于Gibco 公司;3-[4,5-dimethylthiazol-2-yl]-2,5-diphenyltetrazolium bromide thiazolyl blue(MTT)和二甲基亚砜购于Amresco 公司;胎牛血清(fetal bovine serum,FBS)购于杭州四季青生物工程材料有限公司;其它试剂为国产分析纯。
1.2 仪器与设备
HV-85 型高压灭菌锅 日本Hirayama 公司;生物安全柜(Forma class-II/A2)和Forma 3111 系列CO2培养箱(Thermo Forma Series-Ⅱ)美国Thermo 公司;96 孔细胞培养板 美国Corning 公司;IX-71 型倒置荧光显微镜 日本Olympus 公司;全自动酶标仪(Multiscan Mk-3 型)美国Labsystems 公司;离心机(5804R 型)德国Eppendorf 公司;超纯水系统(Milli-Q Synthesis Millipore)美国Millipore 公司。
1.3 实验方法
1.3.1 马齿苋多糖的提取、分离及纯化
采用水提醇沉法、Sevag 法脱蛋白、大孔树脂AB-8 脱色(其中5 mg/mL 马齿苋多糖溶液脱色工艺的最佳条件为:AB-8 大孔吸附树脂用量为60 g/L、脱色时间为207 min、脱色温度为50 ℃[5]。)等方法得到马齿苋粗多糖(提取率为24.25%),并用DEAE-52 纤维素柱层析分离和Sephadex G-100 凝胶过滤层析柱进行纯化。具体操作方法见本课题组吴光杰等的研究报道[6]。
1.3.2 细胞形态观察
将对数生长期的3T3-L1 前脂肪细胞(2×104个/mL)接种于96 孔培养板,贴壁生长48 h 后,用磷酸盐缓冲液(phosphate-buffered saline,PBS)洗涤,空白对照组更换新鲜DMEM 完全培养液(含10%FBS),其余各实验组分别更换含有不同浓度POP 的DMEM 完全培养液(0.01、0.03、0.06、0.125、0.25、0.5 mg/mL)继续培养至预定时间(1、3、5 d),分别平放在倒置显微镜下进行拍照及观察。
1.3.3 MTT 比色法
将对数生长期的3T3-L1 前脂肪细胞(2×104个/mL)接种于96 孔培养板,贴壁生长48 h 后,用磷酸盐缓冲液(phosphate-buffered saline,PBS)洗涤,空白对照组更换新鲜DMEM 完全培养液(含10%FBS),其余各实验组分别更换含有不同浓度POP 的DMEM 完全培养液(0.01、0.03、0.06、0.125、0.25、0.5 mg/mL)继续培养至预定时间(1、3、5 d)后,吸去培养上清液,添加新鲜DMEM 培养液,用MTT 法检测POP 对细胞生存能力的影响。用酶联免疫检测仪测定吸光度(λ=492 nm),与空白对照组相比较,计算各实验组的细胞相对增殖率。
1.3.4 NRU 检测法
细胞的前培养同方法1.3.3。在更换不同培养液培养至预定时间(1、3、5 d)后,吸去培养上清液,用PBS 洗涤后,根据中性红细胞增殖及细胞毒性检测试剂盒说明书进行中性红摄取量的检测。用酶标仪测定吸光度(λ=540 nm),通过计算中性红摄取率间接反映细胞膜的完整性和细胞相对存活率。
1.3.5 LDH 释放检测法
细胞的前培养同方法1.3.3。用PBS 清洗后,各实验组更换含有不同浓度POP 的DMEM 培养液(1% FBS)。同时,设阴性对照组(未经任何处理的对照细胞组)、阳性对照组(经终浓度为10%的LDH释放试剂处理1 h 组),继续培养至预定时间后,将细胞培养板用多孔板离心机以400 g 离心5 min。轻轻吸取一定量的上清液至另一96 孔培养板中,根据乳酸脱氢酶细胞毒性检测试剂盒的说明书进行测定。用酶标仪测定吸光度(λ=492 nm),计算细胞相对死亡率。
1.4 统计学处理
实验所得数据以平均数±标准差表示,多组间比较用SPSS 17.0 进行描述性统计。P<0.05 被认为有显著性差异并具有统计学意义。
2 结果与分析
2.1 POP 影响3T3-L1 前脂肪细胞形态的显微观察
形态学观察是最早用于定性细胞损伤的检测方法。本研究中,不同浓度POP 处理3T3-L1 细胞后,1 d 内POP 处理组和对照组的细胞一样,贴壁、细胞呈梭形或多角形、无圆缩漂浮细胞;随着培养时间延长,空白对照组细胞大量增殖,排列密集,而POP 处理组细胞密度明显减小,但无细胞固缩、漂浮等现象。然而,当POP 浓度增加到0.5 mg/mL 时,随着处理时间延长(3 d 和5 d),可见部分细胞固缩、漂浮、裂解碎片,死亡细胞数明显多于空白对照组和POP 低浓度处理组,5 d 后细胞几乎漂浮死亡。
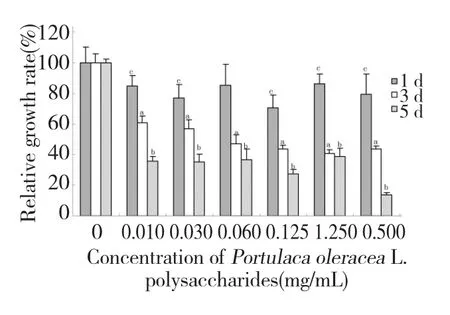
图1 马齿苋多糖对3T3-L1 前脂肪细胞相对增殖力的影响Fig.1 Effects of POPs on cell relative growth rate(RGR)of 3T3-L1 preadipocytes
2.2 不同方法检测POP 对3T3-L1 细胞增殖的影响
2.2.1 MTT 比色法评价
MTT 比色法是一种通过检测线粒体活性来间接反应细胞存活和增殖的常用方法。由图1 可知,在试验浓度范围内,POP 具有抑制3T3-L1 前脂肪细胞相对增殖的能力(P<0.05),并显示随处理时间(1、3、5 d)延长而抑制能力增强的趋势,随着多糖浓度的增加,整体呈现下降趋势。本研究结果再一次证实了一定浓度范围的POP 对3T3-L1 前脂肪细胞增殖具有明显的抑制作用。
然而,当用0.5 mg/mL POP 处理细胞5 d 时,出现大量细胞漂浮、裂解、死亡,细胞相对增殖率显著减小(P<0.001),说明了高浓度POP(≥0.5 mg/mL)对3T3-L1 前脂肪细胞有细胞毒性作用。
2.2.2 NRU 法评价
由图2 可知:各个浓度的POP 处理1 d 时,3T3-L1 细胞摄入中性红染料的量和对照组相比无显著性差异,随着处理时间延长(3 d 和5 d),3T3-L1 细胞摄入中性红染料的量随着细胞增殖抑制而减少(P<0.001)。这个结果与MTT 法和显微观察法检测结果存在较大差异。MTT 法和显微观察法均显示,在处理时间内(1、3、5 d),各个浓度的POP 均能明显抑制细胞增殖,且当用0.5 mg/mL POP 处理细胞5 d 时会导致3T3-L1 前脂肪细胞大量死亡;而NRU 法却未显示出同样的抑制增殖作用和细胞毒性。说明MTT 方法在检测POP 与3T3-L1 前脂肪细胞反应性方面较NRU 法更为敏感。
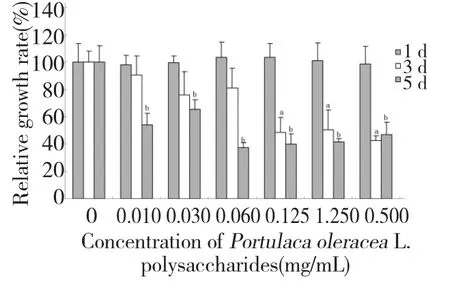
图2 马齿苋多糖对3T3-L1 前脂肪细胞中性红染料摄取率的影响Fig.2 Effects of POPs on NRU rate of 3T3-L1 preadipocytes
2.2.3 LDH 释放法评价
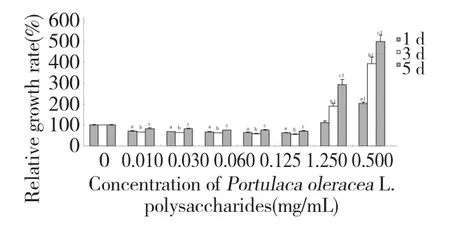
图3 马齿苋多糖对3T3-L1 前脂肪细胞致死率的影响Fig.3 Effects of POPs on relative death rate of 3T3-L1 preadipocytes
结果显示:用LDH 释放试剂处理3T3-L1 细胞1 h 后,在不同培养时间点(1、3、5 d)均导致细胞培养液上清中的LDH 显著升高,分别超过空白对照组的2 倍、4 倍和5 倍。当用0.01~0.25 mg/mL 的POP分别处理1 d、3 d 和5 d 时,LDH 的释放率明显低于空白对照组(P<0.05),说明POP 对3T3-L1 细胞的细胞膜具有保护作用;但当浓度增加到0.5 mg/mL时,LDH 释放明显增多,在POP 处理细胞3 d 和5 d时,LDH 释放率分别是对照组的2 倍和3 倍(P<0.001)。结果表明:高浓度的POP 对3T3-L1 细胞存在毒性作用,对细胞膜有较强的损伤作用(图3)。这个结果与形态学观察结果(细胞固缩、悬浮和死亡)和MTT 法检测结果相符合。
2.3 三种毒性评价方法的实验结果比较
分别以三个检测时间点(1 d、3 d、5 d)获得了相应的剂量-反应关系(表1~4)。与中性红法相比,LDH 法和MTT 法对细胞增殖活性的影响更为敏感。随着POP 处理浓度的升高,细胞增殖活性明显降低,显示POP 抑制脂肪细胞增殖的生物活性。如表1 所示,处理1 d 时,LDH 法测定0.25 mg/mL 剂量组的细胞存活率仅为63.58%,MTT 法测定结果为86.03%,而中性红法的存活率达101.04%。

表1 马齿苋多糖处理1 d 后三种毒性试验测定细胞活性结果Table 1 The cell viability results of the three cytotoxicity assays after 1 d exposure to POPs

表2 马齿苋多糖浓度与三种检测方法的相关性Table 2 The correlation of concentration of POPs and results of 3 cytotoxicity assays after 1 d exposure to POPs
由表1 和表2 方差分析可以看出,不同浓度下的马齿苋多糖作用3T3-L1 前脂肪细胞24 h,三种方法均有显著性差异。
从表3 中可以看出,当POP 处理至3 d 时,0.25 mg/mL 剂量组的细胞存活率中MTT 法、LDH 法和NRU 法分别下降至40.88%、56.86%和50.59%。但是,当处理浓度继续增大(≥0.5 mg/mL)时,LDH值显著高于空白对照组,显微镜下可见3T3-L1 前脂肪细胞出现明显的固缩、漂浮、裂解现象,呈现明显的细胞毒性作用。从表4 中也可看见类似的结果。
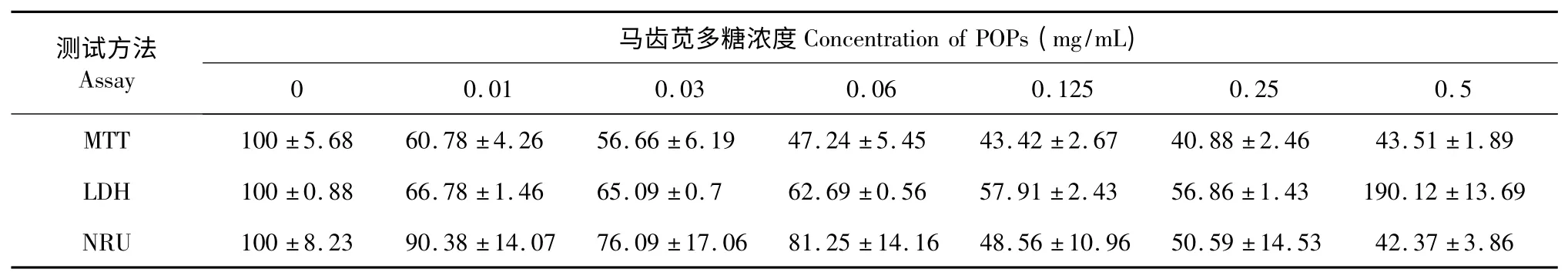
表3 马齿苋多糖处理3 d 后三种毒性试验测定细胞活性结果Table 3 The cell viability results of the 3 cytotoxicity assays after 3 d exposure to POP
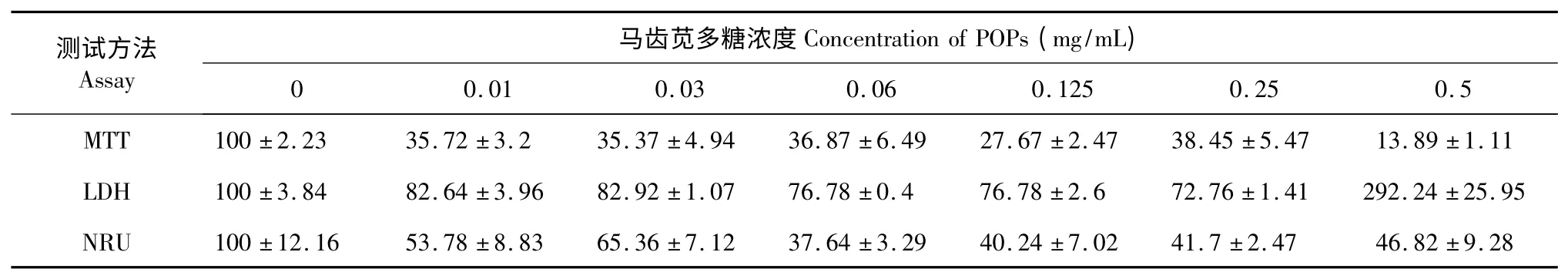
表4 马齿苋多糖处理5 d 后三种毒性试验测定细胞活性结果Table 4 The cell viability results of the three cytotoxicity assays after 5 d exposure to POP
3 讨论
在预防或治疗肥胖以及与肥胖高度关联的胰岛素抵抗、高血压、动脉粥样硬化和Ⅱ型糖尿病等疾病时,常把抑制前脂肪细胞的增殖和分化、抑制脂肪蓄积作为策略之一。因此,许多研究者致力于从天然产物中筛选具有调控脂肪细胞增殖及分化、抑制脂肪蓄积功能的化合物[4]。在快速筛选试验中,3T3-L1 前脂肪细胞作为模式细胞被广泛应用。通过观察待测物对3T3-L1 前脂肪细胞增殖及分化、代谢能力等的影响,以此来初步判断待测物是否具有调控脂肪细胞分化异常和减肥的作用。
利用体外细胞培养法因其具有简便、经济、敏感度高、耗时短等优点,被广泛用于抗癌、减肥、降糖等生物活性成分的功能及安全性评价的初筛[7-9]。目前常用的细胞培养毒性试验包括:细胞形态及化学染料法、细胞代谢活性(MTT 法)、细胞膜效应(LDH法、NRU 法)等。但是,在实际应用过程中,每种方法对不同细胞和不同毒性敏感度不同,导致细胞毒性评价得到不少彼此矛盾的结果。孙健等[9]用MTT 法、CCK-8 法等五种方法评价绿原酸和白藜芦醇对中国仓鼠卵巢(CHO)细胞毒性时,也发现不同方法在相同浓度下所得结果之间有显著性差异,MTT 法的变异系数分别为5.54%和5.04%。本次研究旨在对比三种目前常用的细胞毒性实验方法(MTT 法、LDH 法和NRU 法),以期为研究脂肪细胞增殖检测提供较为敏感的检测方法,同时为进一步的作用机制研究提供参考。
在本研究中,三种检测方法的测定结果出现明显的差异性。在POP 处理1 d 时,LDH 法和MTT 法测定的结果为,POP 对3T3-L1 前脂肪细胞具有明显的浓度依存性抑制作用;而NRU 法测定结果则显示,随着处理浓度的增加,细胞增殖率与空白对照组相比无明显变化,无抑制作用,说明LDH 及MTT 法均比NRU 法较为敏感。但是随着POP 处理时间延长至3 d 时,三种测定方法的结果很接近,均显示POP 对脂肪细胞的增殖有明显的抑制作用。而且当POP 浓度≥0.5 mg/mL 时,LDH 释放率显著高于空白对照组,表现出和阳性对照组(LDH 释放剂处理组)同样的细胞毒性作用,说明LDH 释放法敏感性>MTT 法。而NRU 法在POP 处理5 d 时才显示细胞毒性作用。由此可知,不同浓度的POP 作用于3T3-L1 前脂肪细胞不同时间点,用NRU 法没有检测出和MTT 法及LDH 法相似的结果,说明NRU 法针对POP 实验材料和3T3-L1 前脂肪细胞作用对象而言不敏感或者不适合。三种检测方法的敏感度顺序为:LDH 释放法>MTT 法>NRU 法。此外,通过细胞显微形态学观察,发现和MTT 法及LDH 法相似的结果,为待检化合物的细胞安全性提供直观的证据。
本研究采用三种不同的细胞毒性试验测定不同浓度的POP 作用于3T3-L1 前脂肪细胞不同时间的结果有明显差异,造成这种结果的原因可能是因为三种细胞毒性试验检测的毒性指标的不同。LDH法通过检测细胞膜的完整性来测定死亡细胞的数量。当特定环境导致细胞膜损伤时,存在胞浆中的LDH 会快速透过细胞膜释放到细胞外,故可通过测定细胞培养液中LDH 活性来间接反映细胞膜受损程度,培养液中LDH 释放率与死亡细胞数量成正相关。MTT 法根据线粒体琥珀酸脱氢酶与MTT 的结合能力来测定细胞活性。活细胞中的线粒体琥珀酸脱氢酶能使黄色的MTT 还原成不溶于水的蓝紫色甲瓒沉积在细胞中,而死细胞无此功能。DMSO 可使甲瓒结晶溶解显色,其颜色的深浅与活细胞数目和代谢活性呈正相关。NRU 法通过胞吞作用来测定活细胞溶酶体中摄入染料的量间接表示存活细胞数量。中性红染料可被活细胞摄入,并在溶酶体中积累,而死细胞无此功能。通过定量检测所摄入中性红的水平,间接判定活细胞的数量。Weyermann等[8]对MTT 法、LDH 法和NRU 法三种试验方法进行了比较,结果发现LDH 试验对于细胞膜完整性的破坏较敏感,而对于影响细胞内活动的一些毒性物质反应不敏感;MTT 比色法主要对影响线粒体酶活性的毒性反应敏感,NRU 法主要对于导致溶酶体破坏的细胞毒性反应灵敏。通过比较本研究中各试验结果的差异及三种检测方法的敏感度顺序,可以推断POP 对3T3-L1 前脂肪细胞的短期作用机制与细胞膜和线粒体功能有关,且可影响3T3-L1 前脂肪细胞内溶酶体的功能。至于这种影响是通过何途径调控,尚待进一步研究。
综上所述,POP 对3T3-L1 前脂肪细胞的增殖抑制或毒性作用可以通过MTT 试验、LDH 释放检测和中性红摄入试验这三种体外细胞毒性试验来表示。但不同检测方法显示出了不同的敏感性。因此,在评价毒性作用机理尚不明确的待检化合物时,可根据“最接近应用状况、多种评价方法结合应用”的原则,合理地选择样品浓度、处理时间、细胞类型、与细胞的接触方式和检测生物学终点的评价指标或评价方法,综合评价功能因子或药物先导化合物的功效或毒性,以增加结果的可信度。
1 Poulos SP,Dodson MV,Hausman GJ.Cell line models for differentiation:preadipocytes and adipocytes.Experimental Biology and Medicine,2010,235:1185-1193.
2 Rayalan S,Della-Fera MA,Baile CA.Phytochemicals and regulation of the adipocyte life cycle.J Nutr Biochem,2008,19:717-726.
3 Green H,Meuth M.An established preadipose cell line and its differentiation in culture.Cell,1974,3:127-133.
4 Li FL(李凤林),Li QW(李青旺),Geng GX(耿果霞),et al.Effects of polysaccharide of Portulaca oleracea L.on factors related to glucose and lipid metabolism in diabetic mice.J Northwest A&F Univ(西北农林科技大学学报),2012,4:15-20.
5 Wu GJ(吴光杰),Li YP(李玉萍),Pi XF(皮小芳),et al.Optimization of decoloration technology of polysaccharides from Portulace oleracea L.by response surface methodology.Food Science and Technology(食品科技),2011,36:166-168.
6 Wu GJ(吴光杰),Li YP(李玉萍),Pi XF(皮小芳),et al.Optimization of polysaccharides extraction process from Portulace oleracea L.by response surface methodology.Food &Machinery(食品与机械),2010,26:129-133.
7 Sylbester PW.Optimization of the tetrazolium dye(MTT)colorimetric assay for cellular growth and viability.Methods Mol Biol,2011,716:157-168.
8 Weyermann J,Lochmann D,Zimmer A.A practical note on the use of cytotoxicity assays.Int J Pharm,2005,288:369-376.
9 Sun J(孙健),Mei J(梅晶),Zhao XH(赵晓红),et al.Effects of Bioactive Plant Components on Cell Viability and Comparison of Cell Viable Assays.Food Science,2012,33:119-123.
